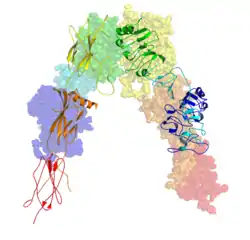
Инсулиновый рецептор
Инсулиновый рецептор (IR) (англ. insulin receptor) — трансмембранный рецептор, который активируется инсулином, IGF-I, IGF-II и принадлежит к большому классу тирозинкиназных рецепторов[1]. Инсулиновый рецептор играет ключевую роль в регуляции гомеостаза глюкозы, функционального процесса, который при дегенеративных условиях может привести к ряду клинических проявлений, в том числе диабету и раку[2][3]. Биохимически инсулиновый рецептор кодируется одним геном INSR, альтернативный сплайсинг которого в ходе транскрипции производит либо к IR-A-либо к IR-B-изоформам[4]. Последующие посттрансляционные события каждой изоформы приводят к формированию протеолитически расщеплённых α и β-субъединиц, которые при объединении, в конечном счете способны к димеризации с получением дисульфидно связанного трансмембранного инсулинового рецептора массой ≈ 320 кДа[4].
Структура
Первоначально транскрипты альтернативных вариантов сплайсинга гена INSR транслируются с образованием одного из двух мономерных изомеров: IR-A, в котором вырезан экзон 11, и IR-B, в котором есть экзон 11. Включение экзона 11 приводит к добавлению 12 аминокислот выше фурина в сайте протеолитического расщепления.
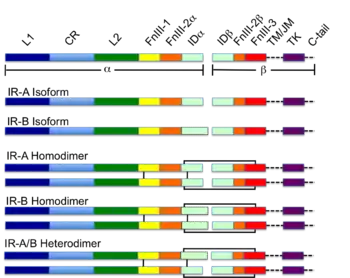
При димеризации рецептора, после протеолитического расщепления α- и β-цепей, дополнительные 12 аминокислот остаются на С-конце α-цепи (обозначенной αCT), где они предположительно влияют на взаимодействия рецептора и лиганда[5].
Каждый изомерический мономер структурно разбит на 8 различных доменов; домен лейцин-обогащённых повторов (L1, остатки 1-157), регион, богатый цистеином (CR, остатки 158—310), дополнительный домен лейцин-обогащённых повторов (L2, остатки 311—470), три типа доменов фибронектина III; FnIII-1 (остатки 471—595), FnIII-2 (остатки 596—808) и FnIII-3 (остатки 809—906). Кроме того, вставной домен (ID, остатки 638—756), находящийся в пределах FnIII-2, содержащий сайт расщепления α/β фурина, протеолиз которого действуют как в IDα- так и IDβ-доменах. В β-цепи ниже области FnIII-3 находится трансмембранная спираль и внутриклеточная околомембранная область, непосредственно выше внутриклеточного каталитического тирозинкиназного домена, ответственного за активацию внутриклеточных сигнальных путей[6]. При расщеплении мономера на соответствующие α- и β-цепи рецептор гомо- или гетеродимеризуется через ковалентно дисульфидную связь, а между мономерами в димере образуется две дисульфидные связи, идущие от каждого α-цепи. Общая структура 3D эктодомена, обладает четырьмя сайтами связывания лиганда, напоминает перевернутую V. Каждый мономер поворачивается примерно 2 раза вокруг оси, проходящей параллельно перевернутой V, L2 и FnIII-1 доменам от каждого мономера, формирующего вершину перевернутой V[6][7].
Связывание лиганда
Эндогенные лиганды инсулинового рецептора включают инсулин, IGF-I и IGF-II. Связывание лиганда с α-цепями эктодомена IR вызывает структурные изменения в рецепторе, ведущие к автофосфорилированию различных остатков тирозина во внутриклеточном домене TK в β-цепи. Эти изменения способствуют рекрутированию определенных адаптерных белков, таких как белки субстрата инсулинового рецептора (IRS) в дополнение к SH2-B (гомолог Src 2 — B), APS и протеинфосфатазы, таких как PTP1B, в конечном итоге, способствующих последующим процессам, связанным с гомеостазом глюкозы в крови[8].
Строго говоря, отношения между инсулиновым рецептором и лигандом показывают сложные аллостерические свойства. На это указывает график Скэтчарда который показывает, что измеренное соотношение инсулинового рецептора, связанного с лигандом, относительно несвязанного лиганда не следует линейной зависимости относительно изменений концентрации инсулинового рецептора, связанного с лигандом, давая основание предположить, что инсулиновый рецептор и его лиганд взаимодействуют по механизму кооперативно связаны[9]. Кроме того, наблюдение, что скорость диссоциации IR-лиганда увеличивается при добавлении несвязанного лиганда предполагает, что природа этого сотрудничества отрицательна; иначе говоря, начальное связывание лиганда с IR ингибирует дополнительное связывание со своим вторым активным сайтом, демонстрируя аллостерическое ингибирование[9].
Хотя точный механизм связывания IR с его лигандом структурно ещё не выяснен, с точки зрения системной биологии, биологически значимое предсказание кинетики IR-лиганд (инсулин/IGF-I) было определено в контексте доступной в настоящий момент структуры эктодомена IR[6][7].
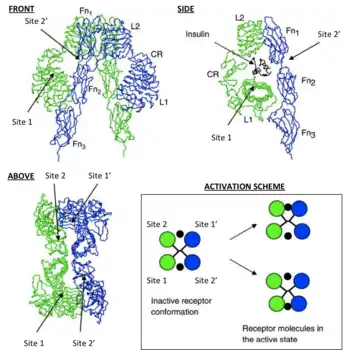
Эти модели утверждают, что каждый мономер IR имеет 2 инсулиновых сайта связывания; Сайт 1, который связывается с «классической» поверхностью связывания инсулина: состоящей из L1 плюс αCT доменов и сайта 2, состоящий из петель на стыке FnIII-1 и FnIII-2, по прогнозам, связывающихся с «новым» гексамерным лицом сайта связывания инсулина[1]. Так как каждый мономер предоставляет IR эктодомену представление 3D «зеркальной» взаимодополняемости, N-терминальный сайт 1 из одного мономера, в конечном счете сталкивается с C-терминальным сайтом 2 второго мономера, что также верно для каждого зеркального дополнения мономеров (противоположная сторона структуры эктодомена). Текущая литература отличает сайты связывания дополнений, назначив на сайте 1 и 2 мономерные сайты дополнений, как 3 и 4 или как сайт 1' и 2' соответственно[1][10].
Таким образом, эти модели утверждают, что каждый IR может связываться с молекулой инсулина (который имеет две связывающих поверхности) в 4 местах, посредством сайтов 1, 2, (3/1') или (4/2'). Поскольку каждый сайт 1 проксимально сталкивается с сайтом 2, по прогнозам, произойдет связывания инсулина конкретным сайтом, «сшивание» с помощью лиганда между мономерами, (то есть [мономер 1 Сайт 1 — Инсулин — мономер 2 сайт (4/2')] или [мономер 1 сайт 2 — Инсулин — мономер 2-сайт (3/1')]). В соответствии с действующим математическим моделированием IR-инсулиновой кинетики, есть два важных последствия для событий сшивания инсулина; 1. в вышеупомянутом наблюдении отрицательное взаимодействие IR и его лиганда, после связывания лиганда с IR снижается и 2. физическое воздействие приводит к сшиванию эктодомена в такой конформации, которая необходима для наступления событий внутриклеточного фосфорилирования тирозина (то есть эти события служат требованием к активации рецептора с последующим поддержанием гомеостаза глюкозы в крови)[8].
Биологическое значение
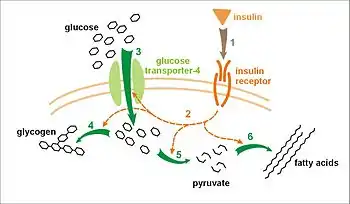
Рецепторы тирозинкиназы, в том числе инсулиновый рецептор, опосредуют свою активность, вызывая добавление фосфатной группы к конкретным тирозинам в клетках определенных белков. В «подложке» белки, которые фосфорилируются инсулиновым рецептором включает белок, называемый «IRS-1» для «инсулинового рецептора подложки 1». Связывания и фосфорилирования IRS-1 в конечном итоге приводит к увеличению высокого сродства молекул транспортёра глюкозы (GLUT4) на внешней мембране инсулиночувствительных тканей, в том числе мышечных клеток и жировой ткани, и, следовательно, к увеличению поглощения глюкозы из крови в этих тканях. Другими словами, глюкозный транспортёр GLUT4 транспортируется из клеточных везикул к клеточной поверхности, где он затем может опосредовать транспорт глюкозы в клетку.
Патология
Основная деятельность активации инсулинового рецептора — индуцировать поглощение глюкозы. По этой причине «нечувствительность инсулина», или снижение сигнализации инсулинового рецептора, приводит к сахарному диабету 2 типа — клетки неспособны принять глюкозу и в результате — гипергликемия (повышение циркуляции глюкозы) и все последствия диабета.
Пациенты с инсулинорезистентностью могут иметь признаки чёрного акантоза.
Несколько пациентов с гомозиготной мутацией гена INSR были описаны, как получившие синдром Донохью. Это аутосомно-рецессивные нарушения делают совершенно нефункциональными инсулиновые рецепторы. Эти пациенты имеют низкорасположенные, часто выпуклые, уши, ноздри, утолщенные губы и сильную задержку роста. В большинстве случаев, прогноз для этих пациентов является крайне бедным, смертельный исход случается в течение первого года жизни. Другие мутации того же гена вызывают менее тяжелый синдром Робсона-Менденхолла, при которых пациенты имеют характерно аномальные зубы, гипертрофированные дёсны и расширение шишковидной железы. Оба заболевания представляют флуктуацию уровня глюкозы: после приема пищи глюкоза изначально очень высока, а затем резко падает до аномально низких уровней[11].
Регуляция экспрессии генов
Активированные IRS-1 действуют в качестве вторичного мессенджера в клетке, чтобы стимулировать транскрипцию инсулинорегулируемых генов. Во-первых, белок Grb2 связывает Р-Tyr остаток IRS-1 в его домене SH2. Grb2 становится в состоянии связать SOS, который в свою очередь катализирует замену связанного GDP с GTP в Ras, G-белка. Этот белок затем начинает каскад фосфорилирования, что приводит к активации митогеноактивируемой протеинкиназы (МАРК), которая входит в ядро и фосфорилирует различные факторы ядерной транскрипции (например, Elk1).
Стимуляция синтеза гликогена
Синтез гликогена также стимулируется инсулиновым рецептором с помощью IRS-1. В этом случае это SH2-домен из киназы PI-3 (PI-3K), который связывает P-Tyr из IRS-1. Теперь активации PI-3K может конвертировать мембранные липидные фосфатидилинозитол 4,5-бисфосфата (PIP2) до фосфатидилинозит 3,4,5-трифосфата (PIP3). Это косвенно активирует протеинкиназу PKB (Akt) с помощью фосфорилирования. РКВ затем фосфорилирует несколько целевых белков, в том числе киназу гликогенсинтазы 3 (GSK-3). GSK-3 несёт ответственность за фосфорилирование (и, следовательно, деактивацию) гликогенсинтазы. Когда GSK-3 фосфорилируется, он отключается, и предотвращается деактивации гликогенсинтазы. Этим окольным путём инсулин увеличивает синтез гликогена.
Деградация инсулина
После того как молекула инсулина стыкуется с рецептором и активирует его, она может быть выпущена обратно во внеклеточную среду, или может быть деградирована в клетке. Деградация обычно включает эндоцитоз инсулино-рецепторного комплекса с последующим действием фермента, разрушающего инсулин. Большинство молекул инсулина деградируют в клетках печени. Было подсчитано, что типичная молекула инсулина деградирует приблизительно через 71 минуту после первоначального выпуска в кровоток[12].
Взаимодействия
Инсулиновый рецептор, как было выявлено, взаимодействует с ENPP1[13], PTPN11[14][15], GRB10[16][17][18][19][20], GRB7[21], PRKCD[22][23], IRS1[24][25], SH2B1[26][27] и MAD2L1[28].
Примечания
- Ward C.W., Lawrence M.C. Ligand-induced activation of the insulin receptor: a multi-step process involving structural changes in both the ligand and the receptor (англ.) // BioEssays : journal. — 2009. — April (vol. 31, no. 4). — P. 422—434. — doi:10.1002/bies.200800210. — PMID 19274663.
- Ebina Y., Ellis L. The human insulin receptor cDNA: the structural basis for hormone-activated transmembrane signalling. (англ.) // Cell : journal. — Cell Press, 1985. — April (vol. 40, no. 4). — P. 747—758. — doi:10.1016/0092-8674(85)90334-4. — PMID 2859121.
- Malaguarnera R., Belfiore A. Proinsulin Binds with High Affinity the Insulin Receptor Isoform A and Predominantly Activates the Mitogenic Pathway. (англ.) // Endocrinology. : journal. — 2012. — February (vol. Epub, no. 5). — P. 2152—2163. — doi:10.1210/en.2011-1843. — PMID 22355074.
- Belfiore A., Frasca F. Insulin receptor isoforms and insulin receptor/insulin-like growth factor receptor hybrids in physiology and disease. (англ.) // Endocrine Reviews : journal. — Endocrine Society, 2009. — October (vol. 30, no. 6). — P. 586—623. — doi:10.1210/er.2008-0047. — PMID 19752219.
- Knudsen L., De Meyts P., Kiselyov VV. Insight into the molecular basis for the kinetic differences between the two insulin receptor isoforms. (англ.) // Biochemical Journal : journal. — 2012. — February (vol. 440, no. 3). — P. 397—403. — doi:10.1042/BJ20110550. — PMID 21838706.
- Smith B.J., Huang K. Structural resolution of a tandem hormone-binding element in the insulin receptor and its implications for design of peptide agonists. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2010. — April (vol. 107, no. 15). — P. 6771—6776. — doi:10.1073/pnas.1001813107. — . — PMID 20348418.
- McKern N.M., Lawrence M.C., Ward CW et al. Structure of the insulin receptor ectodomain reveals a folded-over conformation. (англ.) // Nature : journal. — 2006. — September (vol. 7108, no. 443). — P. 218—221. — doi:10.1038/nature05106. — . — PMID 16957736.
- Kiselyov V.V., Versteyhe S., Gauguin L., De Meyts P. Harmonic oscillator model of the insulin and IGF1 receptors' allosteric binding and activation. (англ.) // Mol Syst Biol. : journal. — 2009. — February (vol. 253, no. 5). — doi:10.1038/msb.2008.78. — PMID 19225456.
- de Meyts P., Roth J., Neville DM Jr, Gavin JR 3rd, Lesniak M.A. Insulin interactions with its receptors: experimental evidence for negative cooperativity. (англ.) // Biochemical and Biophysical Research Communications : journal. — 1973. — November (vol. 55, no. 1). — P. 154—161. — doi:10.1016/S0006-291X(73)80072-5. — PMID 4361269.
- Kiselyov V.V., Versteyhe S., Gauguin L., De Meyts P. Harmonic oscillator model of the insulin and IGF1 receptors' allosteric binding and activation. (англ.) // Mol Syst Biol. : journal. — 2009. — February (vol. 253, no. 5). — doi:10.1038/msb.2008.78. — PMID 19225456.
- Longo N., Wang Y., Smith S.A., Langley S.D., DiMeglio L.A., Giannella-Neto D. Genotype-phenotype correlation in inherited severe insulin resistance (англ.) // Human Molecular Genetics : journal. — Oxford University Press, 2002. — Vol. 11, no. 12. — P. 1465—1475. — doi:10.1093/hmg/11.12.1465. — PMID 12023989.
- Duckworth W.C., Bennett R.G., Hamel F.G. Insulin degradation: progress and potential (англ.) // Endocrine Reviews. — Endocrine Society, 1998. — Vol. 19, no. 5. — P. 608—624. — doi:10.1210/er.19.5.608. — PMID 9793760.
- Maddux, B A; Goldfine I D. Membrane glycoprotein PC-1 inhibition of insulin receptor function occurs via direct interaction with the receptor alpha-subunit (англ.) // Diabetes : journal. — UNITED STATES, 2000. — January (vol. 49, no. 1). — P. 13—9. — ISSN 0012-1797. — doi:10.2337/diabetes.49.1.13. — PMID 10615944.
- Maegawa, H; Ugi S; Adachi M; Hinoda Y; Kikkawa R; Yachi A; Shigeta Y; Kashiwagi A. Insulin receptor kinase phosphorylates protein tyrosine phosphatase containing Src homology 2 regions and modulates its PTPase activity in vitro (англ.) // Biochemical and Biophysical Research Communications : journal. — UNITED STATES, 1994. — March (vol. 199, no. 2). — P. 780—785. — ISSN 0006-291X. — doi:10.1006/bbrc.1994.1297. — PMID 8135823.
- Kharitonenkov, A; Schnekenburger J; Chen Z; Knyazev P; Ali S; Zwick E; White M; Ullrich A. Adapter function of protein-tyrosine phosphatase 1D in insulin receptor/insulin receptor substrate-1 interaction (англ.) // Journal of Biological Chemistry : journal. — UNITED STATES, 1995. — December (vol. 270, no. 49). — P. 29189—29193. — ISSN 0021-9258. — doi:10.1074/jbc.270.49.29189. — PMID 7493946.
- Langlais, P; Dong L Q; Hu D; Liu F. Identification of Grb10 as a direct substrate for members of the Src tyrosine kinase family (англ.) // Oncogene : journal. — ENGLAND, 2000. — June (vol. 19, no. 25). — P. 2895—2903. — ISSN 0950-9232. — doi:10.1038/sj.onc.1203616. — PMID 10871840.
- Hansen, H; Svensson U; Zhu J; Laviola L; Giorgino F; Wolf G; Smith R J; Riedel H. Interaction between the Grb10 SH2 domain and the insulin receptor carboxyl terminus (англ.) // Journal of Biological Chemistry : journal. — UNITED STATES, 1996. — April (vol. 271, no. 15). — P. 8882—8886. — ISSN 0021-9258. — doi:10.1074/jbc.271.15.8882. — PMID 8621530.
- Liu, F; Roth R A. Grb-IR: a SH2-domain-containing protein that binds to the insulin receptor and inhibits its function (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — UNITED STATES, 1995. — October (vol. 92, no. 22). — P. 10287—10291. — ISSN 0027-8424. — doi:10.1073/pnas.92.22.10287. — . — PMID 7479769.
- He, W; Rose D W; Olefsky J M; Gustafson T A. Grb10 interacts differentially with the insulin receptor, insulin-like growth factor I receptor, and epidermal growth factor receptor via the Grb10 Src homology 2 (SH2) domain and a second novel domain located between the pleckstrin homology and SH2 domains (англ.) // Journal of Biological Chemistry : journal. — UNITED STATES, 1998. — March (vol. 273, no. 12). — P. 6860—6867. — ISSN 0021-9258. — doi:10.1074/jbc.273.12.6860. — PMID 9506989.
- Frantz, J D; Giorgetti-Peraldi S; Ottinger E A; Shoelson S E. Human GRB-IRbeta/GRB10. Splice variants of an insulin and growth factor receptor-binding protein with PH and SH2 domains (англ.) // Journal of Biological Chemistry : journal. — UNITED STATES, 1997. — January (vol. 272, no. 5). — P. 2659—2667. — ISSN 0021-9258. — doi:10.1074/jbc.272.5.2659. — PMID 9006901.
- Kasus-Jacobi, A; Béréziat V; Perdereau D; Girard J; Burnol A F. Evidence for an interaction between the insulin receptor and Grb7. A role for two of its binding domains, PIR and SH2 (англ.) // Oncogene : journal. — ENGLAND, 2000. — April (vol. 19, no. 16). — P. 2052—2059. — ISSN 0950-9232. — doi:10.1038/sj.onc.1203469. — PMID 10803466.
- Braiman, L; Alt A; Kuroki T; Ohba M; Bak A; Tennenbaum T; Sampson S R. Insulin induces specific interaction between insulin receptor and protein kinase C delta in primary cultured skeletal muscle (англ.) // Molecular Endocrinology : journal. — United States, 2001. — April (vol. 15, no. 4). — P. 565—574. — ISSN 0888-8809. — doi:10.1210/mend.15.4.0612. — PMID 11266508.
- Rosenzweig, Tovit; Braiman Liora; Bak Asia; Alt Addy; Kuroki Toshio; Sampson Sanford R. Differential effects of tumor necrosis factor-alpha on protein kinase C isoforms alpha and delta mediate inhibition of insulin receptor signaling (англ.) // Diabetes : journal. — United States, 2002. — June (vol. 51, no. 6). — P. 1921—1930. — ISSN 0012-1797. — doi:10.2337/diabetes.51.6.1921. — PMID 12031982.
- Aguirre, Vincent; Werner Eric D; Giraud Jodel; Lee Yong Hee; Shoelson Steve E; White Morris F. Phosphorylation of Ser307 in insulin receptor substrate-1 blocks interactions with the insulin receptor and inhibits insulin action (англ.) // Journal of Biological Chemistry : journal. — United States, 2002. — January (vol. 277, no. 2). — P. 1531—1537. — ISSN 0021-9258. — doi:10.1074/jbc.M101521200. — PMID 11606564.
- Sawka-Verhelle, D; Tartare-Deckert S., White M F., Van Obberghen E. Insulin receptor substrate-2 binds to the insulin receptor through its phosphotyrosine-binding domain and through a newly identified domain comprising amino acids 591–786 (англ.) // Journal of Biological Chemistry : journal. — UNITED STATES, 1996. — March (vol. 271, no. 11). — P. 5980—5983. — ISSN 0021-9258. — doi:10.1074/jbc.271.11.5980. — PMID 8626379.
- Kotani, K; Wilden P; Pillay T S. SH2-Balpha is an insulin-receptor adapter protein and substrate that interacts with the activation loop of the insulin-receptor kinase (англ.) // Biochemical Journal : journal. — ENGLAND, 1998. — October (vol. 335, no. 1). — P. 103—109. — ISSN 0264-6021. — PMID 9742218.
- Nelms, K; O'Neill T J; Li S; Hubbard S R; Gustafson T A; Paul W E. Alternative splicing, gene localization, and binding of SH2-B to the insulin receptor kinase domain (англ.) // Mammalian Genome : journal. — UNITED STATES, 1999. — December (vol. 10, no. 12). — P. 1160—1167. — ISSN 0938-8990. — doi:10.1007/s003359901183. — PMID 10594240.
- O'Neill, T J; Zhu Y; Gustafson T A. Interaction of MAD2 with the carboxyl terminus of the insulin receptor but not with the IGFIR. Evidence for release from the insulin receptor after activation (англ.) // Journal of Biological Chemistry : journal. — UNITED STATES, 1997. — April (vol. 272, no. 15). — P. 10035—10040. — ISSN 0021-9258. — doi:10.1074/jbc.272.15.10035. — PMID 9092546.
Литература
- Pearson R.B., Kemp B.E. Protein kinase phosphorylation site sequences and consensus specificity motifs: tabulations (англ.) // Methods in Enzymology : journal. — 1991. — Vol. 200. — P. 62—81. — doi:10.1016/0076-6879(91)00127-I. — PMID 1956339.
- Joost H.G. Structural and functional heterogeneity of insulin receptors (англ.) // Cellular Signalling : journal. — 1995. — Vol. 7, no. 2. — P. 85—91. — doi:10.1016/0898-6568(94)00071-I. — PMID 7794689.
- O'Dell S.D., Day I.N. Insulin-like growth factor II (IGF-II) (англ.) // International Journal of Biochemistry & Cell Biology : journal. — 1998. — Vol. 30, no. 7. — P. 767—771. — doi:10.1016/S1357-2725(98)00048-X. — PMID 9722981.
- Lopaczynski W. Differential regulation of signaling pathways for insulin and insulin-like growth factor I (англ.) // Acta Biochim. Pol. : journal. — 1999. — Vol. 46, no. 1. — P. 51—60. — PMID 10453981.
- Sasaoka T., Kobayashi M. The functional significance of Shc in insulin signaling as a substrate of the insulin receptor (англ.) // Endocrine Journal : journal. — 2000. — Vol. 47, no. 4. — P. 373—381. — doi:10.1507/endocrj.47.373. — PMID 11075717.
- Perz M., Torlińska T. Insulin receptor—structural and functional characteristics (англ.) // Medical Science Monitor : journal. — 2001. — Vol. 7, no. 1. — P. 169—177. — PMID 11208515.
- Benaim G., Villalobo A. Phosphorylation of calmodulin. Functional implications (англ.) // FEBS Journal : journal. — 2002. — Vol. 269, no. 15. — P. 3619—3631. — doi:10.1046/j.1432-1033.2002.03038.x. — PMID 12153558.