Белок-белковые взаимодействия
Белок-белковые взаимодействия (ББВ) — обладающие высокой специфичностью физические контакты между двумя и более белками. Эти контакты образуются в результате биохимических событий с помощью электростатических взаимодействий, в том числе гидрофобного эффекта[1].
Белки — важные макромолекулы как для внутриклеточных, так и для внешних процессов. Белки редко действуют в одиночку: для участия в различных жизненно важных процессах внутри клетки эти макромолекулы с помощью белок-белковых взаимодействий собираются в мультибелковые комплексы. Белок-белковые взаимодействия составляют основу интерактома любой живой клетки[1]. Они участвуют в таких важных клеточных процессах, как передача сигнала, клеточное общение, транскрипция, репликация, мембранный транспорт и другие. Поэтому неудивительно, что нарушения этих взаимодействий приводят ко многим заболеваниям, таким как болезнь Крейтцфельдта — Якоба, болезнь Альцгеймера и рак[2].
Не все белок-белковые взаимодействия образуются раз и навсегда. Часть белков входит в состав стабильных комплексов, которые являются молекулярными машинами (например, АТФ-синтаза или цитохромоксидаза). Другие же белки собираются обратимо для осуществления какой-либо временной функции (например, для активации экспрессии генов в случае с транскрипционными факторами и активаторами)[1].
Белок-белковые взаимодействия рассматриваются со стороны биохимии, квантовой химии, молекулярной динамики, передачи сигналов в клетке[3]. Полученная информация позволяет создавать обширные сети белковых взаимодействий, похожих на метаболические или генетические/эпигенетические связи. Это расширяет текущие знания о биохимических каскадах и патогенезе заболеваний, а также открывает новые возможности для поиска новых терапевтических мишеней.
Типы белок-белковых взаимодействий
Белки могут «временно» связываться друг с другом или же образовывать «стабильные» мультибелковые комплексы. При этом белковые комплексы могут быть как гетеро-, так и гомоолигомерными. Классическими примерами ББВ являются взаимодействия фермент-ингибитор и антитело-антиген, но помимо них ББВ могут возникать между двумя доменами или же доменом и пептидом[1].
Гомо- и гетероолигомеры
Гомоолигомеры — макромолекулярные комплексы, состоящие только из одного типа белковых субъединиц. Если же связь образуется между неидентичными белковыми цепями, то образуется гетероолигомер. Гетероолигомеры разнятся по своей стабильности, а для большинства гомоолигомерных комплексов характерна симметричность и стабильность. Разборка гомоолигомеров зачастую требует денатурации[4]. Некоторые ферменты, транспортные белки, факторы транскрипции выполняют свою функцию будучи гомоолигомерами. Взаимодействия между разными белками играют большую роль в клеточной передаче сигналов.
Обязательные и необязательные взаимодействия
Для разделения ББВ на обязательные и необязательные нужна информация о стабильности участвующих во взаимодействии белков (мономеров) в свободном состоянии и в составе белкового комплекса. Если мономеры стабильны in vivo только в составе комплекса, то взаимодействие между ними является обязательным. В результате обязательных взаимодействий формируются обязательные или облигатные комплексы. Если же белки могут существовать независимо, то они участвуют в необязательных ББВ. Большинство макромолекулярных машин в клетке являются примерами обязательных взаимодействий[2]. К обязательным комплексам относятся человеческий катепсин D и димер ДНК связывающего белка P22 Arc repressor, а необязательных взаимодействий — взаимодействие RhoA с RhoGAP и тромбина со своим ингибитором родниином[5].
Постоянные и временные взаимодействия
ББВ можно разделить по времени жизни комплекса. Постоянные взаимодействия обычно очень стабильны: белки, взаимодействуя, образуют постоянныей комплекс. Они часто присутствуют в гомоолигомерах (например, Цитохром с) и в некоторых гетероолигомерах (например, субъединицы АТРазы). Временные взаимодействия постоянно образуются и разрушаются. Они могут возникать при взаимодействии гормона с рецептором, передаче клеточного сигнала. Такой тип взаимодействия широко распространён в сигнальных и регуляторных путях[2].
Ковалентные и нековалентные взаимодействия
Ковалентные связи — наиболее прочные и образуются в случае обмена электронами (например, дисульфидные связи). Хотя эти связи редко встречаются при белок-белковых взаимодействиях, в некоторых посттрансляционных модификациях они являются определяющими (например, убиквитирование и навешивание SUMO белков). Нековалентные связи обычно образуются во временных взаимодействиях за счет комбинаций слабых связей: водородных, ионных, ван-дер-ваальсовых или гидрофобных[6].
Переход из неструктурированного в структурированное состояние
Отдельно можно выделить ББВ, которые образуются частично неструктурированными белками. В таких белках есть участки, аминокислотная последовательность которых не позволяет образовать стабильной третичной структуры. Эти белки могут взаимодействать с другими, подбирая подходящую конформацию для образования связи с партнёром[2].
Трёхмерная структура белковых комплексов
Молекулярные структуры многих белковых комплексов были разрешены с помощью рентгеноструктурного анализа[7][8]. Первой такой структурой был миоглобин кашалота[9]. Позднее для определения трёхмерной структуры белковых комплексов также стали применять ЯМР. Так, например, одной из первых была получена структура кальмодулин-связанных доменов, взаимодействующих с кальмодулином[8][10]. Этот метод хорошо подходит для определения слабых белок-белковых взаимодействий[11].
Домены
Благодаря развитию методов разрешения трёхмерной структуры белков удалось выделить структурные домены, которые участвуют в образовании ББВ. Такими, например, являются:
- SH2-домен, связывающий фосфорилированные белки;
- SH3-домен, специфичный к пролин-богатым последовательностям;
- PTB-домен, взаимодействующий с последовательностями, содержащими фосфотирозиновую группу;
- LIM-домен, содержащий цистеин-богатый мотив цинкового пальца и способный связываться с PDZ-доменом и себе подобными;
- SAM-домен, связывающий белки, не содержащие данный домен;
- PDZ-домен, узнающий мотив S/TXV на C-конце белка, а также LIM-домены или себе подобные;
- FERM-домен, способный связывать PI(4,5)P2 (фосфоинозитол-4,5-бисфосфат)[12].
Биологические эффекты белок-белковых взаимодействий
Белок-белковые взаимодействия играют важную роль во многих биологических процессах. Функция и активность белка в большинстве случаев изменяются при связывании с белками-партнёрами. Они могут оказывать значительное влияние на кинетические параметры фермента за счёт аллостерического эффекта, приводить к его инактивации (например, при связывании фермента с ингибитором) или к изменению специфичности фермента к своему субстрату[13].
Помимо этого, взаимодействие белков друг с другом может приводить к формированию нового центра связывания для субстрата на поверхности взаимодействия двух молекул. За счёт взаимодействия двух или более ферментов друг с другом становится возможным туннелирования субстрата, что увеличивает эффективность ферментативных реакций за счёт стабилизации интермедиатов и повышения их локальной концентрации[13].
Методы изучения белок-белковых взаимодействий
Существует множество методов изучения белок-белковых взаимодействий[13]. Некоторые из них позволяют экспериментально определять белки-партнёры для изучаемого белка, другие — лишь верифицировать возможное взаимодействие двух белков. Для подтверждения партнёрства двух белков используется бимолекулярная флуоресцентная комплементация (BiFC), FRET-методы, Far-Western, дрожжевая двугибридная система. Для решения задачи обнаружения белков-партнёров используется коиммунопреципитация с последующей аффинной хроматографией и масс-спектрометрией, система AviTag с промискуитетной BirA-лигазой. Основной проблемой в применении данных методов является возможная неспецифичность белка, который определился как входящий в состав белкового комплекса.
Дрожжевой двугибридный анализ

Двугибридные дрожжи позволяют in vivo выявлять парные ББВ (бинарный метод), а также неспецифичные липкие взаимодействия (sticky interactions)[14].
Клетки дрожжей трансфецируются двумя плазмидами: наживкой — интересующим нас белком с прилинкованным ДНК-связывающим доменом дрожжевого фактора транскрипции, например Gal4, и добычей — библиотекой кДНК (cDNA) фрагментов, прикреплённых к активирующему домену транскрипционного фактора. Если добыча и наживка взаимодействуют, два домена транскрипционного фактора соединяются и становятся функциональными. Таким образом, по присутствию результатов продукции репортерного гена можно судить о наличии взаимодействия между белками[6][15].
Несмотря на всю полезность, у дрожжевой двугибридной системы имеется ряд ограничений: относительно низкая специфичность; использование дрожжей в качестве основного хозяйского организма, что может приводить к проблемам при исследовании других биологических систем; относительно низкое количество обнаруживаемых ББВ, поскольку некоторые белки со слабыми связями теряются в процессе выделения[16] (к примеру, плохо обнаруживаются мембранные белки[17][18]). Ограничения преодолеваются использованием различных вариантов двугибридной системы, например мембранным дрожжевым двугибридом (membrane yeast two-hybrid)[18], сплит-убиквитиновыми системами[15], которые не ограничены взаимодействиями только внутри ядра; и бактериальными двугибридными системами (с использованием бактерий, соответственно)[19].
Афинная хроматография с последующей масс-спектрометрией
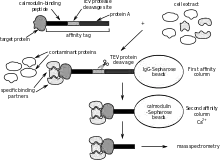
Аффинная хроматография с последующей масс-спектрометрией позволяет обнаруживать, в основном, стабильные взаимодействия, тем самым лучше отражая функциональные ББВ, существующие в живой клетке (in vivo)[14][15]. При использовании этого метода сначала выделяют помеченный белок, экспрессируемый в клетке обычно в in vivo концентрациях, и взаимодействующие с ним белки (афинная хроматография). Один из наиболее выигрышных и широко используемых методов для выделения протеинов в случае сильного фонового загрязнения — это метод тандемной афинной хроматографии. ББВ могут быть качественно и количественно проанализированы различными масс-спектрометрическими методами: химическим слиянием, биологическим или метаболическими слиянием (SILAC), или методами без использования меток[4].
Вычислительные способы предсказания ББВ
Так как до сих пор нет полных данных интерактома и не все ББВ обнаружены, при реконструкции сигнальных или метаболических карт взаимодействий используют различные вычислительные методы. Они позволяют устранить пробелы, предсказывая наличие тех или иных взаимодействий между узлами сети. С помощью вычислительных методов можно предсказать не только возможность ББВ, но также и их силу[2].
Ниже приведено несколько вычислительных подходов предсказания ББВ:
- Поиск событий слияния генов или доменов белков: слияния генов, что часто также означает слияние доменов, можно использовать для поиска функциональной связи между белками. При этом используется предположение, что слиянию этих генов в течение эволюции способствовал отбор[20].
- Методы сравнительной геномики и кластеризации генов: часто гены, которые кодируют белки со схожей функцией или взаимодействующие друг с другом белки, находятся в одном опероне (в случае бактерий) или совместно регулируются (корегуляция) (в случае эукариот). Такие гены обычно близко расположены в геноме. Методы кластеризации генов оценивают вероятность совместной встречаемости ортологов белков, которые кодируют гены из одного кластера. Такие подходы помогают выявлять скорее функциональное взаимодействие между белками, чем их физический контакт[2].
- Методы, основанные на филогенетических профилях: в таких методах предполагают, что если негомологичные белки функционально связаны, то существует вероятность того, что они могут вступать в ББВ и коэволюционировать. Для того чтобы найти функциональную связь между белками, используют кластеризацию по филогенетическим профилям этих белков или же оценивают вероятность совместной встречаемости белков в различных протеомах[2]. Идея того, что у взаимодействующих друг с другом белков часто схожие по топологии филогенетические деревья, используется в методе «mirror tree»[21].
- Способы предсказания на основе гомологии: данный подход предполагает, что исследуемые белки будут взаимодействовать друг с другом, если известно, что их гомологи вступают во взаимодействие. Такие пары белков из разных организмов, которые сохранили в течение эволюции способность взаимодействовать друг с другом, называются интерологами. Примерами сервисов, использующих данный метод, являются PPISearch и BIPS[2].
- Предсказание, основанное на данных коэкспрессии генов: если исследуемые белки кодируют гены с похожими паттернами экспрессии (схожий профиль и уровень экспрессии) в разные временные промежутки, то можно предположить, что эти белки функционально связаны и, возможно, как-то взаимодействуют друг с другом[22].
- Методы на основе сетевой топологии: сети ББВ можно представить в виде графа, где узлами являются белки, а каждое ребро обозначает взаимодействие между белками. С помощью математической интерпретации сети ББВ (например, в виде матрицы смежности) можно определить, как белки функционально связаны между собой, а также предсказать новые ББВ. Если у двух белков очень много общих партнёров в сети, то скорее всего они принимают участие в одном биологическом процессе и потенциально могут взаимодействовать друг с другом[2].
- In-Silico Two-Hybrid подход: главное предположение данного метода — взаимодействующие друг с другом белки коэволюционируют, чтобы сохранить функциональность. Данный метод анализирует множественные выравнивания белкового семейства и ищет скоррелированные мутации для предсказания ББВ и поиска оснований, входящих в участок связывания[23].
- Предсказание ББВ, основанное на структуре белков: такой подход позволяет не только выяснить, могут ли белки взаимодействовать, но и охарактеризовать это взаимодействие (например, его физические характеристики или аминокислоты, входящие в состав поверхности взаимодействия двух белков). Одним из методов, использующих трёхмерную структуру белков, является докинг. Сюда же относят методы, которые предполагают эволюционную консервативность оснований, входящих в состав поверхности взаимодействия. Таким образом, на основе уже известных структур можно предсказать, как будет выглядеть мультимолекулярный комплекс исследуемых белков[2].
- Методы, основанные на машинном обучении или интеллектуальном анализе текста: на основе машинного обучения был разработан метод предсказания ББВ, который использует только последовательности исследуемых белков[24]. Это позволяет проанализировать, хотя и менее точно, бóльшее число возможных взаимодействий, так как для работы используются только аминокислотные последовательности. Интеллектуальный анализ текста ищет связь между белками, рассматривая их взаимное упоминание в предложениях или параграфах различных текстовых блоков[25].
Базы белок-белковых взаимодействий
Крупномасштабные поиски ББВ позволили выявить сотни тысяч взаимодействий, информация о которых была собрана в специализированных биологических базах данных (БД). Эти базы постоянно обновляются с целью предоставить полный интерактом. Первой такой базой стала База Данных Взаимодействующих Белков(DIP)[26]. С момента её появления число публичных баз данных продолжает расти. Эти БД можно разделить на три класса: первичные, мета-БД и БД предсказаний[1].
- Первичные БД собирают информацию об опубликованных ББВ, чье существование доказано в мелко- или крупномасштабных экспериментах. Например, к ним можно отнести DIP, Biomolecular Interaction Network Database (BIND), Biological General Repository for Interaction Datasets (BioGRID), Human Protein Reference Database (HPRD), IntAct Molecular Interaction Database, Molecular Interactions Database (MINT), MIPS Protein Interaction Resource on Yeast (MIPS-MPact) и MIPS Mammalian Protein-Protein Interaction Database (MIPS-MPPI)[1].
- Мета-БД обычно являются результатом объединения данных из первичных баз, но могут и впоследствии пополняться оригинальной информацией. Примеры: Agile Protein Interaction DataAnalyzer (APID), The Microbial Protein Interaction Database (MPID8) и Protein Interaction Network Analysis (PINA) platform[1].
- БД предсказанных ББВ заполняются результатами, полученными с использованием различных техник. Примеры: Michigan Molecular Interactions (MiMI), Human Protein-Protein Interaction Prediction Database (PIPs), Online Predicted Human Interaction Database (OPHID), Known and Predicted Protein-Protein Interactions (STRING), а также Unified Human Interactome (UniHI)[1].
Сети белок-белковых взаимодействий

Информация, содержащаяся в базах ББВ, позволяет строить сети белковых взаимодействий. Сеть ББВ для одного конкретного белка вполне возможно описать, например, с помощью текста. Но задача создания диаграммы всевозможных внутриклеточных ББВ поистине сложна и трудноизобразима. Одним из примеров вручную созданной молекулярной карты взаимодействий является карта контроля клеточного цикла, созданная Куртом Коном (Kurt Kohn) в 1999 году[27]. Базируясь на карте Кона, Швиковски (Schwikowski) и др. в 2000 году опубликовали карту ББВ в дрожжах, объединившую 1548 взаимодействующих протеина, информация о которых была получена методом двугибридного анализа. При визуализации для первоначального расположения вершин использовался метод послойного изображения графа, а затем полученное изображение было улучшено за счет применения силового (force based) алгоритма[28][29].
Чтобы упростить сложную задачу визуализации, были разработаны различные биоинформатические инструменты, которые также позволяют сочетать информацию о ББВ с другими типами данных. К примеру, широко используется пакет с открытым исходным кодом Cytoscape, к которому доступна масса плагинов[1][30]. Для визуализации и анализа очень больших сетей подходит пакет Pajek[31].
Важная роль ББВ в физиологических и патологических процессах является хорошей мотивацией для расширения интерактома. В качестве примеров уже опубликованных интерактомов можно привести thyroid-специфичный интерактом DREAM[32] и PP1α-интеракто в человеческом мозге[33].
Примечания
- De Las Rivas, J.; Fontanillo, C. Protein-protein interactions essentials: key concepts to building and analyzing interactome networks (англ.) // PLoS computational biology : journal. — 2010. — Vol. 6, no. 6. — P. e1000807. — PMID 20589078.
- Keskin, O.; Tuncbag, N; Gursoy, A. Predicting Protein–Protein Interactions from the Molecular to the Proteome Level (англ.) // Chemical Reviews : journal. — 2016. — Vol. 116, no. 8. — P. 4884—4909. — PMID 27074302.
- Herce, H.D.; Deng, W.; Helma, J.; Leonhardt, H.; Cardoso, M.C. Visualization and targeted disruption of protein interactions in living cells (англ.) // Nature Communications : journal. — Nature Publishing Group, 2013. — Vol. 4. — P. 2660. — PMID 24154492.
- Jones, S.; Thornton, J.M. Principles of protein-protein interactions (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1996. — Vol. 93, no. 1. — P. 13—20. — PMID 8552589.
- Nooren, I.M.; Thornton, J.M. Diversity of protein-protein interactions (англ.) // EMBO J. : journal. — 2003. — Vol. 22, no. 14. — P. 3486—3492. — PMID 12853464.
- Westermarck, J.; Ivaska, J.; Corthals, G.L. Identification of protein interactions involved in cellular signaling (англ.) // Molecular & cellular proteomics : MCP : journal. — 2013. — Vol. 12, no. 7. — P. 1752—1763. — PMID 23481661.
- Janin J., Chothia C. The structure of protein-protein recognition sites. (англ.) // The Journal of biological chemistry. — 1990. — Vol. 265, no. 27. — P. 16027—16030. — PMID 2204619.
- Bruce, A.; Johnson, A.; Lewis, J.; Raff, M.; Roberts, K.; Walter, P. Molecular biology of the cell (неопр.). — 4th. — New York: Garland Science, 2002. — ISBN 0-8153-3218-1.
- Kendrew, J.C.; Bodo, G.; Dintzis, H.M.; Parrish, R.G.; Wyckoff, H.; Phillips, D.C. A three-dimensional model of the myoglobin molecule obtained by x-ray analysis (англ.) // Nature : journal. — 1958. — Vol. 181, no. 4610. — P. 662—666. — PMID 13517261.
- Wand, A.J.; Englander, S. W. Protein complexes studied by NMR spectroscopy (неопр.) // Current opinion in biotechnology. — 1996. — Т. 7, № 4. — С. 403—408. — PMID 8768898.
- Vinogradova, O.; Qin, J. NMR as a unique tool in assessment and complex determination of weak protein-protein interactions (англ.) // Topics in current chemistry : journal. — 2012. — Vol. 326. — P. 35—45. — PMID 21809187.
- Berridge, M.J. Cell Signalling Biology: Module 6 – Spatial and Temporal Aspects of Signalling (англ.) // Biochemical Journal : journal. — 2012. — doi:10.1042/csb0001006.
- Phizicky E. M., Fields S. Protein-protein interactions: methods for detection and analysis. (англ.) // Microbiological reviews. — 1995. — Vol. 59, no. 1. — P. 94—123. — PMID 7708014.
- Brettner L. M., Masel J. Protein stickiness, rather than number of functional protein-protein interactions, predicts expression noise and plasticity in yeast. (англ.) // BMC systems biology. — 2012. — Vol. 6. — P. 128. — doi:10.1186/1752-0509-6-128. — PMID 23017156.
- Wodak, S.J.; Vlasblom, J.; Turinsky, A.L.; Pu, S. Protein-protein interaction networks: the puzzling riches (англ.) // Current opinion in structural biology : journal. — 2013. — Vol. 23, no. 6. — P. 941—953. — PMID 24007795.
- Rajagopala, S.V.; Sikorski, P.; Caufield, J.H.; Tovchigrechko, A.; Uetz, P. Studying protein complexes by the yeast two-hybrid system (англ.) // Methods : journal. — 2012. — Vol. 58, no. 4. — P. 392—399. — PMID 22841565.
- Stelzl, U.; Wanker, E.E. The value of high quality protein-protein interaction networks for systems biology (англ.) // Current opinion in chemical biology : journal. — 2006. — Vol. 10, no. 6. — P. 551—558. — PMID 17055769.
- Petschnigg, J.; Snider, J.; Stagljar, I. Interactive proteomics research technologies: recent applications and advances (англ.) // Current opinion in biotechnology : journal. — 2011. — Vol. 22, no. 1. — P. 50—8. — PMID 20884196.
- Battesti, A; Bouveret, E. The bacterial two-hybrid system based on adenylate cyclase reconstitution in Escherichia coli (англ.) // Methods : journal. — 2012. — Vol. 58, no. 4. — P. 325—334. — PMID 22841567.
- Enright, A. J.; Iliopoulos, I.; Kyrpides, N.C.; Ouzounis, C.A. Protein Interaction Maps for Complete Genomes Based on Gene Fusion Events (англ.) // Nature : journal. — 1999. — Vol. 402, no. 6757. — P. 86—90. — PMID 10573422.
- Pazos, F.; Valencia, A. Similarity of Phylogenetic Trees as Indicator of Protein-Protein Interaction (англ.) // Protein Eng., Des. Sel. : journal. — 2001. — Vol. 14, no. 9. — P. 609—614. — PMID 11707606.
- Jansen, R.; IGreenbaum, D.; Gerstein, M. Relating Whole- Genome Expression Data with Protein-Protein Interactions (англ.) // Genome Res. : journal. — 2002. — Vol. 12, no. 1. — P. 37—46. — PMID 11779829.
- Pazos, F.; Valencia, A. In Silico Two-Hybrid System for the Selection of Physically Interacting Protein Pairs (англ.) // Proteins: Struct., Funct., Genet. : journal. — 2002. — Vol. 47, no. 2. — P. 219—227. — PMID 11933068.
- Shen, J.; IZhang, J.; Luo, X.; Zhu, W.; Yu, K.; Chen, K.; Li, Y.; Jiang, H. Predicting protein-protein interactions based only on sequences information (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — Vol. 104, no. 11. — P. 4337—4341. — PMID 17360525.
- Papanikolaou, N.; Pavlopoulos, G.A.; Theodosiou, T.; Iliopoulos, I. Protein-protein interaction predictions using text mining methods (англ.) // Methods : journal. — 2015. — Vol. 74. — P. 47—53. — PMID 25448298.
- Xenarios I., Rice D. W., Salwinski L., Baron M. K., Marcotte E. M., Eisenberg D. DIP: the database of interacting proteins. (англ.) // Nucleic acids research. — 2000. — Vol. 28, no. 1. — P. 289—291. — PMID 10592249.
- Schwikowski B., Uetz P., Fields S. A network of protein-protein interactions in yeast. (англ.) // Nature biotechnology. — 2000. — Vol. 18, no. 12. — P. 1257—1261. — doi:10.1038/82360. — PMID 11101803.
- Rigaut G., Shevchenko A., Rutz B., Wilm M., Mann M., Séraphin B. A generic protein purification method for protein complex characterization and proteome exploration. (англ.) // Nature biotechnology. — 1999. — Vol. 17, no. 10. — P. 1030—1032. — doi:10.1038/13732. — PMID 10504710.
- Prieto C., De Las Rivas J. APID: Agile Protein Interaction DataAnalyzer. (англ.) // Nucleic acids research. — 2006. — Vol. 34. — P. 298—302. — doi:10.1093/nar/gkl128. — PMID 16845013.
- Michael Kohl, Sebastian Wiese, and Bettina Warscheid (2011) Cytoscape: Software for Visualization and Analysis of Biological Networks. In: Michael Hamacher et al. (eds.), Data Mining in Proteomics: From Standards to Applications, Methods in Molecular Biology, vol. 696, DOI 10.1007/978-1-60761-987-1_18
- Raman, K. Construction and analysis of protein-protein interaction networks (англ.) // Automated experimentation : journal. — 2010. — Vol. 2, no. 1. — P. 2. — PMID 20334628.
- Rivas, M.; Villar, D.; González, P.; Dopazo, X.M.; Mellstrom, B.; Naranjo, J.R. Building the DREAM interactome (неопр.) // Science China. Life sciences. — 2011. — Т. 54, № 8. — С. 786—792. — PMID 21786202.
- Esteves, S.L.; Domingues, S.C.; da Cruz e Silva, O.A.; Fardilha, M.; da Cruz e Silva, E.F. Protein phosphatase 1α interacting proteins in the human brain (англ.) // Omics : a journal of integrative biology : journal. — 2012. — Vol. 16, no. 1—2. — P. 3—17. — PMID 22321011.
Ссылки
- Stark, C. «BioGRID: a general repository for interaction datasets» (англ.). http://www.thebiogrid.org. Nucleic Acids Res (2006). — Biological General Repository for Interaction Datasets (BioGRID). Дата обращения: 13 мая 2017.
- Peri, S. «Human protein reference database as a discovery resource for proteomics» (англ.). http://www.hprd.org. Nucleic Acids Res (2004). — Human Portein Reference Database (HPRD). Дата обращения: 13 мая 2017.
- Hermjakob, H. «IntAct: an open source molecular interaction database» (англ.). http://www.ebi.ac.uk/intact. Nucleic Acids Res (2004). — IntAct Molecular Interaction Database. Дата обращения: 13 мая 2017.
- Chatr-aryamontri, A. «MINT: the Molecular INTeraction database» (англ.). http://mint.bio.uniroma2.it/mint/. Nucleic Acids Res (2007). — Molecular Interactions Database (MINT). Дата обращения: 13 мая 2017.