Факторы транскрипции
Факторы транскрипции (транскрипционные факторы) — белки́, контролирующие процесс синтеза мРНК, а также других видов РНК [1] на матрице ДНК (транскрипцию) путём связывания со специфичными участками ДНК[2][3]. Транскрипционные факторы выполняют свою функцию либо самостоятельно, либо в комплексе с другими белками. Они обеспечивают снижение (репрессоры) или повышение (активаторы) константы связывания РНК-полимеразы с регуляторными последовательностями регулируемого гена[4][5][6].
Определяющая черта факторов транскрипции — наличие в их составе одного или более ДНК-связывающих доменов, которые взаимодействуют с характерными участками ДНК, расположенными в регуляторных областях генов. Другие белки, играющие ключевую роль в регуляции экспрессии генов, такие как коактиваторы, гистонацетилазы, киназы, метилазы, не имеют ДНК-связывающих доменов, и, следовательно, не могут быть причислены к транскрипционным факторам[7][8][9].
Консервативность у различных организмов
Факторы транскрипции необходимы для регуляции экспрессии генов и обнаружены у всех живых организмов. Их количество, как абсолютное, так и удельное, возрастает с ростом размера генома[10].
В геноме человека обнаружено более 2600 белков, имеющих ДНК-связывающий домен, и большинство из них предположительно являются факторами транскрипции[11]. Следовательно, около 10 % всех генов в геноме кодируют транскрипционные факторы. Таким образом, они являются самым большим семейством белков человека[12]. Более того, активность многих генов регулируется корпоративным взаимодействием большого числа различных факторов транскрипции, что позволяет обеспечить каждому из генов уникальный способ регуляции в процессе развития организма[9].
Функции
Факторы транскрипции — одна из групп белков, обеспечивающих прочтение и интерпретацию генетической информации. Они связывают ДНК и способствуют инициации программы повышения или понижения транскрипции гена. Таким образом, они жизненно необходимы для нормального функционирования организма на всех уровнях. Ниже перечислены важнейшие из процессов, в которые вовлечены факторы транскрипции.
Регуляция базальной экспрессии генов
Фоновая транскрипционная активность обеспечивается набором ТФ, общим для всех генов. Важный класс эукариотических факторов транскрипции — GTFs (general transcription factors)[13][14]. Многие из его представителей не связывают ДНК непосредственно, а входят в состав комплекса инициации транскрипции (преинициирующего комплекса), который напрямую взаимодействует с РНК-полимеразой. Наиболее распространенными GTF являются TFIIA, TFIIB, TFIID (связываются с т. н. ТАТА-боксом (элементом промотора)), TFIIE, TFIIF, и TFIIH[15].
Помимо ТФ, необходимых для экспрессии всех генов, существуют также специфичные факторы транскрипции, обеспечивающие включение/выключение определённых генов в нужный момент.
Регуляция онтогенеза
Многие ТФ многоклеточных организмов вовлечены в обеспечение их развития[16]. Действуя в соответствии с генетической программой и/или в ответ на внешние воздействия, они инициируют или подавляют транскрипцию определённых генов, что влечет за собой изменения в клеточной морфологии, клеточную дифференциацию, морфогенез, органогенез и т. д. Например, семейство гомеобоксных ТФ критично для формирования правильной морфологии тела у организмов от дрозофилы до человека[17][18]. Мутации генов этих белков (гомеозисные мутации) у дрозофил приводят к серьёзным нарушениям в дифференцировке сегментов тела данных насекомых (например, развитие ног вместо усиков).
Другой пример данной группы ТФ — продукт гена полопределяющего региона Y (SRY, Sex-determining Region Y), который играет важную роль в детерминации пола человека.[19]
Ответ на внеклеточные сигналы
Согласованная регуляция взаимодействия клеток многоклеточного организма осуществляется путём высвобождения специальных молекул (гормонов, цитокинов и т. п.), которые вызывают сигнальный каскад в клетках-мишенях. В случае, если сигнал вызывает изменение уровня экспрессии определённых генов, конечным звеном каскада часто оказываются ТФ[20]. Эстрогеновый сигнальный путь — пример короткого каскада, включающего транскрипционный фактор рецептора эстрогена: эстроген секретируется тканями плаценты и яичника, преодолевает плазматическую мембрану реципиентных клеток, и связывается со своим рецептором в цитоплазме. Рецептор эстрогена проникает в ядро и связывает специфичный участок ДНК, изменяя регуляции транскрипции соответствующего гена[21].
Ответ на изменение окружающей среды
ТФ — не единственные конечные звенья сигнальных каскадов, возникающих в ответ на различные внешние стимулы, но они тоже могут быть эффекторами в сигнальных каскадах, индуцируемых воздействием окружающей среды. Например, фактор теплового шока (HSF) активирует гены белков теплового шока, которые обеспечивают выживание при повышении температуры (например, шапероны)[22], фактор, индуцируемый гипоксией (HIF) — при снижении концентрации кислорода[23]; белок SREBP (sterol regulatory element binding protein) помогает поддерживать необходимое содержание липидов в клетках[24].
Контроль клеточного цикла
Многие ТФ, особенно онкогены и онкосупрессоры, участвуют в регуляции клеточного цикла. Они определяют переход от одной фазы клеточного цикла к другой, частоту делений и интенсивность роста. Один из наиболее известных подобных ТФ — онкоген Myc, играющий важную роль в росте клеток и направлении их в апоптоз.
Регуляция
Все общебиологические процессы имеют многоуровневую регуляцию и контроль. Это верно и для ТФ — ТФ не только обеспечивают регуляцию уровня накопления белков и РНК в клетке, но и регулируют активность собственных генов (часто с помощью других ТФ). Ниже кратко описаны основные способы регуляции активности ТФ.
Общие для всех белков
Уровень накопления ТФ в клетке регулируется по той же схеме, что и у других белков за счет контроля транскрипции, деградации мРНК, трансляции, постпроцессинга белка, его внутриклеточной локализации и деградации. Возможна саморегуляция по принципу отрицательной обратной связи — ТФ репрессирует активность кодирующего его гена.
Внутриядерная локализация
У эукариотических организмов процессы транскрипции и трансляции пространственно разделены — они происходят в ядре и цитоплазме соответственно. После синтеза ТФ должны проникнуть в ядро, преодолев двойную мембрану. Многие белки, функционирующие в ядре, имеют сигнал ядерной локализации — специфичный участок полипептидной цепи, адресующий белок в ядро. Для многих ТФ транслокация является ключевым фактором в регуляции их активности[25]. Важные классы ТФ, такие как некоторые ядерные рецепторы, должны сперва связать эндогенный лиганд-агонист в цитоплазме и только потом транспортироваться в ядро[25].
Активация
ТФ могут быть активированы/деактивированны путём воздействия на их сигнал-чувствительный домен различным образом:
- связывание лиганда — необходимой для функционирования субстанции, не входящий в состав полипептида (например, ионов Zn2+)
- фосфорилирование[26][27] — многие ТФ должны быть фосфорилированы для получения возможности связывать ДНК.
- взаимодействие с другими ТФ и/или корегуляторными белками.
Доступность сайта связывания ДНК
У эукариот гены, не транскрибируемые постоянно, часто находятся в гетерохроматине (участках ДНК, плотно упакованных за счет связывания гистонов и организованных в компактные хроматиновые фибриллы). ДНК в составе гетерохроматина недоступна для многих факторов транскрипции. Для того, чтобы ТФ могли связаться с ДНК, гетерохроматин должен быть трансформирован в эухроматин, обычно путём модификаций гистонов. Также для связывания ТФ с ДНК важную роль играет свобода хроматина от нуклеосом. Хроматин свободный от нуклеосом называется открытым хроматином и значительно чаще связывает факторы транскрипции, чем связанный с нуклеосомами хроматин. Перераспределение нуклеосом осуществляют факторы ремоделирования хроматина. Сайт связывания ТФ на ДНК может быть недоступным и в случае, если он связан другим фактором транскрипции. Пары факторов транскрипции могут играть антагонистическую роль (активатор — репрессор) при регуляции активности одного гена.
Наличие других кофакторов/транскрипционных факторов
Большинство ТФ не работают в одиночку. Часто для активации транскрипции гена с его регуляторными элементами должно связаться большое количество ТФ. Связывании ТФ вызывает привлечение промежуточных белков, таких как кофакторы, что приводит к сборке преинициационного комплекса и посадке на промотор РНК-полимеразы.
Структура
ТФ являются модульными по структуре и содержат следующие домены[2]:
- ДНК-связывающий домен (DBD) — взаимодействует со специфичными последовательностями ДНК, характерными для промоторов и энхансеров. Специфичность распознавания определённых последовательностей определяет набор генов, подверженных регуляции данным ТФ;
- трансактивирующий домен (TAD) — содержит участки связывания других белков, например, транскрипционных корегуляторов[28];
- сигналраспознающий домен (SSD) (например, лиганд-связывающий домен), который чувствителен к внешнем сигналам и отвечающим за передачу сигнала к другим компонентам транскрипционного комплекса, что вызывает повышение или понижение уровня экспрессии.
ДНК-связывающий домен
Структурно-функциональная единица (домен) факторов транскрипции, связывающая ДНК, называется ДНК-связывающим доменом. Ниже приведен список важнейших семейств ДНК-связывающих доменов/ТФ:
| Семейство | NCBI conserved domains | База данных структурной классификации белков (SCOP) | База данных InterPro |
|---|---|---|---|
| Спираль-петля-спираль (helix-loop-helix)[29] | cl00228 | 47460 | IPR001092 |
| Лейциновая молния[30] | cl02576 | 57959 | IPR004827 |
| C-концевые эффекторные домены составных регуляторов ответа | 46894 | IPR001789 | |
| GCC box | cl00033 | 54175 | |
| Спираль-поворот-спираль (helix-turn-helix)[31] | cl02600 | ||
| Гомеодоменные белки — связывают гомеобокс (особый участок ДНК). Играют критическую роль в индивидуальном развитии организмов (онтогенезе).[32] | cd00086 | 46689 | IPR009057 |
| Подобные репрессору фага лямбда | 47413 | IPR010982 | |
| srf-подобные | cl00109 | 55455 | IPR002100 |
| Парный бокс[33] | cl09102 | ||
| winged helix | 46785 | IPR011991 | |
| Цинковые пальцы[34] | |||
| * многодоменные цинковые пальцы типа Cys2His2[35] | pfam00096 | 57667 | IPR007087 |
| * Zn2/Cys6 | 57701 | ||
| * цинковые пальцы типа Zn2/Cys8 ядерных рецепторов гормонов | pfam00105 | 57716 | IPR001628 |
Сайты связывания ТФ
Участки ДНК, которые взаимодействуют с факторами транскрипции, называются сайтами связывания ТФ. Взаимодействие осуществляется за счет электростатических сил, водородных связей и сил Ван-дер-Ваальса. За счет корпоративного, стерически детерминированного действия данных сил, которое определяется пространственной структурой белковой молекулы, ТФ связываться только с определёнными участками ДНК. Не все нуклеотидные основания в ДНК, входящие в сайт связывания ТФ, имеют одинаковую значимость при взаимодействии с белком. Вследствие этого, ТФ обычно связывают не участок со строго определённой первичной структурой, а группу структур с близким сходством, каждую — с разной степенью сродства. Например, хотя консенсусной последовательностью сайта связывания ТАТА-связывающих белков является ТАТАААА, они могут взаимодействовать также с ТАТАТАТ и ТАТАТАА.
Вследствие того, что ТФ взаимодействуют с короткими участками ДНК гетерогенной структуры, потенциальные сайты связывания ТФ могут возникать случайно в достаточно протяженной молекуле ДНК. Маловероятно, однако, что ТФ взаимодействуют со всеми подходящими элементами в геноме.
Различные ограничения, такие как доступность сайтов и наличие кофакторов, могут способствовать направлению ТФ в нужные участки ДНК. Таким образом, затруднительно на основании последовательности генома достоверно предсказать реальное место посадки ТФ на ДНК in vivo. Дополнительная специфичность ТФ может опосредоваться наличием нескольких ДНК связывающих доменов в составе одного белка, которые взаимодействуют с двумя или более смежными последовательностями одновременно.
Клинические аспекты
В связи с ключевой ролью ТФ в процессе реализации наследственной информации, некоторые заболевания человека могут быть вызваны мутациями в генах ТФ. Ниже приведены некоторые наиболее изученные нарушения подобного рода:
- Синдром Ретта. Мутации в гене ТФ MECP2 ассоциированы с синдромом Ретта, нарушением в развитии нервной системы[36].
- Диабеты. Редкая форма диабета, называемая MODY (Maturity onset diabetes of the young) может быть обусловлена мутациями в генах некоторых ТФ[37].
- Developmental verbal dyspraxia. (нарушение речевых функций). Мутации в гене ТФ FOXP2 ассоциированы с развитием данного заболевания, при котором человек не может производить координированных движений, необходимых для речевой функции[38][39].
- Аутоиммунные заболевания. Мутации в гене ТФ FOXP3 связаны с аутоиммунным заболеванием IPEX (immune dysregulation polyendocrinopathy enteropathy X-linked syndrome)[39].
- Рак. Многие факторы транскрипции являются онкогенами или онкосупрессорами, и их мутации или неправильная регуляция могут приводить к развитию рака. Например, синдром Li-Fraumeni обусловлен мутациями в гене онкосупрессора p53[40].
Классификация
ТФ могут классифицироваться по (1) механизму действия, (2) регуляторной функции, (3) структуре ДНК-связывающего домена, а также на натуральные и (5)искусственные.
Механизм действия
По данному признаку выделяют три класса ТФ:
- Главные факторы транскрипции (GTFs), вовлеченные в образование инициационного комплекса. Наиболее важные из них — TFIIA, TFIIB, TFIID, TFIIE, TFIIF, и TFIIH. Они присутствуют во всех клетках и взаимодействуют с кором промотора генов, транскрибируемых РНК-полимеразой второго класса.
- ТФ, взаимодействующие с upstream-участками ДНК, (областями, расположенными до промотора, лежащими относительно него с другой стороны от кодирующей области гена).
- Индуцируемые ТФ сходны с предыдущим классом, но требуют активации либо ингибирования.
Функция
- Конститутивные — присутствуют всегда во всех клетках — главные факторы транскрипции, Sp1, NF1, CCAAT.
- Активируемые (активны в определённых условиях)
- Участвующие в развитии организма (клетко-специфичные) — экспрессия строго контролируется, но, начав экспрессироваться, не требуют дополнительной активации — GATA, HNF, PIT-1, MyoD, Myf5, Hox, Winged Helix.
- Сигнал-зависимые — требуют внешнего сигнала для активации
- внеклеточные сигнал-зависимые — ядерные рецепторы
- внутриклеточные сигнал-зависимые — активируются низкомолекулярными внутриклеточными соединениями — SREBP, p53, одиночные ядерные рецепторы
- мембраносвязанные рецептор-зависимые — фосфорилируются киназами сигнального каскада
Структурная классификация
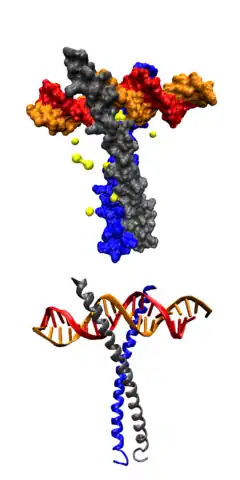
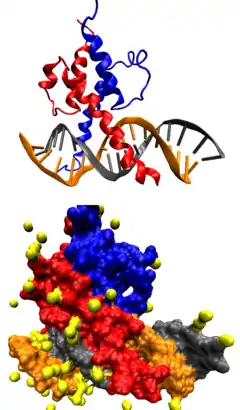
Факторы транскрипции классифицируют на основании сходства первичной структуры (что предполагает и сходство третичной структуры) ДНК-связывающих доменов[41][42][43].
- 1 Надкласс: Basic Domains (Basic-helix-loop-helix)
- 1.1 Класс: Лейциновая молния (bZIP)
- 1.1.1 Семейство: AP-1(-like) components; includes (c-Fos/c-Jun)
- 1.1.2 Семейство: CREB
- 1.1.3 Семейство: C/EBP-like factors
- 1.1.4 Семейство: bZIP / PAR
- 1.1.5 Семейство: Plant G-box binding factors
- 1.1.6 Семейство: ZIP only
- 1.2 Класс: Спираль-петля-спираль (bHLH)
- 1.2.1 Семейство: Ubiquitous (Класс A) factors
- 1.2.2 Семейство: Myogenic transcription factors (MyoD)
- 1.2.3 Семейство: Achaete-Scute
- 1.2.4 Семейство: Tal/Twist/Atonal/Hen
- 1.3 Класс: Спираль-петля-спираль / лейциновая молния factors (bHLH-ZIP)
- 1.4 Класс: NF-1
- 1.4.1 Семейство: NF-1 (NFIC)
- 1.5 Класс: RF-X
- 1.6 Класс: bHSH
- 1.1 Класс: Лейциновая молния (bZIP)
- 2 Надкласс: Zinc-coordinating DNA-binding domains
- 2.1 Класс: Cys4 zinc finger of nuclear receptor type
- 2.1.1 Семейство: Steroid hormone receptors
- 2.1.2 Семейство: Thyroid hormone receptor-like factors
- 2.2 Класс: diverse Cys4 zinc fingers
- 2.2.1 Семейство: GATA-Factors
- 2.3 Класс: Cys2His2 zinc finger domain
- 2.3.1 Семейство: Ubiquitous factors, includes TFIIIA, Sp1
- 2.3.2 Семейство: Developmental / cell cycle regulators; includes Krüppel
- 2.3.4 Семейство: Large factors with NF-6B-like binding properties
- 2.4 Класс: Cys6 cysteine-zinc cluster
- 2.5 Класс: Zinc fingers of alternating composition
- 2.1 Класс: Cys4 zinc finger of nuclear receptor type
- 3 Надкласс: Спираль-поворот-спираль
- 3.1 Класс: Гомеодомен
- 3.1.1 Семейство: Homeo domain only; includes Ubx
- 3.1.2 Семейство: POU domain factors; includes Oct
- 3.1.3 Семейство: Homeo domain with LIM region
- 3.1.4 Семейство: homeo domain plus zinc finger motifs
- 3.2 Класс: Paired box
- 3.2.1 Семейство: Paired plus homeo domain
- 3.2.2 Семейство: Paired domain only
- 3.3 Класс: Fork head / winged helix
- 3.3.1 Семейство: Developmental regulators; includes forkhead
- 3.3.2 Семейство: Tissue-specific regulators
- 3.3.3 Семейство: Cell-cycle controlling factors
- 3.3.0 Семейство: Other regulators
- 3.4 Класс: Heat Shock Factors
- 3.4.1 Семейство: HSF
- 3.5 Класс: Tryptophan clusters
- 3.5.1 Семейство: Myb
- 3.5.2 Семейство: Ets-type
- 3.5.3 Семейство: Interferon regulatory factors
- 3.6 Класс: TEA (transcriptional enhancer factor) domain
- 3.6.1 Семейство: TEA (TEAD1, TEAD2, TEAD3, TEAD4)
- 3.1 Класс: Гомеодомен
- 4 Надкласс: beta-Scaffold Factors with Minor Groove Contacts
- 4.1 Класс: RHR (Rel homology region)
- 4.1.1 Семейство: Rel/ankyrin; NF-kappaB
- 4.1.2 Семейство: ankyrin only
- 4.1.3 Семейство: NF-AT (Nuclear Factor of Activated T-cells) (NFATC1, NFATC2, NFATC3)
- 4.2 Класс: STAT
- 4.2.1 Семейство: STAT
- 4.3 Класс: p53
- 4.3.1 Семейство: p53
- 4.4 Класс: MADS box
- 4.4.1 Семейство: Regulators of differentiation; includes (Mef2)
- 4.4.2 Семейство: Responders to external signals, SRF (serum response factor) (SRF)
- 4.4.1 Семейство: Regulators of differentiation; includes (Mef2)
- 4.5 Класс: beta-Barrel alpha-helix transcription factors
- 4.6 Класс: TATA binding proteins
- 4.6.1 Семейство: TBP
- 4.7.1 Семейство: SOX genes, SRY
- 4.7.2 Семейство: TCF-1 (TCF1)
- 4.7.3 Семейство: HMG2-related, SSRP1
- 4.7.5 Семейство: MATA
- 4.8 Класс: Heteromeric CCAAT factors
- 4.8.1 Семейство: Heteromeric CCAAT factors
- 4.9 Класс: Grainyhead
- 4.9.1 Семейство: Grainyhead
- 4.10 Класс: Cold-shock domain factors
- 4.10.1 Семейство: csd
- 4.11 Класс: Runt
- 4.11.1 Семейство: Runt
- 4.1 Класс: RHR (Rel homology region)
- 0 Надкласс: Другие факторы транскрипции
- 0.1 Класс: Copper fist proteins
- 0.2 Класс: HMGI(Y) (HMGA1)
- 0.2.1 Семейство: HMGI(Y)
- 0.3 Класс: Pocket domain
- 0.4 Класс: E1A-like factors
- 0.5 Класс: AP2/EREBP-related factors
- 0.5.1 Семейство: AP2
- 0.5.2 Семейство: EREBP
- 0.5.3 Надсемейство: AP2/B3
- 0.5.3.1 Семейство: ARF
- 0.5.3.2 Семейство: ABI
- 0.5.3.3 Семейство: RAV
Искусственные факторы транскрипции
Систему CRISPR можно адаптировать так, чтобы она действовала как транскрипционный фактор (crisprTF). Для этого CRISPR-ассоциированный белок, известный как Cas9, изменяют так, чтобы он после связывания с ДНК больше не мог её расщепить. Затем к нему добавляют сегмент, который активирует или подавляет экспрессию генов путём модуляции транскрипционного механизма клетки[44][45][46][47]. В отличие от транскрипционных факторов на базе цинковых пальцев и TAL-эффектора, для узнавания ДНК системе CRISPR-Cas требуется только создание соответствующей последовательности РНК-«гида», а не создание новых белковых доменов фермента, что делает его гораздо более доступным благодаря дешевизне и простоте (вплоть до того что разработан набор правил — «грамматика» — описывающих, как спроектировать синтетический транскрипционный фактор (STFS) и программа для его автоматизированного проектирования[48]).
Примечания
- Coordinated decreases in rRNA gene transcription factors and rRNA synthesis during muscle cell differentiation - PubMed
- Latchman D.S. Transcription factors: an overview (англ.) // Int. J. Biochem. Cell Biol. : journal. — 1997. — Vol. 29, no. 12. — P. 1305—1312. — doi:10.1016/S1357-2725(97)00085-X. — PMID 9570129.
- Karin M. Too many transcription factors: positive and negative interactions (англ.) // New Biol. : journal. — 1990. — Vol. 2, no. 2. — P. 126—131. — PMID 2128034.
- Roeder R.G. The role of general initiation factors in transcription by RNA polymerase II (англ.) // Trends Biochem. Sci. : journal. — 1996. — Vol. 21, no. 9. — P. 327—335. — doi:10.1016/0968-0004(96)10050-5. — PMID 8870495.
- Nikolov D.B., Burley S.K. RNA polymerase II transcription initiation: a structural view (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1997. — Vol. 94, no. 1. — P. 15—22. — doi:10.1073/pnas.94.1.15. — PMID 8990153.
- Lee T.I., Young R.A. Transcription of eukaryotic protein-coding genes (англ.) // Annu. Rev. Genet. : journal. — 2000. — Vol. 34. — P. 77—137. — doi:10.1146/annurev.genet.34.1.77. — PMID 11092823.
- Mitchell P.J., Tjian R. Transcriptional regulation in mammalian cells by sequence-specific DNA binding proteins (англ.) // Science : journal. — 1989. — Vol. 245, no. 4916. — P. 371—378. — doi:10.1126/science.2667136. — PMID 2667136.
- Ptashne M., Gann A. Transcriptional activation by recruitment (англ.) // Nature. — 1997. — Vol. 386, no. 6625. — P. 569—577. — doi:10.1038/386569a0. — PMID 9121580.
- Brivanlou A.H., Darnell J.E. Signal transduction and the control of gene expression (англ.) // Science : journal. — 2002. — Vol. 295, no. 5556. — P. 813—818. — doi:10.1126/science.1066355. — PMID 11823631.
- van Nimwegen E. Scaling laws in the functional content of genomes (англ.) // Trends Genet. : journal. — 2003. — Vol. 19, no. 9. — P. 479—484. — doi:10.1016/S0168-9525(03)00203-8. — PMID 12957540.
- Babu M.M., Luscombe N.M., Aravind L., Gerstein M., Teichmann S.A. Structure and evolution of transcriptional regulatory networks (англ.) // Curr. Opin. Struct. Biol. : journal. — 2004. — Vol. 14, no. 3. — P. 283—291. — doi:10.1016/j.sbi.2004.05.004. — PMID 15193307.
- Lambert S. A., Jolma A., Campitelli L. F., Das P. K., Yin Y., Albu M., Chen X., Taipale J., Hughes T. R., Weirauch M. T. The Human Transcription Factors. (англ.) // Cell. — 2018. — 8 February (vol. 172, no. 4). — P. 650—665. — doi:10.1016/j.cell.2018.01.029. — PMID 29425488.
- Reese J.C. Basal transcription factors (неопр.) // Current opinion in genetics & development. — 2003. — April (т. 13, № 2). — С. 114—118. — doi:10.1016/S0959-437X(03)00013-3. — PMID 12672487.
- Shilatifard A., Conaway R.C., Conaway J.W. The RNA polymerase II elongation complex (англ.) // Annual review of biochemistry : journal. — 2003. — Vol. 72. — P. 693—715. — doi:10.1146/annurev.biochem.72.121801.161551. — PMID 12676794.
- Thomas M.C., Chiang C.M. The general transcription machinery and general cofactors (англ.) // Critical reviews in biochemistry and molecular biology : journal. — 2006. — Vol. 41, no. 3. — P. 105—178. — PMID 16858867.
- Lobe C.G. Transcription factors and mammalian development (неопр.) // Current topics in developmental biology. — 1992. — Т. 27. — С. 351—383. — PMID 1424766.
- Lemons D., McGinnis W. Genomic evolution of Hox gene clusters (англ.) // Science : journal. — 2006. — September (vol. 313, no. 5795). — P. 1918—1922. — doi:10.1126/science.1132040. — PMID 17008523.
- Moens C.B., Selleri L. Hox cofactors in vertebrate development (неопр.) // Developmental biology. — 2006. — March (т. 291, № 2). — С. 193—206. — doi:10.1016/j.ydbio.2005.10.032. — PMID 16515781.
- Ottolenghi C., Uda M., Crisponi L., Omari S., Cao A., Forabosco A., Schlessinger D. Determination and stability of sex (неопр.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 2007. — January (т. 29, № 1). — С. 15—25. — doi:10.1002/bies.20515. — PMID 17187356.
- Pawson T. Signal transduction--a conserved pathway from the membrane to the nucleus (англ.) // Developmental genetics : journal. — 1993. — Vol. 14, no. 5. — P. 333—338. — doi:10.1002/dvg.1020140502. — PMID 8293575.
- Osborne C.K., Schiff R., Fuqua S.A., Shou J. Estrogen receptor: current understanding of its activation and modulation (англ.) // Clin. Cancer Res. : journal. — 2001. — December (vol. 7, no. 12 Suppl). — P. 4338s—4342s; discussion 4411s—4412s. — PMID 11916222.
- Shamovsky I., Nudler E. New insights into the mechanism of heat shock response activation (англ.) // Cell. Mol. Life Sci. : journal. — 2008. — March (vol. 65, no. 6). — P. 855—861. — doi:10.1007/s00018-008-7458-y. — PMID 18239856.
- Benizri E., Ginouvès A., Berra E. The magic of the hypoxia-signaling cascade (англ.) // Cell. Mol. Life Sci. : journal. — 2008. — April (vol. 65, no. 7—8). — P. 1133—1149. — doi:10.1007/s00018-008-7472-0. — PMID 18202826.
- Weber L.W., Boll M., Stampfl A. Maintaining cholesterol homeostasis: sterol regulatory element-binding proteins (англ.) // World J. Gastroenterol. : journal. — 2004. — November (vol. 10, no. 21). — P. 3081—3087. — PMID 15457548.
- Whiteside S.T., Goodbourn S. Signal transduction and nuclear targeting: regulation of transcription factor activity by subcellular localisation (англ.) // Journal of Cell Science : journal. — The Company of Biologists, 1993. — April (vol. 104 ( Pt 4)). — P. 949—955. — PMID 8314906.
- Bohmann D. Transcription factor phosphorylation: a link between signal transduction and the regulation of gene expression (англ.) // Cancer cells (Cold Spring Harbor, N.Y. : 1989) : journal. — 1990. — November (vol. 2, no. 11). — P. 337—344. — PMID 2149275.
- Weigel N.L., Moore N.L. Steroid Receptor Phosphorylation: A Key Modulator of Multiple Receptor Functions (англ.) : journal. — 2007. — PMID 17536004.
- Wärnmark A., Treuter E., Wright A.P., Gustafsson J-Å. Activation functions 1 and 2 of nuclear receptors: molecular strategies for transcriptional activation (англ.) // Mol. Endocrinol. : journal. — 2003. — Vol. 17, no. 10. — P. 1901—1909. — doi:10.1210/me.2002-0384. — PMID 12893880.
- Littlewood T.D., Evan G.I. Transcription factors 2: helix-loop-helix (неопр.) // Protein profile. — 1995. — Т. 2, № 6. — С. 621—702. — PMID 7553065.
- Vinson C., Myakishev M., Acharya A., Mir A.A., Moll J.R., Bonovich M. Classification of human B-ZIP proteins based on dimerization properties (англ.) // Molecular and cellular biology : journal. — 2002. — September (vol. 22, no. 18). — P. 6321—6335. — doi:10.1128/MCB.22.18.6321-6335.2002. — PMID 12192032.
- Wintjens R., Rooman M. Structural classification of HTH DNA-binding domains and protein-DNA interaction modes (англ.) // Journal of molecular biology : journal. — 1996. — September (vol. 262, no. 2). — P. 294—313. — doi:10.1006/jmbi.1996.0514. — PMID 8831795.
- Gehring W.J., Affolter M., Bürglin T. Homeodomain proteins (англ.) // Annual review of biochemistry : journal. — 1994. — Vol. 63. — P. 487—526. — doi:10.1146/annurev.bi.63.070194.002415. — PMID 7979246.
- Dahl E., Koseki H., Balling R. Pax genes and organogenesis (неопр.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 1997. — September (т. 19, № 9). — С. 755—765. — doi:10.1002/bies.950190905. — PMID 9297966.
- Laity J.H., Lee B.M., Wright P.E. Zinc finger proteins: new insights into structural and functional diversity (англ.) // Current opinion in structural biology : journal. — 2001. — February (vol. 11, no. 1). — P. 39—46. — doi:10.1016/S0959-440X(00)00167-6. — PMID 11179890.
- Wolfe S.A., Nekludova L., Pabo C.O. DNA recognition by Cys2His2 zinc finger proteins (англ.) // Annual review of biophysics and biomolecular structure : journal. — 2000. — Vol. 29. — P. 183—212. — doi:10.1146/annurev.biophys.29.1.183. — PMID 10940247.
- Fichou Y., Nectoux J., Bahi-Buisson N., Rosas-Vargas H., Girard B., Chelly J., Bienvenu T. The first missense mutation causing Rett syndrome specifically affecting the MeCP2_e1 isoform. (англ.) // Neurogenetics : journal. — 2008. — November. — PMID 19034540.
- Al-Quobaili F., Montenarh M. Pancreatic duodenal homeobox factor-1 and diabetes mellitus type 2 (review). (англ.) // Int J Mol Med. : journal. — 2008. — Vol. 21(4). — P. 399—404. — PMID 18360684.
- Lai C.S., Fisher S.E., Hurst J.A., Vargha-Khadem F., Monaco AP. A forkhead-domain gene is mutated in a severe speech and language disorder. (англ.) // Nature : journal. — 2001. — Vol. 413(6855). — P. 519—523. — PMID 11586359.
- Banerjee-Basu S., Baxevanis A.D. Structural analysis of disease-causing mutations in the P-subfamily of forkhead transcription factors. (англ.) // Proteins : journal. — 2004. — Vol. 54(4). — P. 639—647. — PMID 14997560.
- Ariffin H., Martel-Planche G., Daud S.S., Ibrahim K., Hainaut P. Li-Fraumeni syndrome in a Malaysian kindred. (неопр.) // Cancer Genet Cytogenet.. — 2008. — Т. 186(1). — С. 49—53. — PMID 18786442.
- Stegmaier P., Kel A.E., Wingender E. Systematic DNA-binding domain classification of transcription factors (англ.) // Genome informatics. International Conference on Genome Informatics : journal. — 2004. — Vol. 15, no. 2. — P. 276—286. — PMID 15706513. Архивировано 19 июня 2013 года.
- Matys V., Kel-Margoulis O.V., Fricke E., Liebich I., Land S., Barre-Dirrie A., Reuter I., Chekmenev D., Krull M., Hornischer K., Voss N., Stegmaier P., Lewicki-Potapov B., Saxel H., Kel A.E., Wingender E. TRANSFAC and its module TRANSCompel: transcriptional gene regulation in eukaryotes (англ.) // Nucleic Acids Res. : journal. — 2006. — Vol. 34, no. Database issue. — P. D108—10. — doi:10.1093/nar/gkj143. — PMID 16381825.
- TRANSFAC® database. Дата обращения: 5 августа 2007. Архивировано 21 марта 2012 года.
- Qi Lei S., Larson Matthew H., Gilbert Luke A., Doudna Jennifer A., Weissman Jonathan S., Arkin Adam P., Lim Wendell A. Repurposing CRISPR as an RNA-Guided Platform for Sequence-Specific Control of Gene Expression (англ.) // Cell. — 2013. — February (vol. 152, no. 5). — P. 1173—1183. — ISSN 0092-8674. — doi:10.1016/j.cell.2013.02.022. — PMID 23452860.
- Farzadfard Fahim, Perli Samuel D., Lu Timothy K. Tunable and Multifunctional Eukaryotic Transcription Factors Based on CRISPR/Cas (англ.) // ACS Synthetic Biology. — 2013. — 11 September (vol. 2, no. 10). — P. 604—613. — ISSN 2161-5063. — doi:10.1021/sb400081r. — PMID 23977949.
- Gilbert Luke A., Larson Matthew H., Morsut Leonardo, Liu Zairan, Brar Gloria A., Torres Sandra E., Stern-Ginossar Noam, Brandman Onn, Whitehead Evan H., Doudna Jennifer A., Lim Wendell A., Weissman Jonathan S., Qi Lei S. CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes // Cell. — 2013. — Июль (т. 154, № 2). — С. 442—451. — ISSN 0092-8674. — doi:10.1016/j.cell.2013.06.044. — PMID 23849981.
- Perez-Pinera Pablo, Kocak D Dewran, Vockley Christopher M, Adler Andrew F, Kabadi Ami M, Polstein Lauren R, Thakore Pratiksha I, Glass Katherine A, Ousterout David G, Leong Kam W, Guilak Farshid, Crawford Gregory E, Reddy Timothy E, Gersbach Charles A. RNA-guided gene activation by CRISPR-Cas9–based transcription factors (англ.) // Nature Methods. — 2013. — 25 July (vol. 10, no. 10). — P. 973—976. — ISSN 1548-7091. — doi:10.1038/nmeth.2600. — PMID 23892895.
- Purcell Oliver, Peccoud Jean, Lu Timothy K. Rule-Based Design of Synthetic Transcription Factors in Eukaryotes (англ.) // ACS Synthetic Biology. — 2014. — 3 January (vol. 3, no. 10). — P. 737—744. — ISSN 2161-5063. — doi:10.1021/sb400134k. — PMID 24933274.