Cas9
Cas9 (англ. CRISPR associated protein 9, CRISPR-ассоциированный белок) — это управляемая при помощи РНК-гидов эндонуклеаза, связанная с адаптивной иммунной системой CRISPR (англ. Clustered Regularly Interspaced Palindromic Repeats) у ряда бактерий, в частности Streptococcus pyogenes. S. pyogenes использует Cas9 для запоминания[1], последующей проверки и разрезания чужеродной ДНК[2], например, ДНК бактериофагов или плазмид.

Cas9 выполняет проверку посредством раскручивания инородной ДНК и определения её комплементарности с двадцатью спаренными основаниями спейсера управляющей РНК. Если субстрат комплементарен управляющей РНК, Cas9 расщепляет чужую ДНК. В этом смысле механизм CRISPR-Cas9 имеет ряд параллелей с механизмом РНК-интерференции (RNAi) у эукариот. Безопасность практического применения данного метода определяется в том числе и тем фактом, является ли искомая последовательность двадцати спаренных оснований уникальной в модифицируемой ДНК.
Использование Cas9 в генной инженерии
Кроме изначальной функции в бактериальном иммунитете, белок Cas9 активно используют для создания точечных разрывов в двойной спирали ДНК, такие разрывы могут приводить к инактивации генов или созданию гетерологичных генов посредством соединения негомологичных концов и соответствующей гомологичной рекомбинации. Вместе с белками ZFN и TALEN, Cas9 становится значимым инструментом редактирования генома.[3] В 2012 года литовский биохимик Виргиниюс Шикшнис одним из первых продемонстрировал программируемое расщепление ДНК одним из компонентов CRISPR-Cas систем белком Cas9, начиная с 2007 года, основным направлением его исследований было изучение недавно открытых CRISPR-Cas систем защиты бактерий от бактериофагов и чужеродного генетического материала.[4][5][6] По словам Шикшниса, его статья даже не была признана серьезной редакцией академического журнала и не была отправлена рецензентам, поэтому время, необходимое для признания её первой, было потерянно.[7] Мартин Шлак сообщил, что Шикшнис представил свою статью, описывающую расщепление ДНК с помощью Cas9, в рецензируемом научном журнале Cell Reports 18 апреля 2012 года. После того, как она была отклонена без экспертной оценки, он месяц спустя отправил ее в рецензируемый научный журнал PNAS, и на рассмотрение и публикацию ушло несколько месяцев. Тем временем американский биохимик Дженнифер Даудна и французский микробиолог Эмманюэль Шарпантье опубликовали свою статью в рецензируемый научный журнал Science, где она была рассмотрена и принята в течение двух недель.[8] Вскоре технология редактирования генома с помощью Cas9 была лицензирована фирмой DuPont[9][10]. За создание новых технологий, позволяющих проводить с помощью CRISPR-Cas9 редактирование генома Эмманюэль Шарпантье и Дженнифер Даудна получили Нобелевскую премию по химии 2020 года.[11] Вызывает удивление тот факт, что из-за патентных ограничений технология редактирования с помощью Cas9 доступна не ученым всего мира, а только владельцам патента, что является препятствием прогрессу науки, разработке лекарств для людей, живущих с серьезными заболеваниями[12].
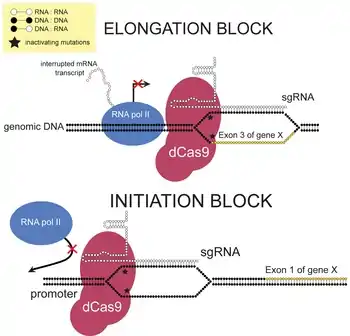
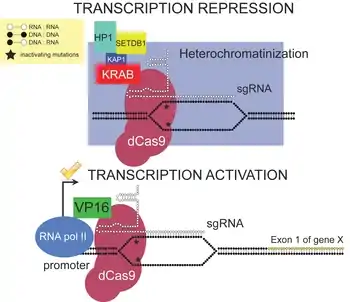
К 2012 году Cas9 приобрёл популярность, потому что он позволяет расщеплять практически любую нуклеотидную последовательность, комплементарную управляющей РНК[2]. Поскольку избирательность Cas9 является следствием комплементарности управляющей РНК и ДНК, а не модификации самого белка (в отличие от случаев TALEN и ZFN), для новых ДНК-мишеней возможна выработка специфических Cas9[13]. Варианты Cas9, которые связывают ДНК, но не расщепляют её (dCas9), могут быть использованы для доставки транскрипционных активаторов или репрессоров к специфичным последовательностям ДНК с целью регулирования транскрипционной активации и репрессии[14][15]. Хотя природный Cas9 требует составления управляющей РНК из двух в корне различных РНК — CRISPR-РНК (crRNA), и транс-активационную РНК (tracrRNA)[2], нацеливание Cas9 было упрощено при помощи выработки единой химерной управляющей РНК. Предполагается, что Cas9 можно будет использовать для изменения генома целых популяций организмов[16]. В 2015 году посредством Cas9 впервые был модифицирован геном человеческого эмбриона[17]. Разработана технология иммуногеномной инженерии гибридом, позволяющая быстро перепрограммировать специфичность их антител с помощью Cas9[18].
Создана технология, которая позволяет редактировать отдельные «буквы» ДНК и РНК, не разрезая цепь ДНК, а путём преобразования одного нуклеотидного основания в другое[19], что позволит лечить врожденные заболевания, вызванные точечными мутациями.[20][21][22]
Используя цитидин-деаминазы или же аденозин-деаминазы соединенные с dCas9 можно выключить экспрессию (путем введения преждевременных стоп-кодонов[23]) или поменять сплайсинг необходимые для синтеза тех или иных белков[24][25]
Создана технология MAGESTIC (multiplexed accurate genome editing with short, trackable, integrated cellular barcodes), которая не только расщепляет ДНК, но ещё и доставляет к месту разрыва кусок ДНК необходимый для точной замены (с помощью гибридного связывающего ДНК белка LexA-Fkh1p), что повышает точность и эффективность редактирования[26][27]. Еще одним инструментом для целевой вставки ДНК может стать CRISPR-ассоциированная транспозаза CAST (CRISPR-associated transposase) цианобактерии Scytonema hofmanni. ShCAST катализирует РНК-управляемую транспозицию ДНК путем однонаправленной вставки ниже протоспейсера сегментов ДНК размером в 60-66 пар нуклеотидов [28].
Использование dCas9
Соединив инактивированную молекулу dCas9, которая связывает ДНК, но не расщепляет её, с нуклеазой FokI, удается получить нуклеазы и рестриктазы для высокоселективного разрезания ДНК[29][30][31]. Разработан также способ избирательного эпигенетического перепрограммирования активности генов с помощью инактивированной молекулы dCas9, соединенной с ферментом, осуществляющим деметилирование ДНК[32]. Причём такое перепрограммирование эпигенома можно проводить даже in vivo[33][34]. Позднее выяснилось, что если укоротить управляющую РНК до 14-15 нуклеотидов, то молекула Cas9 теряет способность разрезать ДНК[35][36]. Используя это свойство удалось создать систему для избирательной активации определённых генов in vivo и проверить её эффективность путем лечения мышей со смоделированными заболеваниями[37]. У этого метода есть только одна проблема: обычно система CRISPR загружается в безвредный вирус, называемый аденоассоциированным вирусом (AAV), который переносит систему в клетку. Но весь белок, состоящий из dCas9 и направляющей РНК, слишком велик, чтобы поместиться в один AAV. Чтобы обойти эту проблему, исследователи загрузили dCas9 в один вирус, а управляющую РНК — в другой[37]. Cозданы трансгенные линии мышей для направленной регуляции генов in vivo путем редактирования эпигенома с помощью систем dCas9p300 и dCas9KRAB. Эти линии мышей являются удобными инструментами для манипулирования экспрессией генов in vivo с помощью различных направляющих РНК.[38]
.jpg.webp)
Повысить эффективность молекулы dCas9 позволяет повторяющийся полипептидный массив из повторяющихся антигенов, называемый SunTag, который может привлекать несколько копий антител, связанных с ферментом, осуществляющим эпигенетическое редактирование, или же с носителем флуоресцентной метки.[40][39]
Еще одно применение dCas9 это программируемая модификация аминокислот в белках хроматина. Например искусственная гистон-протеинкиназа dCas9-dMSK1 позволяет осуществить гиперфосфорилирование серина 28 в гистоне H3 (H3S28ph), играющего роль "пусковой кнопки" в избирательной активации промоторов, и таким образом, повысить экспрессию выбранных генов.[41][42]
Новые способы доставки Cas9 в клетку
Основными требованиями к системе доставки Cas9 помимо высокой эффективности доставки является: (1) конструкция синтезирующая Cas9 не должна встраиваться в геном клетки и не должна быть в клетке постоянно чтобы не мешать работе клетки и не спровоцировать иммунных реакций; (2) средство доставки должно быть способно вместить достаточно большие по размерам фермент Cas9 или кодирующую его мРНК, а также одну или несколько направляющих РНК; (3) оно должно быть удобно для использования в виде инъекций; (4) такое средство вместе с Cas9 и направляющими РНК должно быть достаточно легко воспроизводимым для крупномасштабного производства лекарственного препарата для борьбы с распространенными болезнями. Таким критериям в отличие от вирусных систем доставки, отвечают липидные наночастицы.[43][44] Так, например, была создана биодеградируемая система доставки Cas9 липидной наночастицей, которая позволила после однократного введения достичь in vivo более 97 % ингибирования уровня одного из белков сыворотки крови. При этом такое однократное введение, несмотря на временный характер системы доставки и компонентов системы редактирования, приводило к долговременному ингибированию продолжавшемуся в течение 12 месяцев[45]. Для доставки используют также внеклеточные везикулы[46]
Тем не менее продолжается разработка вирусных частиц для доставки Cas9 и sgРНК. Одной из таких разработок является NanoMEDIC (nanomembrane-derived extracellular vesicles for the delivery of macromolecular cargo)[47] NanoMEDIC эффективно индуцировал редактирование генома в различных типах клеток человека, таких как Т-клетки, моноциты, ИПСК, корковые нейроны, полученные из ИПСК, и миогенные клетки.
Легче переносить в клетки для редактирования генома более компактные белки Cas, поскольку они могут быть упакованы в небольшие по объему средства доставки, такие как дезактивированный аденоассоциированный вирус (AAV). В качестве таких компактных белков можно использовать варианты Cas, обнаруженные в бактериофагах, например CRISPR-CasΦ, который вдвое меньше по молекулярной массе по сравнению с Cas9[48] или генноинженерный CasMINI, который несмотря на малые размеры, на клетках млекопитающих оказался столь же эффективен как и обычный Cas, и при этом лучше проникает в клетки[49]
Модификация Cas9
Модификация Cas9 путем её слияния с хроматин-модулирующими пептидами, полученными из белков группы высокой подвижности HMGN1 и HMGB1, гистона H1 и комплексов ремоделирования хроматина, повышает её активность в несколько раз, особенно в отношении рефрактерных для неё участков хроматина. Эта стратегия слияния, называемая CRISPR-хром (англ. CRISPR-chrom), может быть использована для улучшения эффективности работы нуклеаз Cas9 при модификации генома[50].

CRISPR/Cas9 редактирование с праймером
dCas9-RT редактирование с праймером - в этом методе используется нуклеаза Cas9 (модифицированная в никазу, так что она может создавать разрыв только в одной цепи ДНК) соединенная с обратной транскриптазой (RT) и вместо обычной направляющей РНК используется так называемая pegРНК (prime editing guid RNA - с праймером редактирующая гид РНК). Этот метод, по мнению авторов, является более точным и универсальным, чем все разработанные до сих пор альтернативы CRISPR [51][53][54][52].
Использование dCas9 для визуализации геномных последовательностей in situ
Исследователи разработали новый метод молекулярной визуализации с помощью РНК-направляемой эндонуклеазы CRISPR/dCas9 связанной с меткой. Технология позволила метить выбранные геномные последовательности в ядрах и хромосомах in situ. Метод назван RGEN-ISL. В отличие от классической флуоресцентной гибридизации in situ, RGEN-ISL не требует денатурации ДНК и, следовательно, обеспечивает лучшую сохранность структуры хроматина[55]. Аналогичную функцию выполняет генетический инструмент, названный CRISPR-HOT (CRISPR–Cas9-mediated homology-independent organoid transgenesis), для цветной маркировки определенных генов в органоидах человека[56][57][58].
См. также
Ссылки
- Heler R., Samai P., Modell J. W., Weiner C., Goldberg G. W., Bikard D., Marraffini L. A. Cas9 specifies functional viral targets during CRISPR-Cas adaptation. (англ.) // Nature. — 2015. — Vol. 519, no. 7542. — P. 199—202. — doi:10.1038/nature14245. — PMID 25707807.
- Jinek M., Chylinski K., Fonfara I., Hauer M., Doudna J. A., Charpentier E. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity // Science. — 2012. — 28 июня (т. 337, № 6096). — С. 816—821. — ISSN 0036-8075. — doi:10.1126/science.1225829.
- Carlaw, T. M., Zhang, L. H., & Ross, C. J. (2020). CRISPR/Cas9 Editing: Sparking Discussion on Safety in Light of the Need for New Therapeutics. Human Gene Therapy, 31(15-16), 794-807. doi:10.1089/hum.2020.111
- Sarah Zhang The Battle Over Genome Editing Gets Science All Wrong (англ.). Дата обращения: 19 января 2015.
- Lander ES: The Heroes of CRISPR. Cell 2015, 164:18-28. doi:10.1016/j.cell.2015.12.041
- Gasiunas G, Barrangou R, Horvath P, Siksnys V: Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proc Natl Acad Sci U S A 2012, 109:E2579-2586. doi: 10.1073/pnas.1208507109
- «Imam genų žirkles, iškerpam klaidą, ligos nelieka». Laisvės TV / Freedom TV. LaisvėsTV. 12:22 минут. Transcript.«<...>Well, we were who had sent the article first, but had not much of luck. One editorial office told us they would not send the article to the reviewers. We had sent the article to another journal – and the article was kept too long, maybe on some desk of the editor. So finally we sent it to the third journal and it was published few months later. Meanwhile the scientists from the University of Berkeley had a better luck – they have sent the article later than we and it was accepted and published in 2 weeks. But actually they have sent the article few months later than we.»
- Martin Schlak. Der wahre Mister Crispr (нем.), Spiegel online (18 October 2019).
- DuPont Pioneer Gains Exclusive License for Genome-Editing Technology from Vilnius University (англ.). Дата обращения: 19 января 2015.
- Grushkin D: DuPont in CRISPR-Cas patent land grab. Nat Biotechnol 2016, 34:13-13. doi: 10.1038/nbt0116-13
- Scientifc Background on the Nobel Prize in Chemistry 2020 A TOOL FOR GENOME EDITING
- Wetsman N. (2022). UC Berkeley loses CRISPR patent case. It’s a blow to the university and to biotech companies it partnered with. The Verge.
- Mali Prashant, Esvelt Kevin M, Church George M. Cas9 as a versatile tool for engineering biology // Nature Methods. — 2013. — Vol. 10. — P. 957-963. — ISSN 1548-7091. — doi:10.1038/nmeth.2649.
- Mali Prashant, Aach John, Stranges P Benjamin, Esvelt Kevin M, Moosburner Mark, Kosuri Sriram, Yang Luhan, Church George M. CAS9 transcriptional activators for target specificity screening and paired nickases for cooperative genome engineering // Nature Biotechnology. — 2013. — 1 августа (т. 31, № 9). — С. 833—838. — ISSN 1087-0156. — doi:10.1038/nbt.2675.
- Gilbert Luke A., Larson Matthew H., Morsut Leonardo, Liu Zairan, Brar Gloria A., Torres Sandra E., Stern-Ginossar Noam, Brandman Onn, Whitehead Evan H., Doudna Jennifer A., Lim Wendell A., Weissman Jonathan S., Qi Lei S. CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes // Cell. — 2013. — Июль (т. 154, № 2). — С. 442—451. — ISSN 0092-8674. — doi:10.1016/j.cell.2013.06.044. — PMID 23849981.
- Esvelt Kevin M, Smidler Andrea L, Catteruccia Flaminia, Church George M. Concerning RNA-guided gene drives for the alteration of wild populations // eLife. — 2014. — 17 июля (т. 3). — ISSN 2050-084X. — doi:10.7554/eLife.03401.
- Cyranoski David, Reardon Sara. Chinese scientists genetically modify human embryos // Nature. — 2015. — 22 апреля. — ISSN 1476-4687. — doi:10.1038/nature.2015.17378.
- Pogson M., Parola C., Kelton W. J., Heuberger P., Reddy S. T. Immunogenomic engineering of a plug-and-(dis)play hybridoma platform. (англ.) // Nature communications. — 2016. — Vol. 7. — P. 12535. — doi:10.1038/ncomms12535. — PMID 27531490.
- Komor A. C., Kim Y. B., Packer M. S., Zuris J. A., Liu D. R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. (англ.) // Nature. — 2016. — doi:10.1038/nature17946. — PMID 27096365.
- Gaudelli, N. M., Komor, A. C., Rees, H. A., Packer, M. S., Badran, A. H., Bryson, D. I., & Liu, D. R. (2017). Programmable base editing of A• T to G• C in genomic DNA without DNA cleavage. Nature, 551(7681), 464-471. doi:10.1038/nature24644 PMC 5726555 PMID 29160308
- Xie, J., Huang, X., Wang, X., Gou, S., Liang, Y., Chen, F., ... & Jin, Q. (2020). ACBE, a new base editor for simultaneous C-to-T and A-to-G substitutions in mammalian systems. BMC biology, 18(1), 1-14. doi:10.1186/s12915-020-00866-5 PMC 7510086 PMID 32967664
- Liu, Z., Chen, S., Shan, H., Jia, Y., Chen, M., Song, Y., ... & Li, Z. (2020). Precise base editing with CC context-specificity using engineered human APOBEC3G-nCas9 fusions. BMC biology, 18(1), 111 doi:10.1186/s12915-020-00849-6 PMC 7461344 PMID 32867757
- Billon, P., Bryant, E. E., Joseph, S. A., Nambiar, T. S., Hayward, S. B., Rothstein, R., & Ciccia, A. (2017). CRISPR-mediated base editing enables efficient disruption of eukaryotic genes through induction of STOP codons. Molecular cell, 67(6), 1068-1079. doi:10.1016/j.molcel.2017.08.008 PMC 5610906 PMID 28890334
- Kluesner, M. G., Lahr, W. S., Lonetree, C. L., Smeester, B. A., Claudio-Vázquez, P. N., Pitzen, S. P., ... & Webber, B. R. (2020). CRISPR-Cas9 cytidine and adenosine base editing of splice-sites mediates highly-efficient disruption of proteins in primary cells. bioRxiv. doi:10.1101/2020.04.16.045336
- Levy, J. M., Yeh, W. H., Pendse, N., Davis, J. R., Hennessey, E., Butcher, R., ... & Liu, D. R. (2020). Cytosine and adenine base editing of the brain, liver, retina, heart and skeletal muscle of mice via adeno-associated viruses. Nature Biomedical Engineering, 4(1), 97-110. doi:10.1038/s41551-019-0501-5 PMC 6980783 PMID 31937940
- Roy K. R., Smith J. D., Vonesch S. C., Lin G., Tu C. S., Lederer A. R., Chu A., Suresh S., Nguyen M., Horecka J., Tripathi A., Burnett W. T., Morgan M. A., Schulz J., Orsley K. M., Wei W., Aiyar R. S., Davis R. W., Bankaitis V. A., Haber J. E., Salit M. L., St Onge R. P., Steinmetz L. M. Multiplexed precision genome editing with trackable genomic barcodes in yeast. (англ.) // Nature Biotechnology. — 2018. — July (vol. 36, no. 6). — P. 512—520. — doi:10.1038/nbt.4137. — PMID 29734294.
- Taking CRISPR from clipping scissors to word processor. New platform transforms gene editor into precision tool
- Strecker J., Ladha A., Gardner Z., et al., (2019). RNA-guided DNA insertion with CRISPR-associated transposases. Science, eaax9181 doi:10.1126/science.aax9181
- Tsai S. Q., Wyvekens N., Khayter C., Foden J. A., Thapar V., Reyon D., Goodwin M. J., Aryee M. J., Joung J. K. Dimeric CRISPR RNA-guided FokI nucleases for highly specific genome editing // Nature Biotechnology. — 2014. — Vol. 32, no. 6. — P. 569—576. — doi:10.1038/nbt.2908. — PMID 24770325.
- Guilinger J. P., Thompson D. B., Liu D. R. Fusion of catalytically inactive Cas9 to FokI nuclease improves the specificity of genome modification. (англ.) // Nature biotechnology. — 2014. — Vol. 32, no. 6. — P. 577—582. — doi:10.1038/nbt.2909. — PMID 24770324.
- Wyvekens N., Topkar V. V., Khayter C., Joung J. K., Tsai S. Q. Dimeric CRISPR RNA-Guided FokI-dCas9 Nucleases Directed by Truncated gRNAs for Highly Specific Genome Editing. (англ.) // Human gene therapy. — 2015. — Vol. 26, no. 7. — P. 425—431. — doi:10.1089/hum.2015.084. — PMID 26068112.
- Xu X., Tao Y., Gao X., Zhang L., Li X., Zou W., Ruan K., Wang F., Xu G. L., Hu R. A CRISPR-based approach for targeted DNA demethylation. (англ.) // Cell discovery. — 2016. — Vol. 2. — P. 16009. — doi:10.1038/celldisc.2016.9. — PMID 27462456.
- Morita S., Noguchi H., Horii T., Nakabayashi K., Kimura M., Okamura K., Sakai A., Nakashima H., Hata K., Nakashima K., Hatada I. Targeted DNA demethylation in vivo using dCas9-peptide repeat and scFv-TET1 catalytic domain fusions. (англ.) // Nature biotechnology. — 2016. — doi:10.1038/nbt.3658. — PMID 27571369.
- Xu, X.; Hulshoff, M.S.; Tan, X.; Zeisberg, M.; Zeisberg, E.M. CRISPR/Cas Derivatives as Novel Gene Modulating Tools: Possibilities and In Vivo Applications. Int. J. Mol. Sci. 2020, 21(9), 3038; https://doi.org/10.3390/ijms21093038
- Dahlman J. E., Abudayyeh O. O., Joung J., Gootenberg J. S., Zhang F., Konermann S. Orthogonal gene knockout and activation with a catalytically active Cas9 nuclease. (англ.) // Nature Biotechnology. — 2015. — November (vol. 33, no. 11). — P. 1159—1161. — doi:10.1038/nbt.3390. — PMID 26436575.
- Kiani S., Chavez A., Tuttle M., Hall R. N., Chari R., Ter-Ovanesyan D., Qian J., Pruitt B. W., Beal J., Vora S., Buchthal J., Kowal E. J., Ebrahimkhani M. R., Collins J. J., Weiss R., Church G. Cas9 gRNA engineering for genome editing, activation and repression. (англ.) // Nature Methods. — 2015. — November (vol. 12, no. 11). — P. 1051—1054. — doi:10.1038/nmeth.3580. — PMID 26344044.
- Liao H. K., Hatanaka F., Araoka T., Reddy P., Wu M. Z., Sui Y., Yamauchi T., Sakurai M., O'Keefe D. D., Núñez-Delicado E., Guillen P., Campistol J. M., Wu C. J., Lu L. F., Esteban C. R., Izpisua Belmonte J. C. In Vivo Target Gene Activation via CRISPR/Cas9-Mediated Trans-epigenetic Modulation. (англ.) // Cell. — 2017. — 14 December (vol. 171, no. 7). — P. 1495—1507. — doi:10.1016/j.cell.2017.10.025. — PMID 29224783.
- Gemberling, M., Siklenka, K., Rodriguez, E., Eisinger, K., Barrera, A., Liu, F., ... & Gersbach, C. (2021). Transgenic mice for in vivo epigenome editing with CRISPR-based systems. bioRxiv. https://doi.org/10.1101/2021.03.08.434430
- Morita, S., Horii, T., Kimura, M., & Hatada, I. (2020). Synergistic Upregulation of Target Genes by TET1 and VP64 in the dCas9–SunTag Platform. International journal of molecular sciences, 21(5), 1574. doi:10.3390/ijms21051574 PMC 7084704 PMID 32106616
- Tanenbaum, M. E., Gilbert, L. A., Qi, L. S., Weissman, J. S., & Vale, R. D. (2014). A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell, 159(3), 635-646. doi:10.1016/j.cell.2014.09.039 PMC 4252608 PMID 25307933
- Li, J., Mahata, B., Escobar, M. et al. (2021). Programmable human histone phosphorylation and gene activation using a CRISPR/Cas9-based chromatin kinase. Nat Commun 12, 896, https://doi.org/10.1038/s41467-021-21188-2
- New CRISPR tech targets human genome's complex code. Programmable CRISPR/Cas9-based kinase offers insights into, control over regulatory histone proteins. ScienceDaily, 9 February 2021
- Wang, M., Zuris, J. A., Meng, F., Rees, H., Sun, S., Deng, P., ... & Xu, Q. (2016). Efficient delivery of genome-editing proteins using bioreducible lipid nanoparticles. Proceedings of the National Academy of Sciences, 113(11), 2868-2873.
- Qiu, M., Glass, Z., Chen, J., Haas, M., Jin, X., Zhao, X., ... & Xu, Q. (2021). Lipid nanoparticle-mediated codelivery of Cas9 mRNA and single-guide RNA achieves liver-specific in vivo genome editing of Angptl3. Proceedings of the National Academy of Sciences, 118(10). PMID 33649229 doi:10.1073/pnas.2020401118
- Finn J. D., Smith A. R., Patel M. C., Shaw L., Youniss M. R., van Heteren J., Dirstine T., Ciullo C., Lescarbeau R., Seitzer J., Shah R. R., Shah A., Ling D., Growe J., Pink M., Rohde E., Wood K. M., Salomon W. E., Harrington W. F., Dombrowski C., Strapps W. R., Chang Y., Morrissey D. V. A Single Administration of CRISPR/Cas9 Lipid Nanoparticles Achieves Robust and Persistent In Vivo Genome Editing. (англ.) // Cell Reports. — 2018. — 27 February (vol. 22, no. 9). — P. 2227—2235. — doi:10.1016/j.celrep.2018.02.014. — PMID 29490262.
- Horodecka, K., & Düchler, M. (2021). CRISPR/Cas9: Principle, Applications, and Delivery through Extracellular Vesicles. International Journal of Molecular Sciences, 22(11), 6072. PMID 34199901 PMC 8200053 doi:10.3390/ijms22116072
- Gee, P., Lung, M. S., Okuzaki, Y., Sasakawa, N., Iguchi, T., Makita, Y., ... & Wang, X. H. (2020). Extracellular nanovesicles for packaging of CRISPR-Cas9 protein and sgRNA to induce therapeutic exon skipping. Nature Communications, 11(1), 1-18. PMC 7070030 PMID 32170079 doi:10.1038/s41467-020-14957-y
- Pausch P., Al-Shayeb1 B., Bisom-Rapp E, et al. (2020). CRISPR-CasΦ from huge phages is a hypercompact genome editor. Science. 369(6501), 333-337 doi:10.1126/science.abb1400
- Xiaoshu Xu, Augustine Chemparathy, Leiping Zeng, Hannah R. Kempton, Stephen Shang, Muneaki Nakamura, Lei S. Qi, (2021). Engineered miniature CRISPR-Cas system for mammalian genome regulation and editing, Molecular Cell, https://doi.org/10.1016/j.molcel.2021.08.008.
- Ding X., Seebeck T., Feng Y., Jiang Y., Davis G. D., Chen F. Improving CRISPR-Cas9 Genome Editing Efficiency by Fusion with Chromatin-Modulating Peptides. (англ.) // The CRISPR Journal. — 2019. — February (vol. 2). — P. 51—63. — doi:10.1089/crispr.2018.0036. — PMID 31021236.
- Anzalone, A. V., Randolph, P. B., Davis, J. R., Sousa, A. A., Koblan, L. W., Levy, J. M., ... & Liu, D. R. (2019). Search-and-replace genome editing without double-strand breaks or donor DNA. Nature, 1-1. doi:10.1038/s41586-019-1711-4
- Geurts, M. H., de Poel, E., Pleguezuelos-Manzano, C., Oka, R., Carrillo, L., Andersson-Rolf, A., ... & Clevers, H. (2021). Evaluating CRISPR-based prime editing for cancer modeling and CFTR repair in organoids. Life Science Alliance, 4(10). PMID 34373320 doi:10.26508/lsa.202000940
- Ledford, H. (2019). Super-precise new CRISPR tool could tackle a plethora of genetic diseases. Nature, 574(7779), 464-465 doi:10.1038/d41586-019-03164-5
- New “Prime Editing” Method Makes Only Single-Stranded DNA Cuts. The Scientist
- Ishii T., Schubert V., Khosravi S., Dreissig S., Metje-Sprink J., Sprink T., Fuchs J., Meister A., Houben A. RNA-guided endonuclease - in situ labelling (RGEN-ISL): a fast CRISPR/Cas9-based method to label genomic sequences in various species. (англ.) // The New Phytologist. — 2019. — May (vol. 222, no. 3). — P. 1652—1661. — doi:10.1111/nph.15720. — PMID 30847946.
- Artegiani, B., Hendriks, D., Beumer, J. et al. (2020). Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing. Nat Cell Biol
- Yang, Q., Oost, K.C. & Liberali, P. (2020). Engineering human knock-in organoids. Nat Cell Biol
- CRISPR-HOT: a new tool to “color” specific genes and cells
Литература
- Джагаров Д. Э. (2014). Умные ножницы для ДНК. «Химия и жизнь -XXI век» № 7
- Джагаров Д. Э. (2014). Новый метод генной инженерии — CRISPR/Cas9. Academia.edu
- Дарья Спасская (2018). CRISPR-активация одного гена превратила «взрослые» клетки обратно в стволовые. N+1
- Монография (2020). “Методы редактирования генов и геномов”. под ред. С.М. Закияна, С.П. Медведева, Е.В. Дементьевой, В.В. Власова. Монография состоит из 26 глав, в которых авторы детально описывают протоколы применения CRISPR‐опосредованных систем для модификации геномов различных организмов: от дрожжей до культивируемых клеток человека.
- Гоглева А. А., Артамонова И. И. (2014). CRISPR-системы: структура и гипотетические функции. Природа 6 (2014), 16-21;
- Гоглева А. А., Артамонова И. И. (2014). CRISPR-системы: механизм действия и применения. Природа 7 (2014), 3-9.
- Артамонова И.(2014). CRISPR-системы: иммунизация прокариот «биомолекула.ру»
- Руководство по пониманию и использованию CRISPR (на англ) Загрузите бесплатную электронную книгу здесь http://powered.synthego.com/crispr-101 или здесь https://www.synthego.com/resources/gene-knockout-ebook?
- Asmamaw, M., & Zawdie, B. (2021). Mechanism and Applications of CRISPR/Cas-9-Mediated Genome Editing. Biologics: Targets & Therapy, 15, 353. PMID 34456559 PMC 8388126 doi:10.2147/BTT.S326422
- How To Conduct Successful CRISPR Experiments eBook Загрузите бесплатную электронную книгу здесь http://powered.synthego.com/how-to-conduct-successful-crispr-experiments-ebook
- Bravo, J.P.K., Liu, MS., Hibshman, G.N. et al. (2022). Structural basis for mismatch surveillance by CRISPR–Cas9. Nature. doi:10.1038/s41586-022-04470-1 Новая версия фермента названная SuperFi-Cas9 в 4000 раз реже вносит ошибочные (не целевые) разрезы, но при этом работает так же быстро, как природный Cas9.
- Watters, K. E., Kirkpatrick, J., Palmer, M. J., & Koblentz, G. D. (2021). The CRISPR revolution and its potential impact on global health security. Pathogens and Global Health, 1-13. PMID 33590814 doi:10.1080/20477724.2021.1880202
- Liu, H., Wang, L., & Luo, Y. Blossom of CRISPR technologies and applications in disease treatment (англ.) // Synth Syst Biotechnol : journal. — 2018. — Vol. 3, no. 4. — P. 217—228. — doi:10.1016/j.synbio.2018.10.003. — PMID 30370342.
- Li, B., Niu, Y., Ji, W., & Dong, Y. Strategies for the CRISPR-Based Therapeutics (англ.) // Trends in Pharmacological Sciences : journal. — 2020. — Vol. 41, no. 1. — P. 55-65. — doi:10.1016/j.tips.2019.11.006.
- Kazuto Yoshimi, Yayoi Kunihiro, Takehito Kaneko, Hitoshi Nagahora, Birger Voigt, Tomoji Mashimo. ssODN-mediated knock-in with CRISPR-Cas for large genomic regions in zygotes (англ.) // Nature Communications : journal. — Nature Publishing Group, 2016. — Vol. 7. — P. 10431. — doi:10.1038/NCOMMS10431. — PMID 26786405.
- CRISPR: gene editing is just the beginning. The real power of the biological tool lies in exploring how genomes work. Nature 531, 156—159 (10 March 2016) doi:10.1038/531156a(на англ.) Обзор разных способов применения Cas9. Хорошие иллюстрации.
- CRISPR-Cas: A Laboratory Manual Edited by Jennifer Doudna, University of California, Berkeley; Prashant Mali, University of California, San Diego
- Slaymaker, I. M., Gao, L., Zetsche, B., Scott, D. A., Yan, W. X., & Zhang, F. Rationally engineered Cas9 nucleases with improved specificity (англ.) // Science : journal. — 2016. — Vol. 351, no. 6268. — P. 84—88. — doi:10.1126/science.aad5227.
- Kleinstiver B. P., Pattanayak V., Prew M. S., , & J. Keith Joung et al. High-fidelity CRISPR–Cas9 nucleases with no detectable genome-wide off-target effects (англ.) // Nature : journal. — 2016. — doi:10.1038/nature16526.
- Mandegar M. A., Huebsch N., Frolov E. B., , & Conklin B. R. et al. CRISPR Interference Efficiently Induces Specific and Reversible Gene Silencing in Human iPSCs (англ.) // Cell Stem Cell : journal. — 2016. — doi:10.1016/j.stem.2016.01.022.
- Davis, K. M., Pattanayak, V., Thompson, D. B., Zuris, J. A., & Liu, D. R. Small molecule–triggered Cas9 protein with improved genome-editing specificity (англ.) // Nature chemical biology : journal. — 2015. — Vol. 11, no. 5. — P. 316—318. — doi:10.1038/nchembio.1793.
- Zetsche, B., Volz, S. E., & Zhang, F. A split-Cas9 architecture for inducible genome editing and transcription modulation (англ.) // Nature biotechnology : journal. — 2015. — Vol. 33, no. 2. — P. 139—142. — doi:10.1038/nbt.3149.
- Zlotorynski, E. Genome engineering: Structure-guided improvement of Cas9 specificity (англ.) // Nature Reviews Molecular Cell Biology : journal. — 2016. — P. 3—3.
- Chu, V. T., Weber, T., Wefers, B., Wurst, W., Sander, S., Rajewsky, K., & Kühn, R. (2015). Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells. Nature biotechnology. doi:10.1038/nbt.3198
- van Erp PB et al.(2015). The history and market impact of CRISPR RNA-guided nucleases. Curr Opin Virol.;12:85-90. PMID 25914022
- Cong, L., & Zhang, F. (2015). Genome Engineering Using CRISPR-Cas9 System. In Chromosomal Mutagenesis. Methods in Molecular Biology Vol. 1239, 2015, pp 197–217. Springer New York.
- Belhaj, K., Chaparro-Garcia, A., Kamoun, S., Patron, N. J., & Nekrasov, V. (2015). Editing plant genomes with CRISPR/Cas9. Current opinion in biotechnology, 32, 76-84. doi:10.1016/j.copbio.2014.11.007
- Kennedy E.M., Cullen B.R. (2015). Bacterial CRISPR/Cas DNA endonucleases: A revolutionary technology that could dramatically impact viral research and treatment. Virology, 479—480, 213—220 doi:10.1016/j.virol.2015.02.024
- Junwei Shi, Eric Wang, Joseph P Milazzo, Zihua Wang, Justin B Kinney, Christopher R Vakoc.(2015). Discovery of cancer drug targets by CRISPR-Cas9 screening of protein domains. Nature Biotechnology,; doi:10.1038/nbt.3235
- Michael Boettcher, Michael T. McManus (2015). Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Molecular Cell, 58(4), p575-585 DOI https://dx.doi.org/10.1016/j.molcel.2015.04.028
- Heidi Ledford. A powerful gene-editing technology is the biggest game changer to hit biology since PCR. But with its huge potential come pressing concerns. (англ.) // NATURE : journal. — 2015. — Vol. 522. — P. 20—24. — doi:10.1038/522020a.
- CasFinder: Flexible algorithm for identifying specific Cas9 targets in genomes см. также: Chari R, Mali P, Moosburner M, Church GM (2015). Unraveling CRISPR-Cas9 genome engineering parameters via a library-on-library approach. Nature Methods (in press).
- Amanda Andersson-Rolf , & Bon-Kyoung Koo et al. One-step generation of conditional and reversible gene knockouts. (англ.) // Nature Methods : journal. — 2017. — doi:10.1038/nmeth.4156.CRISPR-FLIP, a strategy that provides an efficient, rapid and scalable method for biallelic conditional gene knockouts in diploid or aneuploid cells.
- SØREN HOUGH (2017). COMPARING DNA, RNA AND RNP-BASED CRISPR DELIVERY. DESKGEN
- Nakajima, K., Zhou, Y., Tomita, A., Hirade, Y., Gurumurthy, C. B., & Nakada, S. (2018). Precise and efficient nucleotide substitution near genomic nick via noncanonical homology-directed repair. Genome research, 28(2), 223—230. PMC 5793786 doi:10.1101/gr.226027.117
- Qiu, X. Y., Zhu, L. Y., Zhu, C. S., Ma, J. X., Hou, T., Wu, X. M., … & Zhu, L. (2018). Highly Effective and Low-Cost MicroRNA Detection with CRISPR-Cas9. ACS synthetic biology, 7(3), 807—813. doi:10.1021/acssynbio.7b00446 PMID 29486117
- Ting Wang, Yong Liu, Huan-Huan Sun, Bin-Cheng Yin, Bang-Ce Ye.(2019). An RNA-Guided Cas9 Nickase-Based Method for Universal Isothermal DNA Amplification. Angewandte Chemie International Edition, doi:10.1002/anie.201901292
- Smith, C. J., Castanon, O., Said, K., Volf, V., Khoshakhlagh, P., Hornick, A., ... & Myllykallio, H. (2019). Enabling large-scale genome editing by reducing DNA nicking. bioRxiv 574020 doi:10.1101/574020 Метод позволяет одновременно редактировать более 10 000 локусов в клетках человека.
- Hirosawa, M., Fujita, Y., & Saito, H. (2019). Cell-type-specific CRISPR activation with microRNA-responsive AcrllA4 switch. ACS synthetic biology. 8(7), 1575-1582 PMID 31268303
- Wang, D., Zhang, F., & Gao, G. (2020). CRISPR-Based Therapeutic Genome Editing: Strategies and In Vivo Delivery by AAV Vectors. Cell, 181(1), 136-150. PMID 32243786 doi:10.1016/j.cell.2020.03.023
- Alagoz, M., & Kherad, N. (2020). Advance genome editing technologies in the treatment of human diseases: CRISPR therapy. International Journal of Molecular Medicine. https://doi.org/10.3892/ijmm.2020.4609
- STEVEN LEVY (2020). Could Crispr Be Humanity's Next Virus Killer?. WIRED
- Timothy R. Abbott, Girija Dhamdhere, Yanxia Liu et al., (2020). Development of CRISPR as an Antiviral Strategy to Combat SARS-CoV-2 and Influenza. Cell https://doi.org/10.1016/j.cell.2020.04.020
- Xie H, Ge X, Yang F, Wang B, Li S, Duan J, et al. (2020). High-fidelity SaCas9 identified by directional screening in human cells. PLoS Biol 18(7): e3000747. https://doi.org/10.1371/journal.pbio.3000747
- Armando Casas-Mollano J., Zinselmeier M. H. , Erickson S.E. , and Smanski M.J. (2020). CRISPR-Cas Activators for Engineering Gene Expression in Higher Eukaryotes. CRISPR J.; 3(5): 350–364 doi:10.1089/crispr.2020.0064 PMC 7580621
- Horodecka K, Düchler M. CRISPR/Cas9: Principle, Applications, and Delivery through Extracellular Vesicles. International Journal of Molecular Sciences. 2021; 22(11):6072. https://doi.org/10.3390/ijms22116072
- Denes CE, Cole AJ, Aksoy YA, Li G, Neely GG, Hesselson D. (2021). Approaches to Enhance Precise CRISPR/Cas9-Mediated Genome Editing. International Journal of Molecular Sciences. 22(16):8571. https://doi.org/10.3390/ijms22168571
- Pan, C., Wu, X., Markel, K. et al. (2021). CRISPR–Act3.0 for highly efficient multiplexed gene activation in plants. Nat. Plants https://doi.org/10.1038/s41477-021-00953-7
- Park, J., Yoon, J., Kwon, D., Han, M. J., Choi, S., Park, S., ... & Choe, S. (2021). Enhanced genome editing efficiency of CRISPR PLUS: Cas9 chimeric fusion proteins. Scientific Reports, 11(1), 1-9. PMID 34376729 PMC 8355345 doi:10.1038/s41598-021-95406-8
- Corsi, G. I., Gadekar, V. P., Gorodkin, J., & Seemann, S. E. (2021). CRISPRroots: on-and off-target assessment of RNA-seq data in CRISPR–Cas9 edited cells. Nucleic Acids Research, 50(4), e20 PMID 34850137 doi:10.1093/nar/gkab1131

