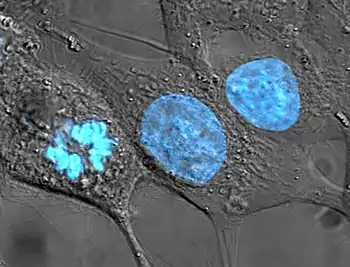
Клеточное ядро
Кле́точное ядро́ (лат. nucleus) — окружённая двумя мембранами органелла (компартмент) эукариотической клетки[1] (в клетках прокариот ядро отсутствует). Обычно в клетках эукариот имеется одно ядро, однако некоторые типы клеток, например, эритроциты млекопитающих, не имеют ядра, а другие содержат несколько ядер.
В ядре заключена бо́льшая часть генетического материала клетки, представленного хромосомами, длинными линейными молекулами ДНК, связанными с белками. Генетический материал, локализованный в хромосомах, составляет ядерный геном. Ядро поддерживает целостность генетического материала, а входящие в его состав структуры управляют клеточными процессами, регулируя экспрессию генов, поэтому ядро является, по сути, контролирующим центром клетки. К основным структурам, из которых состоит ядро, относят хроматин, ядрышко, ядерную оболочку — двойную мембрану, окружающую ядро и изолирующую его от цитоплазмы, а также ядерный матрикс, который включает ядерную ламину — сеть филаментов, обеспечивающая механическую поддержку ядра, подобно цитоскелету в цитоплазме.
Поскольку ядерная оболочка непроницаема для крупных молекул, транспорт молекул через ядерную оболочку (ядерный транспорт) обеспечивают ядерные поры. Поры пронизывают обе ядерные мембраны и формируют сквозной канал, через который малые молекулы и ионы проходят свободно, а крупные молекулы активно транспортируются с участием белков-переносчиков. Перенос через ядерные поры таких крупных молекул, как белки и РНК, необходим для экспрессии генов, поддержания хромосом и сборки рибосомных субъединиц. Хотя внутри ядра нет окружённых мембраной субкомпартментов, его внутреннее содержимое неоднородно и содержит ряд ядерных телец, которые состоят из особых белков, молекул РНК и частей хромосом. Самое известное ядерное тельце — ядрышко, в котором происходит сборка рибосомных субъединиц. После образования в ядрышке рибосомные субъединицы транспортируются в цитоплазму, где они осуществляют трансляцию мРНК.
История изучения
Ядро стало первой из органелл, открытых учёными-естествоиспытателями в составе клетки. Самые ранние рисунки клеток и их ядер принадлежат основоположнику научной микроскопии Антони ван Левенгуку (1633—1723), который наблюдал ядро в эритроцитах лосося[2]. Описания ядра также выполнил Франц Бауэр в 1802 году[3], а более детальное описание было выполнено в 1831 году шотландским ботаником Робертом Броуном и представлено на собрании Лондонского Линнеевского общества. Броун изучал орхидеи под микроскопом и обнаружил в клетках наружного слоя цветка непрозрачные области, которые он называл «ареолами» или «ядрами»[4].
Броун не делал предположений относительно функций ядра. В 1838 году Маттиас Шлейден предположил, что ядро участвует в образовании новых клеток, поэтому он ввёл для обозначения ядер термин «цитобласт» (клеточный строитель). Он был уверен, что наблюдал сборку новых клеток вокруг «цитобластов». Убеждённым оппонентом этого взгляда был Франц Мейен, описавший клетки, размножающиеся посредством деления, и считавший, что у многих клеток может не быть ядра. Идея об образовании клеток de novo, то есть с нуля, посредством цитобластов или иначе, противоречила работам Роберта Ремака (1852) и Рудольфа Вирхова (1855), которые окончательно утвердили новую парадигму, утверждающую, что клетки могут образовываться только из клеток («Omnis cellula e cellula»). Функции ядра оставались неясными[5].
Между 1877 и 1878 годами Оскар Гертвиг опубликовал несколько работ по оплодотворению яиц у морских ежей, в которых показал, что при оплодотворении ядро сперматозоида проникает внутрь яйцеклетки и сливается с её ядром. Впервые было показано, что новая особь развивается из единственной клетки, имеющей ядро. Это противоречило теории Эрнста Геккеля, согласно которой в ходе эмбрионального развития особи последовательно проходятся все этапы филогении её вида, а потому, в частности, поколение первых клеток с ядром якобы образуется из «монерулы» — бесструктурной массы первичной слизи. В связи с этим необходимость ядра сперматозоида для оплодотворения некоторое время была предметом дискуссий. Однако Гертвиг подтвердил свои наблюдения исследованиями на других животных, включая земноводных и моллюсков. В 1884 году Эдуард Страсбургер показал то же самое для растений. Это проложило путь к гипотезе о том, что ядро передаёт наследственный материал. В 1873 году Август Вейсман высказал идею о равнозначности материнского и отцовского материала для наследственности. Функция ядра как носителя генетической информации стала очевидной лишь позже, после открытия митоза и открытия заново законов Менделя в начале XX столетия. На основании этих открытий была сформулирована хромосомная теория наследственности[5].
Структуры

Ядро — крупнейшая органелла животных клеток[6]. У млекопитающих диаметр ядра составляет примерно 6 мкм, а само ядро составляет около 10 % объёма клетки[7]. Вязкая жидкость, заполняющая ядро, называется нуклеоплазмой и по химическому составу близка к цитозолю, окружающему ядро[8].
Ядерная оболочка и ядерные поры
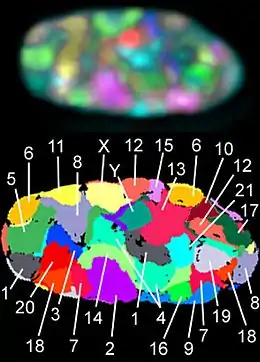
 Строение клеточного ядра |
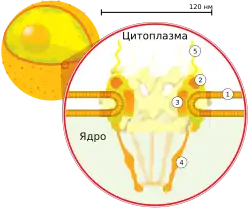 Поперечный разрез ядерной поры. Цифрами обозначены: 1 — ядерная оболочка, 2 — внешнее кольцо, 3 — спицы, 4 — корзина, 5 — филаменты |
Ядерная оболочка состоит из двух мембран (наружной и внутренней), которые расположены параллельно на расстоянии от 10 до 50 нм. Ядерная оболочка полностью окружает ядро, отделяя генетический материал клетки от цитоплазмы и служа барьером, предотвращающим свободную диффузию макромолекул между нуклеоплазмой и цитоплазмой. Наружная ядерная мембрана продолжается в мембрану шероховатого эндоплазматического ретикулума (ЭПР) и покрыта рибосомами. Промежуток между ядерными мембранами называется перинуклеарным пространством и продолжается в люмен ЭПР[9].
Ядерные поры, представляющие собой заполненные водой каналы в ядерной оболочке[1], состоят из множества белков, называемых нуклеопоринами. У человека масса пор составляет около 120 000 кДа,что в 40 раз больше массы рибосомы[10]; при этом у дрожжей в состав ядерных пор входит около 50 белков, а у позвоночных — несколько сотен[6]. Хотя диаметр пор составляет 100 нм, ширина щели, через которую могут проходить молекулы, из-за наличия внутри пор регуляторных систем составляет всего 9 нм. В такую щель могут проходить водорастворимые малые молекулы, но не крупные молекулы — такие, как нуклеиновые кислоты и большие белки; для переноса этих молекул в ядро необходим активный (то есть энергозатратный) транспорт. На оболочке ядра типичной клетки млекопитающего располагается от 3000 до 4000 пор[11], и у каждой в месте слияния двух ядерных мембран находится кольцевая структура, имеющая 8 осей симметрии[12]. К кольцу прикрепляется особая структура, известная как ядерная корзина, которая выдаётся в нуклеоплазму, а несколько её филаментов выдаются в цитоплазму. Обе структуры необходимы для опосредования связывания транспортных ядерных белков[6].
Большинство белков, субъединицы рибосом и некоторые ДНК переносятся через ядерные поры посредством семейства транспортных факторов, известных как кариоферины. Кариоферины, опосредующие транспорт в ядро, также называются импортинами, а опосредующие транспорт из ядра — экспортинами. Большинство кариоферинов непосредственно взаимодействуют со своим грузом, но некоторые используют для этого адаптерные белки[13]. Стероидные гормоны (такие, как кортизол и альдостерон), а также другие жирорастворимые малые молекулы могут диффундировать в цитоплазму внутрь клетки через клеточную мембрану; в цитоплазме они связываются с белковыми ядерными рецепторами, которые доставляют их в ядро. Здесь ядерные рецепторы, связанные со своими лигандами, функционируют как транскрипционные факторы, а в отсутствие лиганда многие рецепторы функционируют как гистондеацетилазы, подавляющие экспрессию некоторых генов[6].
Ядерная ламина
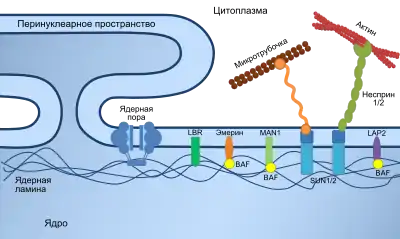
В клетках животных механическую поддержку ядра обеспечивают две сети из промежуточных филаментов: ядерная ламина, представляющая собой сеть промежуточных филаментов на внутренней поверхности ядра, а также менее организованные филаменты на цитозольной поверхности ядра. Обе системы филаментов обеспечивают поддержку ядра и служат для закрепления хромосом и ядерных пор[7].
Ядерная ламина состоит в основном из белков, известных как ламины. Как и все белки, ламины синтезируются в цитоплазме и далее транспортируются внутрь ядра, где они вставляются в ядерную ламину[14][15]. Расположенные на наружной стороне ядерной оболочки белки (такие, как несприн), связываются с элементами цитоскелета, что обеспечивает структурную поддержку ядру. Ламины также обнаруживаются в нуклеоплазме, где они образуют другую регулярную структуру, известную как нуклеоплазматическая вуаль (англ. nucleoplasmic veil)[16]; последнюю можно визуализировать с использованием флуоресцентной микроскопии. Функция вуали неизвестна, но известно, что её нет в ядрышке и она присутствует в интерфазе клеточного цикла[17]. Входящие в состав вуали ламины (такие, как LEM3) связываются с хроматином, и нарушения в их структуре подавляют транскрипцию белоккодирующих генов[18].
Как и другие белки промежуточных филаментов, мономеры ламинов содержат α-спиральный домен, используемый двумя мономерами, чтобы обвиться вокруг друг друга, образуя димер, имеющий структуру биспирали. Два димера далее связываются своими боковыми сторонами в антипараллельной ориентации, образуя тетрамер, известный как протофиламент. Восемь тетрамеров объединяются в скрученный, похожий на верёвку филамент. Филаменты могут собираться и разбираться динамическим образом, то есть длина филамента зависит от относительных скоростей его сборки и разборки[7].
Хромосомы
В ядре находится большая часть генетического материала клетки, представленного линейными молекулами ДНК, которые организованы в структуры, известные как хромосомы. Суммарная длина молекул ДНК клетки человека составляет около 2 м. В течение интерфазы клеточного цикла данные молекулы в комплексе с белками формируют так называемый ядерный хроматин, а при клеточном делении хромосомы конденсируются и предстают в виде отдельных микроскопически различимых образований. Небольшое количество внеядерного клеточного генетического материала располагается в митохондриях и, в случае растительной клетки, в хлоропластах[19].
Известно два вида хроматина. В эухроматине ДНК наименее плотно организована; он содержит гены, которые транскрибируются наиболее часто[19]. Другой вид хроматина, гетерохроматин, более компактен и содержит ДНК, транскрибируемую редко или никогда. Гетерохроматин подразделяется на факультативный, который формируется в части клеток в процессе развития, и конститутивный, присутствующий во всех клетках на всех стадиях развития и находящийся в основном в теломерных и околоцентромерных участках хромосом[20]. В течение интерфазы хроматин каждой хромосомы занимает свою область ядра — хромосомную территорию, то есть, хроматин разных хромосом не перемешивается[21][22]. Активные гены, которые, как правило, располагаются в эухроматине, обычно располагаются на границе хромосомной территории[23].
Ядерные тельца
В ядре клеток млекопитающих содержится ряд дискретных субкомпартментов[24], которые называются ядерными тельцами. Они осуществляют компартментализацию ядра, создавая внутри него отдельные пространства, которые обладают определёнными свойствами. Многие ядерные тельца осуществляют специфические функции — например, синтез и процессинг пре-рибосомных РНК в ядрышке, накопление и сборку компонентов сплайсосом в спеклах (см. ниже) или накопление молекул РНК в параспеклах. Механизмы, которые обеспечивают выполнение ядрышковыми тельцами этих функций, очень разнообразны. В некоторых случаях ядерное тельце может служить местом протекания определённых процессов, например, транскрипции. В других случаях ядерные тельца, по-видимому, опосредованно регулируют локальные концентрации своих компонентов в нуклеоплазме. Подобно цитоплазматическим органеллам, ядерные тельца содержат специфический набор белков, которые определяют их структуру на молекулярном уровне. Однако, в отличие от органелл цитоплазмы, ядерные тельца не окружены липидными мембранами, и их структурная целостность целиком обеспечивается белок-белковыми и РНК-белковыми взаимодействиями. Ниже в таблице перечислены основные характеристики ядерных телец[25].
| Ядерное тельце | Функции | Характерные компоненты | Типичный размер (в мкм) | Количество на ядро |
|---|---|---|---|---|
| Ядрышко | Биогенез рибосом | Машинерия РНК-полимеразы I, факторы процессинга рРНК и сборки рибосомных субъединиц | 3—8 | 1—4 |
| Спеклы | Накопление и сборка факторов сплайсинга | Факторы сплайсинга пре-мРНК | 2—3 | 20—50 |
| Стрессовые ядерные тельца | Регуляция транскрипции и сплайсинга в условиях стресса | HSF1, HAP | 1—2 | 3—6 |
| Тельце гистоновых локусов | Процессинг пре-мРНК гистонов | NPAT, FLASH, U7 мяРНП | 0,2—1,2 | 2—4 |
| Тельце Кахаля | Биогенез, созревание и кругооборот малых РНК | Коилин, SMN | 0,2—1,5 | 1—10 |
| PML-тельце | Регуляция стабильности генома, репарация ДНК, контроль транскрипции, защита от вирусов | PML | 0,1—1 | 10—30 |
| Параспеклы | Регуляция мРНК, редактирование РНК | Некодирующие РНК NEAT1/MENε/β, белки PSP1, p54nrb/NONO | 0,2—1 | 2—20 |
| Околоядрышковый компартмент | Посттранскрипционная регуляция набора РНК, синтезированных РНК-полимеразой III | PTB | 0,2—1 | 1—2 |
Ядрышко
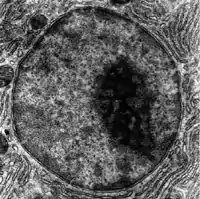
Ядрышко — это отдельная плотная структура в ядре. Она не окружена мембраной и формируется в области расположения рДНК — тандемных повторов генов рибосомной РНК (рРНК), называемых ядрышковыми организаторами. Главная функция ядрышка — синтез рРНК и образование рибосом. Структурная целостность ядрышка зависит от его активности, и инактивация генов рРНК приводит к смешению ядрышковых структур[26].
На первой стадии образования рибосом фермент РНК-полимераза I транскрибирует рДНК и образует пре-рРНК, которая далее разрезается на 5,8S, 18S и 28S рРНК[27]. Транскрипция и посттранскрипционный процессинг рРНК происходят в ядрышке при участии малых ядрышковых РНК (snoРНК), некоторые из которых происходят из сплайсированных интронов мРНК генов, кодирующих белки, связанные с работой рибосом. Собранные рибосомные субъединицы — это самые крупные структуры, проходящие через ядерные поры[6].
При рассматривании под электронным микроскопом в ядрышке можно выделить три компонента: фибриллярные центры (ФЦ), окружающий их плотный фибриллярный компонент (ПФК) и гранулярный компонент (ГК), который, в свою очередь, окружает ПФК. Транскрипция рРНК происходит в ФЦ и на границе ФЦ и ПФК, поэтому при активации образования рибосом ФЦ становятся хорошо различимы. Разрезание и модификации рРНК происходят в ПФК, а последующие этапы образования рибосомных субъединиц, включающие загрузку рибосомных белков, происходят в ГК[27].
Тельце Кахаля
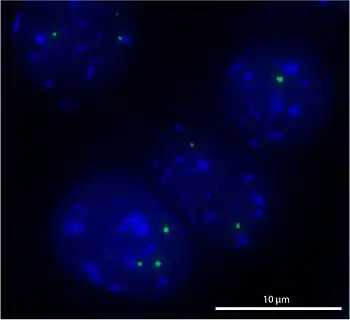
Тельце Кахаля (ТК) — ядерное тельце, имеющееся у всех эукариот. Оно идентифицируется по наличию сигнатурного белка коилина и специфических РНК (scaРНК). В ТК также содержится белок SMN (англ. survival of motor neurons). В ТК наблюдается высокая концентрация сплайсирующих малых ядерных рибонуклеопротеинов (мяРНП) и других факторов процессинга РНК, поэтому считается, что ТК служат местами сборки и/или посттранскрипционной модификации факторов сплайсинга. ТК присутствует в ядре во время интерфазы, но исчезает в митозе. В биогенезе ТК прослеживаются свойства самоорганизующейся структуры[28].
Когда внутриклеточная локализация SMN впервые изучалась методом иммунофлуоресценции, то белок обнаруживался во всей цитоплазме, а также в ядрышковом тельце, сходном по размеру с ТК и часто расположенном рядом с ТК. По этой причине данное тельце было названо «близнецом ТК» (англ. gemini of CB) или просто gem. Однако оказалось, что линия клеток HeLa, в которой было открыто новое тельце, была необычной: в других линиях клеток человека, а также у плодовой мушки Drosophila melanogaster SMN колокализовался с коилином в ТК. Поэтому в общем случае SMN можно рассматривать как важный компонент ТК, а не как маркер отдельного ядерного тельца[29].
Тельце гистоновых локусов
Тельце гистоновых локусов (англ. histone locus body, HLB) содержит факторы, необходимые для процессинга пре-мРНК гистонов. Как и следует из названия, тельца гистоновых локусов ассоциированы с генами, кодирующими гистоны; поэтому предполагается, что в тельцах гистоновых локусов концентрируются факторы сплайсинга. Тельце гистоновых локусов присутствует в клетке во время интерфазы и исчезает с наступлением митоза. Тельце гистоновых локусов нередко рассматривается вместе с тельцем Кахаля по нескольким причинам. Во-первых, в некоторых тельцах гистоновых локусов содержится маркер телец Кахаля — коилин. Во-вторых, эти тельца нередко физически находятся рядом, поэтому между ними наблюдается некоторое взаимодействие. Наконец, очень крупные тельца Кахаля ооцитов земноводных обладают свойствами обоих телец[28].
PML-тельца
Тельца промиелоцитной лейкемии (англ. Promyelocytic leukaemia bodies), или PML-тельца — сферические тельца, разбросанные по всей нуклеоплазме и достигающие около 0,1—1,0 мкм в диаметре. Они известны также под такими названиями, как ядерный домен 10 (англ. nuclear domain 10 (ND10)), тельца Кремера (англ. Kremer bodies) и онкогенные домены PML (англ. PML oncogenic domains). Тельца PML названы по одному из своих ключевых компонентов — белку промиелоцитной лейкемии (PML). Они часто наблюдаются ассоциированными с тельцами Кахаля и тельцами деления (англ. cleavage body)[30]. PML-тельца принадлежат ядерному матриксу и могут быть задействованы в таких процессах, как репликация ДНК, транскрипция и эпигенетический сайленсинг генов[31]. Ключевым фактором организации этих телец выступает белок PML, который привлекает другие белки; последние, по современным представлениям, объединены лишь тем, что они SUMOилированы. Мыши, у которых ген PML делетирован, лишены PML-телец, однако развиваются и живут нормально, поэтому PML-тельца не выполняют незаменимых биологических функций[31].
Спекл
Спеклы (англ. speckle) — это ядерные тельца, которые содержат факторы сплайсинга пре-мРНК и располагаются в интерхроматиновых участках нуклеоплазмы клеток млекопитающих. При флуоресцентной микроскопии спеклы выглядят как пятнистые тельца неправильной формы, различных размеров, а при электронной микроскопии они выглядят как кластеры интерхроматиновых гранул. Спеклы — динамические структуры, и содержащиеся в них белки и РНК могут перемещаться между спеклами и другими ядерными тельцами, включая участки активной транскрипции. На основании исследований состава, структуры и поведения спеклов была создана модель, объясняющая функциональную компартментализацию ядра и организацию машинерии экспрессии генов[32], сплайсирующих малые ядерные рибонуклеопротеины[33][34] и другие белки, необходимые для сплайсинга пре-мРНК[32]. Из-за изменяющихся потребностей клетки состав и расположение спеклов изменяется согласно транскрипции мРНК и посредством регуляции фосфорилирования специфических белков[35]. Сплайсирующие спеклы также известны как ядерные спеклы, компартменты сплайсирующих факторов, кластеры интерхроматиновых гранул и B-снурпосомы (англ. B snurposomes)[36]. B-снурпосомы найдены в ядрах ооцитов земноводных и зародышах плодовой мушки Drosophila melanogaster[37]. На электронных микрофотографиях B-снурпосомы предстают прикреплёнными к тельцам Кахаля или отдельно от них. Кластеры интерхроматиновых гранул служат местами скопления факторов сплайсинга[38].
Параспеклы
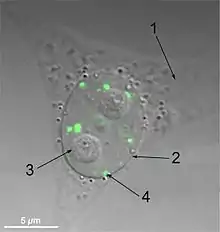
Параспеклы — это ядерные тельца неправильной формы, располагающиеся в интерхроматиновом пространстве ядра[39]. Впервые они были описаны у клеток HeLa, у которых имеется 10—30 параспеклов на ядро, но сейчас параспеклы обнаружены во всех первичных клетках человека, в клетках трансформированных линий и на срезах тканей[40]. Своё название они получили из-за своего расположения в ядре — вблизи спеклов[39].
Параспеклы — динамические структуры, которые изменяются в ответ на изменения в метаболической активности клетки. Они зависят от транскрипции[39], и в отсутствие транскрипции, проводимой РНК-полимеразой II, параспеклы исчезают, а все входящие в их состав белки (PSP1, p54nrb, PSP2, CFI(m)68 и PSF) формируют серповидный околоядрышковый кэп. Этот феномен наблюдается в ходе клеточного цикла: параспеклы присутствуют в интерфазе и всех фазах митоза, за исключением телофазы. В ходе телофазы формируются дочерние ядра, и РНК-полимераза II ничего не транскрибирует, поэтому белки параспеклов и формируют околоядрышковый кэп[40]. Параспеклы участвуют в регуляции экспрессии генов, накапливая те РНК, где есть двухцепочечные участки, которые подвергаются редактированию, а именно превращению аденозина в инозин. Благодаря этому механизму параспеклы задействованы в контроле экспрессии генов при дифференцировке, вирусной инфекции и стрессе[41].
Околоядрышковый компартмент
Околоядрышковый компартмент (ОК) — ядерное тельце неправильной формы, которое характеризуется тем, что располагается на периферии ядрышка. Несмотря на физическую связь, эти два компартмента структурно различны. Обычно ОК обнаруживают в клетках злокачественных опухолей[42]. ОК — динамическая структура, и содержит очень много РНК-связывающих белков и РНК-полимеразу III. Структурная стабильность ОК обеспечивается транскрипцией, осуществляемой РНК-полимеразой III, и наличием ключевых белков. Поскольку присутствие ОК обычно связано со злокачественностью и со способностью к метастазированию, их рассматривают как потенциальные маркеры рака и других злокачественных опухолей. Показана ассоциация ОК со специфическими локусами ДНК[43].
Стрессовые ядерные тельца
Стрессовые ядерные тельца формируются в ядре при тепловом шоке. Они образуются при непосредственном взаимодействии транскрипционного фактора теплового шока 1 (HSF1) и перицентрических тандемных повторов в последовательности сателлита III, что соответствует сайтам активной транскрипции некодирующих транскриптов сателлита III. Распространено мнение, что такие тельца соответствуют очень плотно упакованным формам рибонуклеопротеиновых комплексов. Считается, что в клетках, подвергающихся стрессу, они участвуют в быстрых, временных и глобальных изменениях в экспрессии генов посредством различных механизмов — например, ремоделирования хроматина и захватывания факторов транскрипции и сплайсинга. В клетках, находящихся в нормальных (не стрессовых) условиях, стрессовые ядерные тельца обнаруживаются редко, однако их количество резко увеличивается под действием теплового шока. Стрессовые ядерные тельца найдены только в клетках человека и других приматов[44].
Ядерные тельца-сироты
Ядерные тельца-сироты (англ. orphan nuclear bodies) — нехроматиновые ядерные компартменты, которые исследованы гораздо хуже, чем другие хорошо охарактеризованные структуры ядра. Некоторые из них выступают как места, в которых белки модифицируются белками SUMO и/или происходит протеасомная деградация белков, помеченных убиквитином[45]. Ниже в таблице приведены характеристики известных ядерных телец-сирот[46].
| Ядерное тельце | Описание | Типичный размер (в мкм) | Количество на ядро |
|---|---|---|---|
| Кластосома | Концентрирует протеасомные комплексы 20S и 19S и белки, связанные с убиквитином. Обнаруживается, главным образом, тогда, когда стимулируется активность протеасом, и разбирается при ингибировании активности протеасом. | 0,2—1,2 | 0—3 |
| Тельце деления (англ. cleavage body) | Обогащено факторами деления CstF и CPSF, а также белком DDX1, содержащим DEAD-бокс. Обнаруживается в основном в S-фазе, ингибирование транскрипции на него не влияет. | 0,2—1,0 | 1—4 |
| Домен OPT | Обогащён факторами транскрипции Oct1 и PTF. Частично колокализуется с сайтами транскрипции. Обнаруживается в основном в поздней G1-фазе, разбирается при ингибировании транскрипции. | 1,0—1,5 | 1—3 |
| Тельце Polycomb | Обнаруживается в клетках человека и дрозофилы, обогащено белком PcG. У человека накапливает белки RING1, BMI1, HPC, может быть связано с околоцентромерным гетерохроматином. | 0,3—1,0 | 12—16 |
| Тельце Sam68 | Накапливает белок Sam68 и схожие с ним белки SLM-1 и SLM-2. Разбирается при ингибировании транскрипции. Вероятно, обогащено РНК. | 0,6—1,0 | 2—5 |
| Тельце SUMO | Обогащено белками SUMO и SUMO-конъюгирующим ферментом Ubc9. Концентрирует транскрипционные факторы pCREB, CBP, c-Jun. | 1—3 | 1—3 |
Функции
Ядерная оболочка защищает ДНК клетки и участвует в гораздо более сложной регуляции экспрессии генов по сравнению с прокариотической клеткой. У прокариот транскрипция и трансляция являются сопряжёнными процессами и трансляция мРНК в белок начинается ещё до того, как она будет полностью синтезирована. В клетках эукариот цитоплазма, в которой проходит трансляция, и транскрипция, протекающая в ядре, пространственно разобщены, поэтому возникает необходимость в обеспечении транспорта молекул между ядром и цитоплазмой[47].
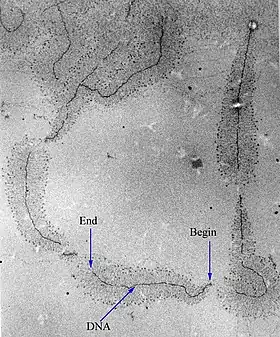
Ядерная оболочка даёт ядру возможность контролировать своё содержимое и отделяет его от остальной цитоплазмы. Это имеет важное значение для регуляции процессов, протекающих по обе стороны ядерной оболочки. Когда цитоплазматический процесс должен быть как-то ограничен, то обычно его ключевой участник переносится в ядро, где он взаимодействует с факторами транскрипции и таким образом запускает подавление образования некоторых ферментов, задействованных в цитоплазматическом процессе. Например, такой регуляторный механизм имеется у гликолиза — процесса, в ходе которого клетка извлекает энергию из молекулы глюкозы. Первую реакцию гликолиза осуществляет фермент гексокиназа, преобразуя молекулу глюкозы в глюкозо-6-фосфат. Когда концентрация фруктозо-6-фосфата (вещества, в ходе гликолиза образующегося из глюкозо-6-фосфата) возрастает, регуляторный белок отправляет гексокиназу в ядро[48], где она формирует транскрипционный репрессирующий комплекс, который подавляет экспрессию генов, кодирующих ферменты гликолиза[49].
Чтобы контролировать, какие именно гены транскрибируются, в клетке транскрипционные факторы не имеют физического доступа к ДНК, пока они не будут активированы в ходе определённого сигнального пути. Это предотвращает даже низкую экспрессию неправильных генов. В частности, в случае контролируемых NF-κB генов, которые принимают участие в воспалительном процессе, транскрипция индуцируется под действием сигнального пути, например, начинающегося со связывания сигнальной молекулы TNF-α со своим рецептором на клеточной мембране и в конце концов приводящего к активации фактора транскрипции NF-κB. Сигнал ядерной локализации, имеющийся у NF-κB, позволяет ему проходить в ядро и из него через ядерные поры; в ядре он стимулирует транскрипцию генов-мишеней[7].
Компартментализация предотвращает транскрипцию клеткой несплайсированной мРНК. Эукариотические мРНК содержат интроны, которые должны быть удалены до того, как начнётся трансляция мРНК. Сплайсинг, то есть удаление интронов, протекает в ядре, что предотвращает доступ к пре-мРНК рибосом, находящихся вне ядра. Если бы ядра не было, то рибосомы начинали бы транслировать незрелые мРНК, что привело бы к образованию неправильных белковых продуктов[50].
Поскольку транскрипция протекает в ядре, ядро содержит множество белков, непосредственно участвующих в транскрипции или регулирующих этот процесс. К этим белкам относятся хеликазы, которые расплетают двойную спираль ДНК, облегчая доступ к ней других белков, РНК-полимеразы, которые синтезируют РНК, топоизомеразы, влияющие на топологию ДНК, а также разнообразные факторы транскрипции[51].
Ядерный транспорт

Выход из ядра и вход в ядро крупных молекул контролируется ядерными порами. Хотя малые молекулы могут проникать в ядро без всякой регуляции, макромолекулы — такие, как белки и РНК — должны связаться с кариоферинами для транспорта в ядро (импортинами) и из ядра (экспортинами). Белки, которые должны быть транспортированы из цитоплазмы в ядро, содержат особую аминокислотную последовательность, известную как сигнал ядерной локализации, с которой связываются импортины. Аналогичным образом белки, которые должны выйти из ядра, содержат сигнал ядерного экспорта, распознаваемый экспортинами. Способность импортинов и экспортинов переносить свой груз регулируется ГТФазами — ферментами, которые гидролизуют ГТФ с высвобождением энергии[13]. Ключевая ГТФаза ядерного транспорта — Ran, которая может связываться с ГТФ или ГДФ, в зависимости от своего местонахождения (в ядре или в цитоплазме). В ядре взаимодействие Ran-ГТФ с импортином вызывает конформационные изменения в последнем, так что он отделяется от переносимого груза. Образованный комплекс Ran-ГТФ и импортина транспортируется в цитоплазму, где белок RanBP отделяет Ran-ГТФ от импортина. Отделение от импортина позволяет белку GAP связаться с Ran-ГТФ и катализировать гидролиз ГТФ до ГДФ. Далее комплекс Ran-GDP распознаётся белком NUTF2, который возвращает его в нуклеоплазму. В ядре белок GEF заменяет ГДФ на ГТФ, образуя Ran-ГТФ и замыкая цикл[52].
Ядерный экспорт осуществляется похожим образом. В ядре экспортин связывается с белком-грузом и Ran-ГТФ и переносится через ядерную пору в цитоплазму, где комплекс диссоциирует. Ran-ГТФ гидролизует ГТФ до ГДФ под действием GAP, и комплекс Ran-ГДФ переносится в ядро, где ГДФ заменяется на ГТФ[13]. Для транспорта через ядерную оболочку зрелых мРНК и тРНК также существуют специальные белки[50][53].
Сборка и разборка
В течение жизни клетки ядро может быть разобрано (при делении клетки или при апоптозе). В ходе этих процессов структурные компоненты ядра — ядерная оболочка и ядерная ламина — разрушаются. В большинстве клеток разборка ядра наблюдается в профазе митоза. Однако разборка ядра не приурочена строго к митозу и происходит не во всех клетках. Некоторые одноклеточные эукариоты (например, дрожжи) подвергаются так называемому закрытому митозу, при котором ядерная оболочка остаётся целой. При закрытом митозе хромосомы перемещаются к разным сторонам ядра, которое потом делится надвое. Клетки высших эукариот, напротив, обычно подвергаются открытому митозу, в ходе которого ядерная оболочка распадается. Хромосомы мигрируют к разным полюсам веретена деления, и вокруг них заново формируются два ядра. Ядерная ламина тоже подвергается разборке из-за фосфорилирования ламинов такими киназами, как циклинзависимая протеинкиназа 1. Сборка ядерной ламины в дочерних ядрах начинается после дефосфорилирования ламинов[54].
Апоптоз — это контролируемый процесс разрушения клеточных компонентов, приводящего к гибели клетки. Перемены, связанные с апоптозом, происходят непосредственно с ядром и его содержимым. К их числу относится конденсация хроматина, а также дезинтеграция ядерной оболочки и ядерной ламины. Разрушение сети ламинов происходит с участием апоптотических протеаз, известных как каспазы, которые разрушают ламины и, таким образом, влияют на структурную целостность ядра. Разрушение ламинов иногда используется в качестве индикатора активности каспаз в исследованиях, посвящённых апоптозу. Клетки, в которых экспрессируются мутантные ламины, устойчивые к действию каспаз, при апоптозе не утрачивают целостность ядра, поэтому ламины играют ключевую роль в начале изменений, которое претерпевает ядро при апоптозе[16]. Кроме того, ингибирование сборки ламинов в сеть запускает апоптоз[55].
Особенности ядер у различных эукариот
Размеры, формы и морфология ядер эукариот изменяются в самых широких пределах. Если у пироплазмид и лейшманий диаметр ядра составляет 1—3 мкм, то у некоторых радиолярий ядра в диаметре достигают 400 мкм и даже 1 мм. Как правило, форма ядра у большинства эукариот близка к сферической, но иногда она способна принимать довольно причудливые очертания (это, в частности, относится к макронуклеусам инфузорий). Хотя у всех эукариот оболочка ядра состоит из двух мембран, число пор в ней у различных видов сильно варьирует, причём иногда к ней (как снаружи, так и изнутри) могут примыкать дополнительные слои; например, у многих свободноживущих амёб к внутренней стороне оболочки прилегает фиброзный слой с ячеистым строением, который значительно превосходит ядерную оболочку по толщине, а у радиолярий с внешней стороны оболочки располагаются дополнительные фибриллярные слои[56].
Значительным своеобразием отличается организация ядра у протистов из типа динофлагеллят (Dinoflagellata). Большинство их представителей имеет ядро, в котором хромосомы конденсированы на протяжении всего клеточного цикла (в том числе и в интерфазе) и практически лишены гистонов. Такой тип ядра получил название динокарион. При этом количество ДНК в динокарионе в десятки и сотни раз превосходит количество ДНК, приходящееся на клетку у представителей других групп эукариот[57]. Впрочем, некоторые динофлагелляты (Noctiluca, Oodinium) имеют обычные эукариотические ядра[58]; у других представителей типа в вегетативных клетках ядра обычные, а динокарион присутствует на других стадиях клеточного цикла (например, в гаметах)[57].
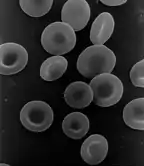
Клетки протистов обладают по крайней мере одним ядром[59]. В то же время в организмах Metazoa встречаются и безъядерные клетки, которые, не имея ядра, утратили способность делиться с образованием двух дочерних клеток. Наиболее известным примером безъядерных клеток являются эритроциты млекопитающих, в которых отсутствуют и другие органеллы — такие, как митохондрии. Эритроциты созревают в костном мозге в процессе эритропоэза, в ходе которого они утрачивают ядра, другие органеллы и рибосомы. Ядро выталкивается из клетки при процессе дифференцировки эритробласта в ретикулоцит, который выступает непосредственным предшественником эритроцита[60]. Под действием некоторых мутагенов в кровь могут выпускаться незрелые эритроциты, содержащие микроядра[61][62].
Большинство протистов имеет только одно ядро; у протистов, для которых характерен сложный жизненный цикл (например, у представителей типа апикомплексы (Apicomplexa) встречаются одноядерные и многоядерные стадии[63].
Многоядерные клетки протистов
В ряде групп протистов клетки имеют несколько ядер на протяжении всей жизни; при этом многоядерные формы протистов способны достигать крупных размеров — порядка нескольких сантиметров в диаметре (в исключительных случаях — до метра и более)[64]. Так, большинство представителей отряда дипломонад и, в частности, лямблии — хорошо известные паразиты кишечника млекопитающих и птиц из рода Giardia — имеют два функционально эквивалентных ядра, которые наследуются независимо в ходе митоза[65][66]. У представителей рода Stephanopogon (тип Percolozoa[67]) клетка содержит от 2 до 16 идентичных ядер. У жгутиконосцев из класса опалины (Opalinea) клетки также содержат несколько одинаковых ядер; их число существенно различается на различных стадиях жизненного цикла опалин. Много ядер у некоторых представителей отряда Oxymonadida, причём количеству ядер соответствует и количество имеющихся в клетке мастигонтных комплексов[68].
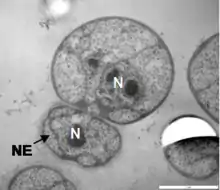
В составе хлоропластов у криптофитовых и хлорарахниофитовых водорослей присутствует нуклеоморф — редуцированное ядро фототрофного эндосимбионта, инкорпорированного предками данных водорослей в ходе вторичного эндосимбиоза (у Cryptophyta происходила инкорпорация красной, а у Chlorarachnea — зелёной водоросли)[69].
У инфузорий и некоторых фораминифер наблюдается феномен ядерного дуализма, при котором в клетке присутствуют ядра двух типов: генеративный микронуклеус и вегетативный макронуклеус. При этом настоящий ядерный дуализм, при котором клетка содержит один или несколько мелких микронуклеусов и один или несколько крупных макронуклеусов, характерен для инфузорий и для определённых стадий (агамонтов) некоторых фораминифер (например, у Rotaliella heterokaryotica)[63]; вообще же клетки или плазмодии фораминифер содержат от одного до нескольких тысяч ядер[70]. В клетках инфузорий может быть как один, так и несколько микронуклеусов; это справедливо и для макронуклеусов. Микронуклеусы диплоидны, и именно в них происходит генетическая рекомбинация. Для макронуклеусов же характерен высокий уровень амплификации генов (так, у Paramecium tetraurelia уровень плоидности макронуклеуса составляет 1000—2000); впрочем, у инфузорий из класса Karyorelictea микро- и макронуклеусы содержат почти одинаковый диплоидный набор ДНК. Макронуклеусы ответственны за клеточный метаболизм и являются местом синтеза РНК. В ходе деления клетки старые макронуклеусы обычно дегенерируют, новые же развиваются путём модификации микронуклеусов[71]. Дифференцировка ядер на генеративные и вегетативные имеет место также у миксоспоридий (Myxosporea) и большинства акантарий (Acantharea); у последних такая дифференцировка происходит перед инцистированием: одно полиплоидное ядро даёт начало сначала вегетативным ядрам, а затем — генеративным, число которых в клетке в результате неоднократных делений достигает сотен[72][73].
Многоядерные клетки высших эукариот
Распространено и наличие двух ядер в клетках мицелия у грибов (особенно у образующих микоризу[74]) и в клетках сближаемых в современных классификациях с грибами микроспоридий. Данное явление известно как дикарион, или диплокарион[75]. Встречающиеся у многих грибов несептированные гифы также, по существу, представляют собой гигантские многоядерные клетки[76].
У семенных растений тоже возможно появление многоядерных клеток. Например, многоядерную стадию развития проходят клетки эндосперма покрытосеменных (после двойного оплодотворения) и женского гаметофита голосеменных (после мейоза). В ряде случаев появление тканей с многоядерными клетками оказывается следствием механического или биохимического воздействия на организм растения-хозяина, оказанного паразитирующими на нём насекомыми[77]. У многих покрытосеменных многоядерными являются клетки тапетума — слоя в пыльнике, ответственного за снабжение пыльцевых зёрен питательными веществами[78].
У человека и других позвоночных клетки скелетной мускулатуры (миоциты) сливаются с образованием многоядерного синцития. В нём ядра оттеснены к периферии, что даёт возможность занять внутреннее пространство сократимыми миофибриллами[6]. Многоядерными также являются остеокласты — клетки костной ткани позвоночных, ответственные за её резорбцию; в норме у млекопитающих они содержат от 2 до 30 ядер (в среднем — от 3 до 10), а при некоторых болезнях, которым сопутствует увеличение костной резорбции (при синдроме Педжета — Шрёттера, ревматоидном артрите и др.), остеокласты увеличиваются в размерах и число ядер в них возрастает (при синдроме Педжета — Шрёттера они могут содержать до 100 ядер)[79]. Многоядерные клетки у человека и животных могут образовываться и при других патологических процессах. Так, слияние макрофага и моноцита с образованием гигантских многоядерных клеток происходит при воспалении[80], а также может говорить об образовании опухоли[81].
Происхождение ядра
Клеточное ядро является важнейшей чертой эукариотических организмов, отличающей их от бактерий и архей. Несмотря на значительный прогресс в цитологии и молекулярной биологии, происхождение ядра не выяснено и является предметом научных споров. Выдвинуто 4 основных гипотезы происхождения клеточного ядра, но ни одна из них не получила широкой поддержки[82].
Гипотеза, известная как синтропная модель, предполагает, что ядро возникло в результате симбиотических взаимоотношений между археей и бактерией (ни археи, ни бактерии не имеют оформленных клеточных ядер). По этой гипотезе, симбиоз возник, когда древняя архея (сходная с современными метаногенными археями), проникла в бактерию (сходную с современными миксобактериями). Впоследствии архея редуцировалась до клеточного ядра современных эукариот. Эта гипотеза аналогична практически доказанным теориям происхождения митохондрий и хлоропластов, которые возникли в результате эндосимбиоза прото-эукариот и аэробных бактерий[83]. Как свидетельство в пользу данной гипотезы рассматривается наличие у эукариот и архей одинаковых генов (в частности, генов гистонов). Кроме того, миксобактерии быстро передвигаются, могут образовывать многоклеточные структуры и имеют киназы и G-белки, близкие к эукариотическим[84].
Согласно второй гипотезе, прото-эукариотическая клетка эволюционировала из бактерии без стадии эндосимбиоза. Доказательством модели является существование современных бактерий группы Planctomycetes, которые имеют ядерные структуры с примитивными порами и другие клеточные компартменты, ограниченные мембранами (ничего похожего у других прокариот не обнаружено)[85].
Согласно гипотезе вирусного эукариогенеза, окружённое мембраной ядро, как и другие эукариотические элементы, возникли вследствие инфекции прокариотической клетки вирусом. Это предположение основывается на наличии общих черт у эукариот и некоторых вирусов, а именно генома из линейных цепей ДНК, кэпирования мРНК и тесного связывания генома с белками (гистоны эукариот принимаются аналогами вирусных ДНК-связывающих белков). По одной версии, ядро возникло при фагоцитировании (поглощении) клеткой большого ДНК-содержащего вируса[86]. По другой версии, эукариоты произошли от древних архей, инфицированных поксвирусами. Эта гипотеза основана на сходстве ДНК-полимеразы современных поксвирусов и эукариот[87][88]. Также предполагается, что нерешённый вопрос о происхождении пола и полового размножения может быть связан с вирусным эукариогенезом[89].
Четвёртая, самая новая гипотеза, названная экзомембранной гипотезой, утверждает, что ядро произошло от одиночной клетки, которая в процессе эволюции выработала вторую внешнюю клеточную мембрану; первичная клеточная мембрана после этого превратилась в ядерную мембрану, и в ней образовалась сложная система поровых структур (ядерных пор) для транспорта клеточных компонентов, синтезированных внутри ядра[90].
Клиническое значение
Мутации, затрагивающие белки различных компонентов ядра, нередко приводят к заболеваниям. Так, мутации, которые затрагивают ламины, приводящие к нарушениям в сборке филаментов ядерной ламины, лежат в основе группы редких наследственных заболеваний, известных как ламинопатии. Наиболее изучена группа ламинопатий, выступающих под общим названием прогерия. У больных прогерией наблюдается преждевременное старение, однако биохимические основы такого фенотипа неясны[92].
Наличие в крови антител к некоторым белкам хроматина, например, нуклеосомным комплексам, обусловливает аутоиммунные заболевания — такие, как системная красная волчанка[93]. Данные антитела известны под названием антиядерных антител, и их наличие также может быть связано с рассеянным склерозом как частью общего расстройства иммунной системы. Как и в случае прогерии, биохимическая подоплёка таких симптомов неясна[94].
Мутации в белках ядрышка часто приводят к различным раковым заболеваниям[95]. Если в ядрышке проявляются дефекты образования рибосом, то наблюдаются заболевания, известные как рибосомопатии[96]. Нарушения в других ядерных тельцах тоже могут приводить к болезням. Так, присутствие в ядре маленьких палочек часто выявляется в случаях немалиновой миопатии. Это заболевание обусловлено мутациями в гене актина, и сами палочки состоят из мутантного актина и других белков цитоскелета[97].
В норме ядерная оболочка служит барьером, который препятствует проникновению в ядро различных вирусов. Некоторым вирусам для репликации и/или сборки необходимы белки, находящиеся внутри ядра. Сборка и репликация ДНК-содержащих вирусов (это, например, герпесвирусы) происходит внутри ядра, и вирионы покидают его, отпочковываясь от внутренней ядерной мембраны. Этот процесс сопровождается разборкой ядерной ламины с обращённой к ядру стороны внутренней ядерной мембраны[16].
Примечания
- Кассимерис, Лингаппа, Плоппер, 2016, с. 406.
- Leeuwenhoek, A. van. . Opera Omnia, seu Arcana Naturae ope exactissimorum Microscopiorum detecta, experimentis variis comprobata, Epistolis ad varios illustres viros. J. Arnold et Delphis, A. Beman, Lugdinum Batavorum 1719—1730. Cited after: Dieter Gerlach, Geschichte der Mikroskopie. — Frankfurt am Main: Verlag Harri Deutsch, 2009. — ISBN 978-3-8171-1781-9.
- Harris H. . The Birth of the Cell. — New Haven: Yale University Press, 1999. — xii + 212 p. — ISBN 0-300-07384-4.
- Brown, Robert. On the Organs and Mode of Fecundation of Orchidex and Asclepiadea // Miscellaneous Botanical Works, I. — 1866. — P. 511—514.
- Cremer, Thomas. . Von der Zellenlehre zur Chromosomentheorie. — Berlin e. a.: Springer Verlag, 1985. — 384 S. — (Veröffentlichungen aus der Forschungsstelle für Theoretische Pathologie der Heidelberger Akademie der Wissenschaften). — ISBN 3-540-13987-7.
- Lodish H., Berk A., Matsudaira P., Kaiser C. A., Krieger M., Scott M. P., Zipursky S. L., Darnell J. . Molecular Cell Biology. 5th edition. — N. Y.: W. H. Freeman, 2004. — ISBN 0-7167-2672-6.
- Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter. . Molecular Biology of the Cell. 4th edition. — Garland Science, 2002. — Chapter 4, p. 191–234.
- Clegg J. S. Properties and Metabolism of the Aqueous Cytoplasm and its Boundaries // The American Journal of Physiology. — 1984. — Vol. 246, no. 2 (Pt. 2). — P. 133—151. — PMID 6364846.
- Paine P. L., Moore L. C., Horowitz S. B. Nuclear Envelope Permeability // Nature. — 1975. — Vol. 254, no. 5496. — P. 109—114. — doi:10.1038/254109a0. — PMID 1117994.
- Кассимерис, Лингаппа, Плоппер, 2016, с. 418.
- Rhoades R., Pflanzer R. G. . Human Physiology. 3rd edition. — Fort Worth: Saunders College Publishing, 1996. — xxx + 978 p. — ISBN 0-030-05159-2.
- Shulga N., Mosammaparast N., Wozniak R., Goldfarb D. S. Yeast Nucleoporins Involved in Passive Nuclear Envelope Permeability // The Journal of Cell Biology. — 2000. — Vol. 149, no. 5. — P. 1027—1038. — PMID 10831607.
- Pemberton L. F., Paschal B. M. Mechanisms of Receptor-Mediated Nuclear Import and Nuclear Export // Traffic (Copenhagen, Denmark). — 2005. — Vol. 6, no. 3. — P. 187—198. — doi:10.1111/j.1600-0854.2005.00270.x. — PMID 15702987.
- Stuurman N., Heins S., Aebi U. Nuclear Lamins: their Structure, Assembly, and Interactions // Journal of Structural Biology. — 1998. — Vol. 122, no. 1-2. — P. 42—66. — doi:10.1006/jsbi.1998.3987. — PMID 9724605.
- Goldman A. E., Moir R. D., Montag-Lowy M., Stewart M., Goldman R. D. Pathway of Incorporation of Microinjected Lamin A into the Nuclear Envelope // The Journal of Cell Biology. — 1992. — Vol. 119, no. 4. — P. 725—735. — PMID 1429833.
- Goldman R. D., Gruenbaum Y., Moir R. D., Shumaker D. K., Spann T. P. Nuclear Lamins: Building Blocks of Nuclear Architecture // Genes & Development. — 2002. — Vol. 16, no. 5. — P. 533—547. — doi:10.1101/gad.960502. — PMID 11877373.
- Moir R. D., Yoon M., Khuon S., Goldman R. D. Nuclear Lamins A and B1: Different Pathways of Assembly during Nuclear Envelope Formation in Living Cells // The Journal of Cell Biology. — 2000. — Vol. 151, no. 6. — P. 1155—1168. — PMID 11121432.
- Spann T. P., Goldman A. E., Wang Chen, Huang Sui, Goldman R. D. Alteration of Nuclear Lamin Organization Inhibits RNA Polymerase II-Dependent Transcription // The Journal of Cell Biology. — 2002. — Vol. 156, no. 4. — P. 603—608. — doi:10.1083/jcb.200112047. — PMID 11854306.
- Ehrenhofer-Murray A. E. Chromatin Dynamics at DNA Replication, Transcription and Repair // European Journal of Biochemistry. — 2004. — Vol. 271, no. 12. — P. 2335—2349. — doi:10.1111/j.1432-1033.2004.04162.x. — PMID 15182349.
- Grigoryev S. A., Bulynko Y. A., Popova E. Y. The End Adjusts the Means: Heterochromatin Remodelling during Terminal Cell Differentiation // Chromosome Research. — 2006. — Vol. 14, no. 1. — P. 53—69. — doi:10.1007/s10577-005-1021-6. — PMID 16506096.
- Schardin M., Cremer T., Hager H. D., Lang M. Specific Staining of Human Chromosomes in Chinese hamster x man Hybrid Cell Lines Demonstrates Interphase Chromosome Territories // Human Genetics. — 1985. — Vol. 71, no. 4. — P. 281—287. — PMID 2416668.
- Lamond A. I., Earnshaw W. C. Structure and Function in the Nucleus // Science. — 1998. — Vol. 280, no. 5363. — P. 547—553. — PMID 9554838.
- Kurz A., Lampel S., Nickolenko J. E., Bradl J., Benner A., Zirbel R. M., Cremer T., Lichter P. Active and Inactive Genes Localize Preferentially in the Periphery of Chromosome Territories // The Journal of Cell Biology. — 1996. — Vol. 135, no. 5. — P. 1195—1205. — PMID 8947544.
- Кассимерис, Лингаппа, Плоппер, 2016, с. 410.
- The Nucleus, 2011, p. 311, 313.
- Hernandez-Verdun D. Nucleolus: from Structure to Dynamics // Histochemistry and Cell Biology. — 2006. — Vol. 125, no. 1-2. — P. 127—137. — doi:10.1007/s00418-005-0046-4. — PMID 16328431.
- Lamond A. I., Sleeman J. E. Nuclear Substructure and Dynamics // Current Biology. — 2003. — Vol. 13, no. 21. — P. 825—828. — PMID 14588256.
- The Nucleus, 2011, p. 235.
- The Nucleus, 2011, p. 239.
- Dundr M., Misteli T. Functional Architecture in the Cell Nucleus // The Biochemical Journal. — 2001. — Vol. 356, Pt. 2. — P. 297—310. — PMID 11368755.
- Lallemand-Breitenbach V., de Thé H. PML Nuclear Bodies // Cold Spring Harbor Perspectives in Biology. — 2010. — Vol. 2, no. 5. — P. a000661. — doi:10.1101/cshperspect.a000661. — PMID 20452955.
- Lamond A. I., Spector D. L. Nuclear Speckles: a Model for Nuclear Organelles // Nature Reviews. Molecular Cell Biology. — 2003. — Vol. 4, no. 8. — P. 605—612. — doi:10.1038/nrm1172. — PMID 12923522.
- Tripathi K., Parnaik V. K. Differential Dynamics of Splicing Factor SC35 During the Cell Cycle // Journal of Biosciences. — 2008. — Vol. 33, no. 3. — P. 345—354. — PMID 19005234.
- Tripathi K., Parnaik V. K. Differential Dynamics of Splicing Factor SC35 During the Cell Cycle // Journal of Biosciences. — 2008. — Vol. 33, no. 3. — P. 345—354. — PMID 19005234.
- Handwerger K. E., Gall J. G. Subnuclear Organelles: New Insights into Form and Function // Trends in Cell Biology. — 2006. — Vol. 16, no. 1. — P. 19—26. — doi:10.1016/j.tcb.2005.11.005. — PMID 16325406.
- Cellular component — Nucleus speckle. // UniProt: UniProtKB. Дата обращения: 30 августа 2013.
- Gall J. G., Bellini M., Wu Zheng’an, Murphy C. Assembly of the Nuclear Transcription and Processing Machinery: Cajal Bodies (Coiled Bodies) and Transcriptosomes // Molecular Biology of the Cell. — 1999. — Vol. 10, no. 12. — P. 4385—4402. — PMID 10588665.
- Matera A. G., Terns R. M., Terns M. P. Non-coding RNAs: Lessons from the Small Nuclear and Small Nucleolar RNAs // Nature Reviews. Molecular Cell Biology. — 2007. — Vol. 8, no. 3. — P. 209—220. — doi:10.1038/nrm2124. — PMID 17318225.
- Fox A. H., Lam Yun Wah, Leung A. K. L., Lyon C. E., Andersen J., Mann M., Lamond A. I. Paraspeckles: a Novel Nuclear Domain // Current Biology. — 2002. — Vol. 12, no. 1. — P. 13—25. — PMID 11790299.
- Fox A. H., Bond C. S., Lamond A. I. P54nrb Forms a Heterodimer with PSP1 That Localizes to Paraspeckles in an RNA-dependent Manner // Molecular Biology of the Cell. — 2005. — Vol. 16, no. 11. — P. 5304—5315. — doi:10.1091/mbc.E05-06-0587. — PMID 16148043.
- The Nucleus, 2011, p. 274.
- Pollock C., Huang Sui. The Perinucleolar Compartment // Journal of Cellular Biochemistry. — 2009. — Vol. 107, no. 2. — P. 189—193. — doi:10.1002/jcb.22107. — PMID 19288520.
- The Nucleus, 2011, p. 264.
- The Nucleus, 2011, p. 288.
- The Nucleus, 2011, p. 300.
- The Nucleus, 2011, p. 301.
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М.: Лаборатория знаний, 2016. — С. 407. — 1056 с. — ISBN 978-5-906828-23-1.
- Lehninger A. L., Nelson D. L., Cox M. M. . Lehninger Principles of Biochemistry. 3rd edition. — New York: Worth Publishers, 2000. — xxix + 1152 p.
- Moreno F., Ahuatzi D., Riera A., Palomino C. A., Herrero P. Glucose Sensing through the Hxk2-dependent Signalling Pathway // Biochemical Society Transactions. — 2005. — Vol. 33, Pt. 1. — P. 265—268. — doi:10.1042/BST0330265. — PMID 15667322.
- Görlich D., Kutay U. Transport Between the Cell Nucleus and the Cytoplasm // Annual Review of Cell and Developmental Biology. — 1999. — Vol. 15. — P. 607—660. — doi:10.1146/annurev.cellbio.15.1.607. — PMID 10611974.
- Nicolini C. A. . Genome Structure and Function: From Chromosomes Characterization to Genes Technology. — Springer, 1997. — ISBN 0-7923-4565-7.
- Izaurralde E., Adam S. Transport of Macromolecules Between the Nucleus and the Cytoplasm // RNA (New York, N.Y.). — 1998. — Vol. 4, no. 4. — P. 351—364. — PMID 9630243.
- Cole C. N., Scarcelli J. J. Transport of Messenger RNA from the Nucleus to the Cytoplasm // Current Opinion in Cell Biology. — 2006. — Vol. 18, no. 3. — P. 299—306. — doi:10.1016/j.ceb.2006.04.006. — PMID 16682182.
- Boulikas T. Phosphorylation of Transcription Factors and Control of The Cell Cycle // Critical Reviews in Eukaryotic Gene Expression. — 1995. — Vol. 5, no. 1. — P. 1—77. — PMID 7549180.
- Steen R. L., Collas P. Mistargeting of B-type Lamins at the End of Mitosis: Implications on Cell Survival and Regulation of Lamins A/C Expression // The Journal of Cell Biology. — 2001. — Vol. 153, no. 3. — P. 621—626. — PMID 11331311.
- Протисты: руководство по зоологии. Ч. 1 / Гл. ред. А. Ф. Алимов. — СПб.: Наука, 2000. — 679 с. — ISBN 5-02-025864-4. — С. 157.
- Белякова Г. А., Дьяков Ю. Т., Тарасов К. Л. . Ботаника: в 4 т. Т. 2. — М.: Издат. центр «Академия», 2006. — 320 с. — ISBN 978-5-7695-2750-1. — С. 145—146.
- Хаусман и др., 2010, с. 121.
- Хаусман и др., 2010, с. 34.
- Skutelsky E., Danon D. Comparative study of nuclear expulsion from the late erythroblast and cytokinesis // Experimental Cell Research. — 1970. — Vol. 60, no. 3. — P. 427—436. — PMID 5422968.
- Torous D. K., Dertinger S. D., Hall N. E., Tometsko C. R. Enumeration of micronucleated reticulocytes in rat peripheral blood: a flow cytometric study // Mutation Research. — 2000. — Vol. 465, no. 1-2. — P. 91—99. — PMID 10708974.
- Hutter K. J., Stöhr M. Rapid detection of mutagen induced micronucleated erythrocytes by flow cytometry // Histochemistry. — 1982. — Vol. 75, no. 3. — P. 353—362. — PMID 7141888.
- Хаусман и др., 2010, с. 336.
- Хаусман и др., 2010, с. 34, 42.
- Adam R. D. The biology of Giardia spp. // Microbiological Reviews. — 1991. — Vol. 55, no. 4. — P. 706—732. — PMID 1779932.
- Poxleitner M. K., Carpenter M. L., Mancuso J. J., Wang C. J., Dawson S. C., Cande W. Z. Evidence for karyogamy and exchange of genetic material in the binucleate intestinal parasite Giardia intestinalis // Science. — 2008. — Vol. 319, no. 5869. — P. 1530—1533. — doi:10.1126/science.1153752. — PMID 18339940.
- Cavalier-Smith T. The excavate protozoan phyla Metamonada Grassé emend. (Anaeromonadea, Parabasalia, Carpediemonas, Eopharyngia) and Loukozoa emend. (Jakobea, Malawimonas): their evolutionary affinities and new higher taxa // International Journal of Systematic and Evolutionary Microbiology. — 2003. — Vol. 53, no. 6. — P. 1741—1758. — doi:10.1099/ijs.0.02548-0. — PMID 14657102.
- Хаусман и др., 2010, с. 70, 91, 97—100.
- Хаусман и др., 2010, с. 95, 181.
- Хаусман и др., 2010, с. 34, 183, 336.
- Хаусман и др., 2010, с. 150—151, 155, 345.
- Zettler L. A., Sogin M. L., Caron D. A. Phylogenetic relationships between the Acantharea and the Polycystinea: a molecular perspective on Haeckel’s Radiolaria // Proc. Nat. Acad. Sci. USA. — 1997. — Vol. 94, no. 21. — P. 11411—11416. — PMID 9326623.
- Карпов С. А. . Строение клетки протистов. — СПб.: ТЕССА, 2001. — 384 с. — ISBN 5-94086-010-9. — С. 257.
- Horton T. R. The number of nuclei in basidiospores of 63 species of ectomycorrhizal Homobasidiomycetes // Mycologia. — 2006. — Vol. 98, no. 2. — P. 233—238. — doi:10.3852/mycologia.98.2.233. — PMID 16894968.
- Хаусман и др., 2010, с. 34, 216.
- Maheshwari R. Nuclear behavior in fungal hyphae // FEMS microbiology letters. — 2005. — Vol. 249, no. 1. — P. 7—14. — doi:10.1016/j.femsle.2005.06.031. — PMID 16002240.
- Aderkas P. von, Rouault G., Wagner R., Chiwocha S., Roques A. Multinucleate storage cells in Douglas-fir (Pseudotsuga menziesii (Mirbel) Franco) and the effect of seed parasitism by the chalcid Megastigmus spermotrophus Wachtl // Heredity. — 2005. — Vol. 94, no. 6. — P. 616—622. — doi:10.1038/sj.hdy.6800670. — PMID 15829985.
- Furness C. A., Rudall P. J. Pollen and anther characters in monocot systematics // Grana. — 2001. — Vol. 40, no. 1-2. — P. 17—25. — ISSN 0017-3134. — doi:10.1080/00173130152591840.
- Rita L. Lees R. L., Heersche J. N. M. Differences in regulation of pHi in large (≥10 nuclei) and small (≤5 nuclei) osteoclasts // American Journal of Physiology — Cell Physiology. — 2000. — Vol. 279, no. 3. — P. C751—C761.
- McInnes A., Rennick D. M. Interleukin 4 induces cultured monocytes/macrophages to form giant multinucleated cells // The Journal of Experimental Medicine. — 1988. — Vol. 167, no. 2. — P. 598—611. — PMID 3258008.
- Goldring S. R., Roelke M. S., Petrison K. K., Bhan A. K. Human giant cell tumors of bone identification and characterization of cell types // The Journal of Clinical Investigation. — 1987. — Vol. 79, no. 2. — P. 483—491. — doi:10.1172/JCI112838. — PMID 3027126.
- Pennisi E. Evolutionary Biology. The Birth of the Nucleus // Science. — 2004. — Vol. 305, no. 5685. — P. 766—768. — doi:10.1126/science.305.5685.766. — PMID 15297641.
- Margulis L. . Symbiosis in Cell Evolution. — San Francisco: W. H. Freeman & Company, 1981. — 419 p. — ISBN 0-7167-1256-3. — P. 206—227.
- López-García P., Moreira D. Selective Forces for the Origin of the Eukaryotic Nucleus // BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology. — 2006. — Vol. 28, no. 5. — P. 525—533. — doi:10.1002/bies.20413. — PMID 16615090.
- Fuerst J. A. Intracellular Compartmentation in Planctomycetes // Annual Review of Microbiology. — 2005. — Vol. 59. — P. 299—328. — doi:10.1146/annurev.micro.59.030804.121258. — PMID 15910279.
- Bell P. J. Viral Eukaryogenesis: Was the Ancestor of the Nucleus a Complex DNA Virus? // Journal of Molecular Evolution. — 2001. — Vol. 53, no. 3. — P. 251—256. — doi:10.1007/s002390010215. — PMID 11523012.
- Takemura M. Poxviruses and the Origin of the Eukaryotic Nucleus // Journal of Molecular Evolution. — 2001. — Vol. 52, no. 5. — P. 419—425. — doi:10.1007/s002390010171. — PMID 11443345.
- Villarreal L. P., DeFilippis V. R. A Hypothesis for DNA Viruses as the Origin of Eukaryotic Replication Proteins // Journal of Virology. — 2000. — Vol. 74, no. 15. — P. 7079—7084. — PMID 10888648.
- Bell P. J. Sex and the Eukaryotic Cell Cycle is Consistent with a Viral Ancestry for the Eukaryotic Nucleus // Journal of Theoretical Biology. — 2006. — Vol. 243, no. 1. — P. 54—63. — doi:10.1016/j.jtbi.2006.05.015. — PMID 16846615.
- de Roos A. D. The Origin of the Eukaryotic Cell Based on Conservation of Existing Interfaces // Artificial Life. — 2006. — Vol. 12, no. 4. — P. 513—523. — doi:10.1162/artl.2006.12.4.513. — PMID 16953783.
- Paradisi M., McClintock D., Boguslavsky R. L., Pedicelli C., Worman H. J., Djabali K. Dermal Fibroblasts in Hutchinson-Gilford Progeria Syndrome with the Lamin A G608G Mutation Have Dysmorphic Nuclei and are Hypersensitive to Heat Stress // BMC Cell Biology. — 2005. — Vol. 6. — P. 27. — doi:10.1186/1471-2121-6-27. — PMID 15982412.
- Mounkes L. C., Stewart C. L. Aging and Nuclear Organization: Lamins and Progeria // Current Opinion in Cell Biology. — 2004. — Vol. 16, no. 3. — P. 322—327. — doi:10.1016/j.ceb.2004.03.009. — PMID 15145358.
- Rothfield N. F., Stollar B. D. The Relation of Immunoglobulin Class, Pattern of Anti-Nuclear Antibody, and Complement-Fixing Antibodies to DNA in Sera from Patients with Systemic Lupus Erythematosus // The Journal of Clinical Investigation. — 1967. — Vol. 46, no. 11. — P. 1785—1794. — doi:10.1172/JCI105669. — PMID 4168731.
- Barned S., Goodman A. D., Mattson D. H. Frequency of Anti-Nuclear Antibodies in Multiple Sclerosis // Neurology. — 1995. — Vol. 45, no. 2. — P. 384—385. — PMID 7854544.
- Proteins of the Nucleolus, 2013, p. 292.
- The Nucleolus, 2011, p. 168.
- Goebel H. H., Warlo I. Nemaline Myopathy with Intranuclear Rods — Intranuclear Rod Myopathy // Neuromuscular Disorders. — 1997. — Vol. 7, no. 1. — P. 13—19. — doi:10.1016/S0960-8966(96)00404-X. — PMID 9132135.
Литература
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М.: Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1.
- Хаусман К., Хюльсман Н., Радек Р. . Протистология / Пер. с англ. С. А. Карпова. Под ред. С. А. Корсуна. — М.: Товарищество научных изданий КМК, 2010. — 495 с. — ISBN 978-5-87317-662-5.
- The Nucleolus / Ed. by Mark O. J. Olson. — N. Y.: Springer Science+Business Media, 2011. — xxvi + 414 p. — (Protein Reviews, vol. 15). — ISBN 978-1-4614-0514-6. — doi:10.1007/978-1-4614-0514-6.
- The Nucleus / Ed. by Tom Misteli, David L. Spector. — N. Y.: Cold Spring Harbor Perpectives in Biology, 2011. — 463 p. — ISBN 978-0-87969-894-2.
- Proteins of the Nucleolus. Regulation, Translocation, & Biomedical Functions / Ed. by Danton H. O’Day, Andrew Catalano. — Dordrecht: Springer Science+Business Media, 2013. — vi + 371 p. — ISBN 978-94-007-5818-6. — doi:10.1007/978-94-007-5818-6.