Рибонуклеиновая кислота
Рибонуклеи́новая кислота́ (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов и играют важную роль в кодировании, прочтении, регуляции и выражении генов.
| Рибонуклеиновая кислота | |
|---|---|
 | |

Так же, как ДНК (дезоксирибонуклеиновая кислота), РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
Клеточные РНК образуются в ходе процесса, называемого транскрипцией, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами — РНК-полимеразами. Затем матричные РНК (мРНК) принимают участие в процессе, называемом трансляцией. Трансляция — это синтез белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.
Для одноцепочечных РНК характерны разнообразные пространственные структуры, в которых часть нуклеотидов одной и той же цепи спарены между собой. Некоторые высокоструктурированные РНК принимают участие в синтезе белка клетки, например, транспортные РНК служат для узнавания кодонов и доставки соответствующих аминокислот к месту синтеза белка, а рибосомные РНК служат структурной и каталитической основой рибосом.
Однако функции РНК в современных клетках не ограничиваются их ролью в трансляции. Так, малые ядерные РНК принимают участие в сплайсинге эукариотических матричных РНК и других процессах.
Помимо того, что молекулы РНК входят в состав некоторых ферментов (например, теломеразы), у отдельных РНК обнаружена собственная ферментативная активность: способность вносить разрывы в другие молекулы РНК или, наоборот, «склеивать» два РНК-фрагмента. Такие РНК называются рибозимами.
Геномы ряда вирусов состоят из РНК, то есть у них она играет роль, которую у высших организмов выполняет ДНК. На основании разнообразия функций РНК в клетке была выдвинута гипотеза, согласно которой РНК — первая молекула, которая была способна к самовоспроизведению в добиологических системах.
История изучения
Нуклеиновые кислоты были открыты в 1868 году швейцарским учёным Иоганном Фридрихом Мишером, который назвал эти вещества «нуклеин», поскольку они были обнаружены в ядре (лат. nucleus)[1]. Позже было обнаружено, что бактериальные клетки, в которых нет ядра, тоже содержат нуклеиновые кислоты. Значение РНК в синтезе белков было предположено в 1939 году в работе Торбьёрна Оскара Касперссона, Жана Браше и Джека Шульца[2]. Джерард Маирбакс выделил первую матричную РНК, кодирующую гемоглобин кролика и показал, что при её введении в ооциты образуется тот же самый белок[3]. В 1956—1957 годах А. Белозёрским, А. Спириным, Э. Волкиным, Л. Астраханом проводились работы по определению состава РНК клеток, которые привели к выводу, что основную массу РНК в клетке составляет рибосомальная РНК[4]. Северо Очоа получил Нобелевскую премию по медицине в 1959 году за открытие механизма синтеза РНК[5].
В 1961 году советские учёные Г. П. Георгиев и В. Л. Мантьева открыли в ядрах клеток животных ядерную РНК, из которой образуется матричная РНК[6]. В октябре 1961 года было зарегистрировано Научное открытие № 145 «Явление синтеза ДРНК (рибонуклеиновой кислоты нового класса) в ядрах клеток высших организмов»[7]. Ими было установлено неизвестное ранее явление образования в ядрах клеток высших организмов рибонуклеиновой кислоты нового класса — ядерной дРНК (РНК с ДНК-подобным нуклеотидным составом), являющейся высокомолекулярным предшественником информационной РНК, которая несет генетическую информацию для синтеза клеточных белков.
Последовательность 77 нуклеотидов одной из тРНК дрожжей S. cerevisiae была определена в 1965 году в лаборатории Роберта Холли, за что в 1968 году он получил Нобелевскую премию по медицине[8]. В 1967 Карл Вёзе предположил, что РНК обладают каталитическими свойствами. Он выдвинул так называемую гипотезу мира РНК, в котором РНК прото-организмов служила и в качестве молекулы хранения информации (сейчас эта роль выполняется в основном ДНК) и молекулы, которая катализировала метаболические реакции (сейчас это делают в основном ферменты)[9]. В 1976 Уолтер Фаэрс и его группа в Гентском Университете в Бельгии определили первую последовательность генома РНК-содержащего вируса, бактериофага MS2[10]. В начале 1990-х было обнаружено, что введение чужеродных генов в геном растений приводит к подавлению выражения аналогичных генов растения[11]. Приблизительно в это же время было показано, что РНК длиной около 22 оснований, которые сейчас называются микроРНК, играют регуляторную роль в онтогенезе нематод C. elegans[12].
Происхождение названия
Основоположник химии сахаров Эмиль Фишер в конце 1880-х вместе со своим молодым коллегой Оскаром Пилоти из арабоновой кислоты получил неизвестную ранее кислоту, изомерную арабоновой. Авторы, придумывая название новому веществу, сначала «изомеризировали» название исходной арабоновой кислоты, переставив в ней буквы. Получилась «раабоновая», но им не понравилось, как это звучит, и они заменили аа на и. Получилась рибоновая кислота, из которой восстановлением была получена рибоза. А она уже дала название таким соединениям, как рибонуклеиновая кислота (РНК) и дезоксирибонуклеиновая кислота (ДНК), рибосома, моносахарид рибулоза, спирт рибит, фермент рибонуклеаза и т. д.[13][страница не указана 1223 дня]
Химический состав и модификации мономеров

Нуклеотиды РНК состоят из сахара — рибозы, к которой в положении 1' присоединено одно из оснований: аденин, гуанин, цитозин или урацил. Фосфатная группа соединяет рибозы в цепочку, образуя связи с 3' атомом углерода одной рибозы и в 5' положении другой. Фосфатные группы при физиологическом рН отрицательно заряжены, поэтому РНК — полианион. РНК транскрибируется как полимер четырёх оснований (аденина (A), гуанина (G), урацила (U) и цитозина (C), но в «зрелой» РНК есть много модифицированных оснований и сахаров[14]. Всего в РНК насчитывается около 100 разных видов модифицированных нуклеотидов, из которых 2'-О-метилрибоза наиболее частая модификация сахара, а псевдоуридин — наиболее часто встречающееся модифицированное основание[15].
У псевдоуридина (Ψ) связь между урацилом и рибозой не C — N, а C — C, этот нуклеотид встречается в разных положениях в молекулах РНК. В частности, псевдоуридин важен для функционирования тРНК[16]. Другое заслуживающее внимания модифицированное основание — гипоксантин, дезаминированный аденин, нуклеозид которого носит название инозина. Инозин играет важную роль в обеспечении вырожденности генетического кода.
Роль многих других модификаций не до конца изучена, но в рибосомальной РНК многие пост-транскрипционные модификации находятся в важных для функционирования рибосомы участках. Например, на одном из рибонуклеотидов, участвующем в образовании пептидной связи[17].
Структура
Азотистые основания в составе РНК могут образовывать водородные связи между цитозином и гуанином, аденином и урацилом, а также между гуанином и урацилом[18]. Однако возможны и другие взаимодействия, например, несколько аденинов могут образовывать петлю, или петля, состоящая из четырёх нуклеотидов, в которой есть пара оснований аденин — гуанин[19].

Важная структурная особенность РНК, отличающая её от ДНК — наличие гидроксильной группы в 2' положении рибозы, которая позволяет молекуле РНК существовать в А, а не В-конформации, наиболее часто наблюдаемой у ДНК[20]. У А-формы глубокая и узкая большая бороздка и неглубокая и широкая малая бороздка[21]. Второе последствие наличия 2' гидроксильной группы состоит в том, что конформационно пластичные, то есть не принимающие участие в образовании двойной спирали, участки молекулы РНК могут химически атаковать другие фосфатные связи и их расщеплять[22].

«Рабочая» форма одноцепочечной молекулы РНК, как и у белков, часто обладает третичной структурой. Третичная структура образуется на основе элементов вторичной структуры, образуемой с помощью водородных связей внутри одной молекулы. Различают несколько типов элементов вторичной структуры — стебель-петли, петли и псевдоузлы[23]. В силу большого числа возможных вариантов спаривания оснований предсказание вторичной структуры РНК — гораздо более сложная задача, чем предсказание вторичной структуры белков, но в настоящее время есть эффективные программы, например, mfold[24].
Примером зависимости функции молекул РНК от их вторичной структуры являются участки внутренней посадки рибосомы (IRES). IRES — структура на 5' конце информационной РНК, которая обеспечивает присоединение рибосомы в обход обычного механизма инициации синтеза белка, требующего наличия особого модифицированного основания (кэпа) на 5' конце и белковых факторов инициации. Первоначально IRES были обнаружены в вирусных РНК, но сейчас накапливается всё больше данных о том, что клеточные мРНК также используют IRES-зависимый механизм инициации в условиях стресса[25].
Многие типы РНК, например, рРНК и мяРНК в клетке функционируют в виде комплексов с белками, которые ассоциируют с молекулами РНК после их синтеза или (у эукариот) экспорта из ядра в цитоплазму. Такие РНК-белковые комплексы называются рибонуклеопротеиновыми комплексами или рибонуклеопротеидами.
Сравнение с ДНК
Между ДНК и РНК есть три основных отличия:
- ДНК содержит сахар дезоксирибозу, РНК — рибозу, у которой есть дополнительная, по сравнению с дезоксирибозой, гидроксильная группа. Эта группа увеличивает вероятность гидролиза молекулы, то есть уменьшает стабильность молекулы РНК.
- Азотистное основание, комплементарное аденину, в РНК не тимин, как в ДНК, а урацил — неметилированная форма тимина.
- ДНК существует в форме двойной спирали, состоящей из двух отдельных молекул. Молекулы РНК, в среднем, гораздо короче и преимущественно одноцепочечные.
Структурный анализ биологически активных молекул РНК, включая тРНК, рРНК, мяРНК и другие молекулы, которые не кодируют белков, показал, что они состоят не из одной длинной спирали, а из многочисленных коротких спиралей, расположенных близко друг к другу и образующих нечто, похожее на третичную структуру белка. В результате этого РНК может катализировать химические реакции, например, пептидил-трансферазный центр рибосомы, участвующий в образовании пептидной связи белков, полностью состоит из РНК[26][27].
Синтез
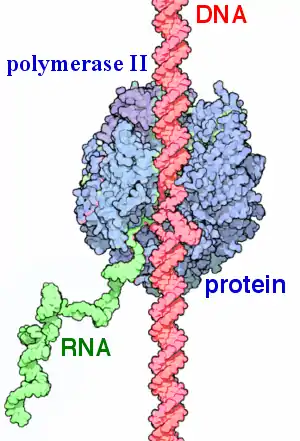
Синтез РНК в живой клетке проводится ферментом — РНК-полимеразой. У эукариот разные типы РНК синтезируются разными, специализированными РНК-полимеразами. В целом матрицей синтеза РНК может выступать как ДНК, так и другая молекула РНК. Например, полиовирусы используют РНК-зависимую РНК-полимеразу для репликации своего генетического материала, состоящего из РНК[28]. Но РНК-зависимый синтез РНК, который раньше считался характерным только для вирусов, происходит и в клеточных организмах, в процессе так называемой РНК-интерференции[29].
Как в случае ДНК-зависимой РНК-полимеразы, так и в случае РНК-зависимой РНК-полимеразы фермент присоединяется к промоторной последовательности. Вторичная структура молекулы матрицы расплетается с помощью хеликазной активности полимеразы, которая при движении субстрата в направлении от 3' к 5' концу молекулы синтезирует РНК в направлении 5' → 3'. Терминатор транскрипции в исходной молекуле определяет окончание синтеза. Многие молекулы РНК синтезируются в качестве молекул-предшественников, которые подвергаются «редактированию» — удалению ненужных частей с помощью РНК-белковых комплексов[30].
Например, у кишечной палочки гены рРНК расположены в составе одного оперона (в rrnB порядок расположения такой: 16S — tRNAGlu 2 — 23S —5S) считываются в виде одной длинной молекулы, которая затем подвергается расщеплению в нескольких участках с образованием сначала пре-рРНК, а затем зрелых молекул рРНК[31]. Процесс изменения нуклеотидной последовательности РНК после синтеза носит название процессинга или редактирования РНК.
После завершения транскрипции РНК часто подвергается модификациям (см. выше), которые зависят от функции, выполняемой данной молекулой. У эукариот процесс «созревания» РНК, то есть её подготовки к синтезу белка, часто включает сплайсинг: удаление некодирующих белок последовательностей (интронов) с помощью рибонуклеопротеида сплайсосомы. Затем к 5' концу молекулы пре-мРНК эукариот добавляется особый модифицированный нуклеотид (кэп), а к 3' концу несколько аденинов, так называемый «полиА-хвост»[30].
Типы РНК


Матричная (информационная) РНК — РНК, которая служит посредником при передаче информации, закодированной в ДНК к рибосомам, молекулярным машинам, синтезирующим белки живого организма. Кодирующая последовательность мРНК определяет последовательность аминокислот полипептидной цепи белка[32]. Однако подавляющее большинство РНК не кодируют белок. Эти некодирующие РНК могут транскрибироваться с отдельных генов (например, рибосомальные РНК) или быть производными интронов[33]. Классические, хорошо изученные типы некодирующих РНК — это транспортные РНК (тРНК) и рРНК, которые участвуют в процессе трансляции[34]. Существуют также классы РНК, ответственные за регуляцию генов, процессинг мРНК и другие роли. Кроме того, есть и молекулы некодирующих РНК, способные катализировать химические реакции, такие, как разрезание и лигирование молекул РНК[35]. По аналогии с белками, способными катализировать химические реакции — энзимами (ферментами), каталитические молекулы РНК называются рибозимами.
Участвующие в трансляции
.png.webp)
Информация о последовательности аминокислот белка содержится в мРНК. Три последовательных нуклеотида (кодон) соответствуют одной аминокислоте. В эукариотических клетках транскрибированный предшественник мРНК или пре-мРНК процессируется с образованием зрелой мРНК. Процессинг включает удаление некодирующих белок последовательностей (интронов). После этого мРНК экспортируется из ядра в цитоплазму, где к ней присоединяются рибосомы, транслирующие мРНК с помощью соединённых с аминокислотами тРНК.
В безъядерных клетках (бактерии и археи) рибосомы могут присоединяться к мРНК сразу после транскрипции участка РНК. И у эукариот, и у прокариот цикл жизни мРНК завершается её контролируемым разрушением ферментами рибонуклеазами[32].
Транспортные (тРНК) — малые, состоящие из приблизительно 80 нуклеотидов, молекулы с консервативной третичной структурой. Они переносят специфические аминокислоты в место синтеза пептидной связи в рибосоме. Каждая тРНК содержит участок для присоединения аминокислоты и антикодон для узнавания и присоединения к кодонам мРНК. Антикодон образует водородные связи с кодоном, что помещает тРНК в положение, способствующее образованию пептидной связи между последней аминокислотой образованного пептида и аминокислотой, присоединённой к тРНК[33].
Рибосомальные РНК (рРНК) — каталитическая составляющая рибосом. Эукариотические рибосомы содержат четыре типа молекул рРНК: 18S, 5.8S, 28S и 5S. Три из четырёх типов рРНК синтезируются в ядрышке. В цитоплазме рибосомальные РНК соединяются с рибосомальными белками и формируют нуклеопротеин, называемый рибосомой[32]. Рибосома присоединяется к мРНК и синтезирует белок. рРНК составляет до 80 % РНК, обнаруживаемой в цитоплазме эукариотической клетки[36].
Необычный тип РНК, который действует в качестве тРНК и мРНК (тмРНК) обнаружен во многих бактериях и пластидах. При остановке рибосомы на дефектных мРНК без стоп-кодонов тмРНК присоединяет небольшой пептид, направляющий белок на деградацию[37].
Участвующие в регуляции генов
В живых клетках обнаружено несколько типов РНК, которые могут уменьшать степень выражения гена при комплементарности мРНК или самому гену. Микро-РНК (21-22 нуклеотида в длину) найдены у эукариот и оказывают воздействие через механизм РНК-интерференции. При этом комплекс микро-РНК и ферментов может приводить к метилированию нуклеотидов в ДНК промотора гена, что служит сигналом для уменьшения активности гена. При использовании другого типа регуляции мРНК, комплементарная микро-РНК, деградируется[38]. Однако есть и миРНК, которые увеличивают, а не уменьшают экспрессию генов[39]. Малые интерферирующие РНК (миРНК, 20-25 нуклеотидов) часто образуются в результате расщепления вирусных РНК, но существуют и эндогенные клеточные миРНК[40]. Малые интерферирующие РНК также действуют через РНК-интерференцию по сходным с микро-РНК механизмам[41]. У животных найдены так называемые РНК, взаимодействующие с Piwi (piРНК, 29-30 нуклеотидов), противодействующие в половых клетках увеличению числа копий транспозонов и играющие роль в образовании гамет[42][43]. Кроме того, piРНК могут эпигенетически наследоваться по материнской линии, передавая потомству своё свойство ингибировать экспрессию транспозонов[44].
Антисмысловые РНК широко распространены у бактерий, многие из них подавляют выражение генов, но некоторые активируют экспрессию[45]. Действуют антисмысловые РНК, присоединяясь к мРНК, что приводит к образованию двуцепочечных молекул РНК, которые деградируются ферментами[46]. У эукариот обнаружены высокомолекулярные, мРНК-подобные молекулы РНК, не кодирующие белков. Эти молекулы также регулируют выражение генов[47]. В качестве примера можно привести Xist, присоединяющуюся и инактивирующую одну из двух X-хромосом у самок млекопитающих[48].
Кроме роли отдельных молекул в регуляции генов, регуляторные элементы могут формироваться в 5' и 3' нетранслируемых участках мРНК. Эти элементы могут действовать самостоятельно, предотвращая инициацию трансляции, либо присоединять белки, например, ферритин или малые молекулы, например, биотин[49].
В процессинге РНК
Многие РНК принимают участие в модификации других РНК. Интроны вырезаются из пре-мРНК сплайсосомами, которые, кроме белков, содержат несколько малых ядерных РНК (мяРНК)[34]. Кроме того, интроны могут катализировать собственное вырезание[50]. Синтезированная в результате транскрипции РНК также может быть химически модифицирована. У эукариот химические модификации нуклеотидов РНК, например, их метилирование, выполняется малыми ядерными РНК (мяРНК, 60-300 нуклеотидов). Этот тип РНК локализуется в ядрышке и тельцах Кахаля[33]. После ассоциации мяРНК с ферментами, мяРНК связываются с РНК-мишенью путём образования пар между основаниями двух молекул, а ферменты модифицируют нуклеотиды РНК-мишени. Рибосомальные и транспортные РНК содержат много подобных модификаций, конкретное положение которых часто сохраняется в процессе эволюции. Также могут быть модифицированы мяРНК и сами мяРНК[51][52]. Гидовые РНК осуществляют процесс редактирования РНК в кинетопласте — особом участке митохондрии протистов-кинетопластид (например, трипаносом).
Геномы, состоящие из РНК
Как и ДНК, РНК может хранить информацию о биологических процессах. РНК может использоваться в качестве генома вирусов и вирусоподобных частиц. РНК-геномы можно разделить на те, которые не имеют промежуточной стадии ДНК и те, которые для размножения копируются в ДНК-копию и обратно в РНК (ретровирусы).
РНК-содержащие вирусы
Многие вирусы, например, вирус гриппа, на всех стадиях содержат геном, состоящий исключительно из РНК. РНК содержится внутри обычно белковой оболочки и реплицируется с помощью закодированных в ней РНК-зависимых РНК-полимераз. Вирусные геномы, состоящие из РНК разделяются на
- содержащие «плюс-цепь РНК», которая используется в качестве и мРНК, и генома;
- «минус-цепь РНК», которая служит только геномом, а в качестве мРНК используется комплементарная ей молекула;
- двухцепочечные вирусы.
Вироиды — другая группа патогенов, содержащих РНК-геном и не содержащих белок. Они реплицируются РНК-полимеразами организма хозяина[53].
Ретровирусы и ретротранспозоны
У других вирусов РНК-геном есть в течение только одной из фаз жизненного цикла. Вирионы так называемых ретровирусов содержат молекулы РНК, которые при попадании в клетки хозяина служат матрицей для синтеза ДНК-копии. В свою очередь, с матрицы ДНК считывается РНК-геном. Кроме вирусов обратную транскрипцию применяют и класс мобильных элементов генома — ретротранспозоны[54].
Двухцепочечная РНК

Двухцепочечная РНК (дцРНК) — это РНК с двумя комплементарными цепями, подобная ДНК, обнаруженной во всех клетках, но с заменой тимина урацилом и добавлением одного атома кислорода. Двухцепочечная РНК образует генетический материал некоторых вирусов (вирусов с двухцепочечной РНК). Двухцепочечная РНК, такая как вирусная РНК или миРНК, может запускать РНК-интерференцию у эукариот, а также интерфероновый ответ у позвоночных[55][56][57][58].
Кольцевая РНК
В конце 1970-х было показано, что существует однониточная ковалентно замкнутая, то есть кольцевая форма РНК, экспрессируемая во всем царстве животных и растений (см. circRNA)[59]. Считается, что Кольцевые РНК возникают в результате реакции «обратного сплайсинга», когда сплайсосома соединяет нижележащий донор с расположенным выше акцепторным сайтом сплайсинга. До сих пор функция circRNAs в значительной степени неизвестна.
Гипотеза РНК-мира
Мир РНК — гипотетический этап эволюционной истории жизни на Земле, в котором самореплицирующиеся молекулы РНК размножались до эволюции ДНК и белков.
Концепция мира РНК была предложена в 1962 году Александром Ричем[60], термин был придуман Вальтером Гилбертом в 1986 году[61]. Кроме мира РНК, были предложены и другие химические пути возникновения жизни[62], и жизнь на основе РНК, возможно, не была первой[61][63]. Тем не менее, найдено достаточно доказательств возможности существования мира РНК, поэтому гипотеза получила широкое признание[60][64][65].
Подобно ДНК, РНК может хранить и реплицировать генетическую информацию, в виде ферментов — рибозимов она может катализировать (начинать или ускорять) химические реакции, которые имеют решающее значение для существования жизни[66]. Один из наиболее важных компонентов клетки, рибосомы, состоят, в основном, из РНК. Рибонуклеотидные фрагменты во многих коферментах, таких как ацетил-КоА, NADH, FADH и F420, уже давно считаются сохранившимися остатками ковалентно связанных коферментов в мире РНК[67].
Если РНК-мир существовал, то вероятно, за ним следовала стадия эволюции рибонуклеопротеинов (мир РНП)[68], которым, в свою очередь, наследовали ДНК и более длинные белки. Причина, по которой ДНК стала преобладающей молекулой хранения генетической информации, может быть связана с тем, что она более стабильна и долговечна, чем РНК[68]. Ферменты-белки, возможно, пришли на смену рибозимам на основе РНК в качестве биокатализаторов, поскольку разнообразие мономеров (аминокислот) делает их более универсальными. Поскольку некоторые кофакторы содержат как нуклеотидные, так и аминокислотные характеристики, может быть, аминокислоты, пептиды и, наконец, белки первоначально были сопутствующими факторами рибозимов[67].
Примечания
- Dahm R. Friedrich Miescher and the discovery of DNA (англ.) // Developmental Biology : journal. — 2005. — Vol. 278, no. 2. — P. 274—288. — PMID 15680349.
- Nierhaus KH, Wilson DN. Protein Synthesis and Ribosome Structure. — Wiley-VCH, 2004. — С. 3. — ISBN 3-527-30638-2.
- Carlier M. L’ADN, cette «simple» molécule. Esprit libre (июнь 2003). Дата обращения: ???. Архивировано 23 августа 2011 года.
- А. С. Спирин. Биоорганическая химия. — М.: Высшая школа, 1986. — С. 10.
- Ochoa S. Enzymatic synthesis of ribonucleic acid. Nobel Lecture (1959). Дата обращения: ???. Архивировано 23 августа 2011 года.
- Георгиев Георгий Павлович — Мегаэнциклопедия Кирилла и Мефодия — статья. Энциклопедия Кирилла и Мефодия. Дата обращения: 8 февраля 2019.
- Научное открытие № 145 Явление синтеза ДРНК (рибонуклеиновой кислоты нового класса) в ядрах клеток высших организмов. ross-nauka.narod.ru. Дата обращения: 8 февраля 2019.
- Holley RW et al. Structure of a ribonucleic acid (англ.) // Science. — 1965. — Vol. 147, no. 1664. — P. 1462—1465. — doi:10.1126/science.147.3664.1462.
- Szathmáry E. The origin of the genetic code: amino acids as cofactors in an RNA world // Trends Genet.. — 1999. — Vol. 15, № 6. — P. 223–9. — doi:10.1016/S0168-9525(99)01730-8.
- Fiers W et al. Complete nucleotide-sequence of bacteriophage MS2-RNA: primary and secondary structure of replicase gene (англ.) // Nature. — 1976. — Vol. 260. — P. 500—507. — PMID 1264203.
- Napoli C, Lemieux C, Jorgensen R. Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans // Plant Cell. — 1990. — Vol. 2, № 4. — P. 279–89. — PMID 12354959.
- Ruvkun G. Glimpses of a tiny RNA world (англ.) // Science. — 2001. — Vol. 294, no. 5543. — P. 797—799. — doi:10.1126/science.1066315.
- Илья Леенсон. Язык химии. Этимология химических названий. — АСТ, 2016. — ISBN 978-5-17-095739-2.
- Jankowski JAZ, Polak J. M. Clinical gene analysis and manipulation: tools, techniques and troubleshooting (англ.). — Cambridge University Press, 1996. — P. 14. — ISBN 0521478960.
- Kiss T. Small nucleolar RNA-guided post-transcriptional modification of cellular RNAs (англ.) // The EMBO Journal : journal. — 2001. — Vol. 20. — P. 3617—3622. — doi:10.1093/emboj/20.14.3617.
- Yu Q., Morrow C. D. Identification of critical elements in the tRNA acceptor stem and TΨC loop necessary for human immunodeficiency virus type 1 infectivity (англ.) // J Virol. : journal. — 2001. — Vol. 75, no. 10. — P. 4902—4906. — doi:10.1128/JVI.75.10.4902-4906.2001.
- King T. H., Liu B., McCully R. R., Fournier M. J. Ribosome structure and activity are altered in cells lacking snoRNPs that form pseudouridines in the peptidyl transferase center (англ.) // Molecular Cell : journal. — 2002. — Vol. 11, no. 2. — P. 425—435. — doi:10.1016/S1097-2765(03)00040-6.
- Barciszewski J., Frederic B., Clark C. RNA biochemistry and biotechnology. — Springer, 1999. — С. 73—87. — ISBN 0792358627.
- Lee J. C., Gutell R. R. Diversity of base-pair conformations and their occurrence in rRNA structure and RNA structural motifs (англ.) // J. Mol. Biol. : journal. — 2004. — Vol. 344, no. 5. — P. 1225—1249. — doi:10.1016/j.jmb.2004.09.072. — PMID 15561141.
- Salazar M., Fedoroff O. Y., Miller J. M., Ribeiro N. S., Reid B. R. The DNA strand in DNAoRNA hybrid duplexes is neither B-form nor A-form in solution (англ.) // Biochemistry : journal. — 1992. — Vol. 1993, no. 32. — P. 4207—4215. — PMID 7682844.
- Hermann T., Patel D. J. RNA bulges as architectural and recognition motifs // Structure. — 2000. — Т. 8, № 3. — С. R47—R54. — doi:10.1016/S0969-2126(00)00110-6.
- Mikkola S., Nurmi K., Yousefi-Salakdeh E., Strömberg R., Lönnberg H. The mechanism of the metal ion promoted cleavage of RNA phosphodiester bonds involves a general acid catalysis by the metal aquo ion on the departure of the leaving group (англ.) // Perkin transactions 2 : journal. — 1999. — P. 1619—1626. — doi:10.1039/a903691a.
- Mathews D. H., Disney M. D., Childs J. L., Schroeder S. J., Zuker M., Turner D. H. Incorporating chemical modification constraints into a dynamic programming algorithm for prediction of RNA secondary structure (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2004. — Vol. 101, no. 19. — P. 7287—7292. — doi:10.1073/pnas.0401799101.
- Redirect (недоступная ссылка). Дата обращения: 5 апреля 2008. Архивировано 20 августа 2007 года.
- Spriggs K. A., Stoneley M., Bushell M., Willis AE. Re-programming of translation following cell stress allows IRES-mediated translation to predominate (англ.) // Biol Cell. : journal. — 2008. — Vol. 100, no. 1. — P. 27—38.
- Higgs P. G. RNA secondary structure: physical and computational aspects (англ.) // Quarterly Reviews of Biophysics : journal. — 2000. — Vol. 33. — P. 199—253. — doi:10.1017/S0033583500003620.
- Nissen P., Hansen J., Ban N., Moore P. B., Steitz T. A. The structural basis of ribosome activity in peptide bond synthesis (англ.) // Science : journal. — 2000. — Vol. 289, no. 5481. — P. 920—930. — doi:10.1126/science.289.5481.920.
- Jeffrey L Hansen, Alexander M Long, Steve C Schultz. Structure of the RNA-dependent RNA polymerase of poliovirus (англ.) // Structure : journal. — 1997. — Vol. 5, no. 8. — P. 1109—1122. — doi:10.1016/S0969-2126(97)00261-X.
- Ahlquist P. RNA-Dependent RNA Polymerases, Viruses, and RNA Silencing (англ.) // Science : journal. — 2002. — Vol. 296, no. 5571. — P. 1270—1273. — doi:10.1126/science.1069132.
- Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters. Molecular Biology of the Cell; Fourth Edition (англ.). — New York and London: Garland Science, 2002. — P. 302—303.
- Wagner R., Theissen G., Zacharias. Regulation of Ribosomal RNA synthesis and Control of ribosome Formation in E.coli (англ.). — 1993. — P. 119—129.
- Cooper G. C., Hausman R. E. The Cell: A Molecular Approach. — 3rd edition. — Sinauer, 2004. — С. 261—276. — ISBN 0-87893-214-3.
- Wirta W. Mining the transcriptome – methods and applications (англ.). — 2006. — ISBN 91-7178-436-5.
- Berg J. M., Tymoczko J. L., Stryer L. Biochemistry. — 5th edition. — WH Freeman and Company, 2002. — С. 118—119. — ISBN 0-7167-4684-0.
- Rossi J. J. Ribozyme diagnostics comes of age // Chemistry & Biology. — 2004. — Т. 11, № 7. — С. 894—895. — doi:10.1016/j.chembiol.2004.07.002.
- Kampers T., Friedhoff P., Biernat J., Mandelkow E-M, Mandelkow E. RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments (англ.) // FEBS Letters : journal. — 1996. — Vol. 399. — P. 98—100, 344—49. — PMID 8985176.
- Gueneau de Novoa P., Williams K. P. The tmRNA website: reductive evolution of tmRNA in plastids and other endosymbionts (англ.) // Nucleic Acids Res. : journal. — 2004. — Vol. 32, no. Database issue. — P. D104—8. — doi:10.1093/nar/gkh102. — PMID 14681369.
- Matzke M. A., Matzke AJM. Planting the seeds of a new paradigm (англ.) // PLoS Biology : journal. — 2004. — Vol. 2, no. 5. — P. e133. — doi:10.1371/journal.pbio.0020133. — PMID 15138502.
- Check E. RNA interference: hitting the on switch (англ.) // Nature. — 2007. — Vol. 448, no. 7156. — P. 855—858. — doi:10.1038/448855a. — PMID 17713502.
- Vazquez F., Vaucheret H., Rajagopalan R., Lepers C., Gasciolli V., Mallory A. C., Hilbert J., Bartel D. P., Crété P. Endogenous trans-acting siRNAs regulate the accumulation of Arabidopsis mRNAs (англ.) // Molecular Cell : journal. — 2004. — Vol. 16, no. 1. — P. 69—79. — doi:10.1016/j.molcel.2004.09.028. — PMID 15469823.
- Doran G. RNAi – Is one suffix sufficient? // Journal of RNAi and Gene Silencing. — 2007. — Т. 3, № 1. — С. 217—219. Архивировано 16 июля 2007 года.
- Horwich M. D., Li C Matranga C., Vagin V., Farley G., Wang P., Zamore P. D. The Drosophila RNA methyltransferase, DmHen1, modifies germline piRNAs and single-stranded siRNAs in RISC (англ.) // Current Biology : journal. — Cell Press, 2007. — Vol. 17. — P. 1265—1272. — doi:10.1016/j.cub.2007.06.030. — PMID 17604629.
- Girard A., Sachidanandam R., Hannon G. J., Carmell M. A. A germline-specific class of small RNAs binds mammalian Piwi proteins (англ.) // Nature : journal. — 2006. — Vol. 442. — P. 199—202. — doi:10.1038/nature04917. — PMID 16751776.
- Brennecke J., Malone C. D., Aravin A. A., Sachidanandam R., Stark A., Hannon G. J. An epigenetic role for maternally inherited piRNAs in transposon silencing (англ.) // Science : journal. — 2008. — November (vol. 322, no. 5906). — P. 1387—1392. — doi:10.1126/science.1165171. — PMID 19039138.
- Wagner E. G., Altuvia S., Romby P. Antisense RNAs in bacteria and their genetic elements (англ.) // Adv Genet. : journal. — 2002. — Vol. 46. — P. 361—398. — PMID 11931231.
- Gilbert S. F. Developmental Biology. — 7th ed. — Sinauer, 2003. — С. 101—103. — ISBN 0878932585.
- Hüttenhofer A., Schattner P., Polacek N. Non-coding RNAs: hope or hype? (англ.) // Trends Genet. : journal. — 2005. — Vol. 21, no. 5. — P. 289—297. — doi:10.1016/j.tig.2005.03.007. — PMID 15851066.
- Heard E., Mongelard F., Arnaud D., Chureau C., Vourc'h C., Avner P. Human XIST yeast artificial chromosome transgenes show partial X inactivation center function in mouse embryonic stem cells (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1999. — Vol. 96, no. 12. — P. 6841—6846. — doi:10.1073/pnas.96.12.6841. — PMID 10359800.
- Batey R. T. Structures of regulatory elements in mRNAs (англ.) // Curr. Opin. Struct. Biol.. — 2006. — Vol. 16, no. 3. — P. 299—306. — doi:10.1016/j.sbi.2006.05.001. — PMID 16707260.
- Steitz T. A., Steitz J. A. A general two-metal-ion mechanism for catalytic RNA (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1993. — Vol. 90, no. 14. — P. 6498—6502. — doi:10.1073/pnas.90.14.6498. — PMID 8341661.
- Covello P. S., Gray M. W. RNA editing in plant mitochondria (англ.) // Nature. — 1989. — Vol. 341. — P. 662—666. — doi:10.1038/341662a0. — PMID 2552326.
- Omer A. D., Ziesche S., Decatur W. A., Fournier M. J., Dennis P. P. RNA-modifying machines in archaea // Molecular Microbiology. — 2003. — Т. 48, № 3. — С. 617—629. — doi:10.1046/j.1365-2958.2003.03483.x. — PMID 12694609.
- Daròs J. A., Elena S. F., Flores R. Viroids: an Ariadne's thread into the RNA labyrinth (англ.) // EMBO Rep. : journal. — 2006. — Vol. 7, no. 6. — P. 593—598. — doi:10.1038/sj.embor.7400706. — PMID 16741503.
- Kalendar R., Vicient C. M., Peleg O., Anamthawat-Jonsson K., Bolshoy A., Schulman A. H. Large retrotransposon derivatives: abundant, conserved but nonautonomous retroelements of barley and related genomes (англ.) // Genetics : journal. — 2004. — Vol. 166, no. 3. — P. D339. — doi:10.1534/genetics.166.3.1437. — PMID 15082561.
- Blevins T, Rajeswaran R, Shivaprasad PV, Beknazariants D, Si-Ammour A, Park HS, Vazquez F, Robertson D, Meins F, Hohn T, Pooggin MM (2006). “Four plant Dicers mediate viral small RNA biogenesis and DNA virus induced silencing”. Nucleic Acids Research. 34 (21): 6233—46. DOI:10.1093/nar/gkl886. PMC 1669714. PMID 17090584.
- Jana S, Chakraborty C, Nandi S, Deb JK (November 2004). “RNA interference: potential therapeutic targets”. Applied Microbiology and Biotechnology. 65 (6): 649—57. DOI:10.1007/s00253-004-1732-1. PMID 15372214. Неизвестный параметр
|s2cid=(справка) - Schultz U, Kaspers B, Staeheli P (May 2004). “The interferon system of non-mammalian vertebrates”. Developmental and Comparative Immunology. 28 (5): 499—508. DOI:10.1016/j.dci.2003.09.009. PMID 15062646.
- Whitehead KA, Dahlman JE, Langer RS, Anderson DG (2011). “Silencing or stimulation? siRNA delivery and the immune system”. Annual Review of Chemical and Biomolecular Engineering. 2: 77—96. DOI:10.1146/annurev-chembioeng-061010-114133. PMID 22432611.
- Hsu MT, Coca-Prados M (July 1979). “Electron microscopic evidence for the circular form of RNA in the cytoplasm of eukaryotic cells”. Nature []. 280 (5720): 339—40. Bibcode:1979Natur.280..339H. DOI:10.1038/280339a0. PMID 460409. Неизвестный параметр
|s2cid=(справка) - Neveu M., Kim H. J., Benner S. A. The "strong" RNA world hypothesis: fifty years old // Astrobiology. — 2013. — Апрель (т. 13, № 4). — С. 391—403. — doi:10.1089/ast.2012.0868. — . — PMID 23551238.. — «[The RNA world's existence] has broad support within the community today.».
- Cech T. R. The RNA worlds in context // Cold Spring Harbor Perspectives in Biology. — 2012. — Июль (т. 4, № 7). — С. a006742. — doi:10.1101/cshperspect.a006742. — PMID 21441585.
- Patel B. H., Percivalle C., Ritson D. J., Duffy C. D., Sutherland J. D. Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism (англ.) // Nature Chemistry : journal. — 2015. — April (vol. 7, no. 4). — P. 301—307. — doi:10.1038/nchem.2202. — . — PMID 25803468.
- Robertson M. P., Joyce G. F. The origins of the RNA world // Cold Spring Harbor Perspectives in Biology. — 2012. — Май (т. 4, № 5). — С. a003608. — doi:10.1101/cshperspect.a003608. — PMID 20739415.
- Wade, Nicholas. Making Sense of the Chemistry That Led to Life on Earth, New York Times (4 мая 2015). Архивировано 9 июля 2017 года. Дата обращения 10 мая 2015.
- Copley S. D., Smith E., Morowitz H. J. The origin of the RNA world: co-evolution of genes and metabolism (англ.) // Bioorganic Chemistry : journal. — 2007. — December (vol. 35, no. 6). — P. 430—443. — doi:10.1016/j.bioorg.2007.08.001. — PMID 17897696.. — «The proposal that life on Earth arose from an RNA World is widely accepted.».
- Zimmer, Carl. A Tiny Emissary from the Ancient Past, New York Times (25 сентября 2014). Архивировано 27 сентября 2014 года. Дата обращения 26 сентября 2014.
- Shen, Liang.; Hong-Fang, Ji. Small Cofactors May Assist Protein Emergence from RNA World: Clues from RNA-Protein Complexes (англ.) // PLOS One : journal. — Public Library of Science, 2011. — Vol. 6. — P. e22494. — doi:10.1371/journal.pone.0022494. — PMID 21789260.
- Garwood, Russell J. Patterns In Palaeontology: The first 3 billion years of evolution (англ.) // Palaeontology Online : journal. — 2012. — Vol. 2, no. 11. — P. 1—14. Архивировано 26 июня 2015 года.
Литература
- Альбертс Б.; Брей Д.; Льюис Дж. и др. Молекулярная биология клетки в 3-х томах. — М.: Мир, 1994. — 1558 с. — ISBN 5-03-001986-3
- История биологии с начала XX века до наших дней. — М.: Наука, 1975. — 660 с.
- Льюин Б. Гены. — М.: Мир, 1987. — 544 с.
- Спирин А. С. Биосинтез белков, мир РНК и происхождение жизни
- Molecular Biology Of The Cell, 4-е издание, 2002 г. — учебник по молекулярной биологии на английском языке
Ссылки
- Предсказание вторичной структуры РНК (англ.)
- База данных геномных тРНК (англ.)
- База данных псевдоузлов (англ.)
- Химики преодолели главное препятствие на пути к абиогенному синтезу РНК
