Очоа, Северо
Севе́ро Очо́а де Альборно́с (исп. Severo Ochoa de Albornoz; 25 сентября 1905, Луарка, Испания — 1 ноября 1993, Мадрид) — испанский и американский биохимик, лауреат Нобелевской премии по физиологии или медицине 1959 года «за открытие механизмов биосинтеза РНК и ДНК»[2] (вместе с А. Корнбергом).
| Северо Очоа | |
|---|---|
| исп. Severo Ochoa de Albornoz | |
 | |
| Дата рождения | 25 сентября 1905 |
| Место рождения | Луарка, Испания |
| Дата смерти | 1 ноября 1993 (88 лет) |
| Место смерти | Мадрид, Испания |
| Страна | Испания, США |
| Научная сфера | биохимия |
| Место работы | |
| Альма-матер | |
| Учёная степень | докторская степень (1930) |
| Научный руководитель |
Отто Мейергоф Генри Дейл |
| Ученики | Мануэль Лосада Вильясанте[d] |
| Награды и премии |
Premio Lección Conmemorativa Jiménez Díaz (1969) Национальная научная медаль США (1979) |

Биография и научная работа
Обучение. Первые работы
Северо Очоа родился 25 сентября 1905 года в Луарке, небольшом городке в Астурии, на побережье Атлантического океана[3]. Он был младшим из семи сыновей, его отец был юристом и бизнесменом и умер, когда Северо было 7 лет.
После смерти отца семья, стремясь пожить в средиземноморском климате, перебралась в Малагу, на побережье, живя там с середины сентября по середину июня. Там Северо пошёл в частную школу, поддерживаемую иезуитами, а потом в высшую школу, где получил степень бакалавра в 1921 году. В течение последнего года в высшей школе он заинтересовался естественными науками и в 1923 году поступил в Медицинскую Школу при Мадридском Университете. Он никогда не стремился быть доктором, однако медицина позволила ему изучать биологию. Он был очарован испанским нейробиологом Сантьяго Рамон-и-Кахалем и мечтал об изучении гистологии под его началом. Но, к великому сожалению Северо, когда он поступил в Медицинскую Школу, Кахаль, которому было уже более 70 лет, отошёл от науки. Однако Северо Очоа никогда не уставал перечитывать биографию Кахаля, а его книга под названием «Рекомендации к научным исследованиям» (Advice on scientific research) имела на Очоа огромное влияние. На третьем курсе медицинской школы Очоа решает посвятить свою жизнь изучению биологии.
Вторым учёным, кто имел сильное влияние на Северо Очоа, был один из его учителей, Хуан Негрин, который бывал в Германии. Он советовал Очоа читать книги не только на испанском языке. На тот момент единственным иностранным языком, которым владел Очоа, был французский, и его последующее решение ехать в Германию и Англию для соискания степени доктора было вызвано стремлением изучать иностранные языки. Профессор Негрин предоставил Северо Очоа и его другу Хосé Вальдекáсасу возможность проводить некоторые исследования в его лаборатории в свободное время. Он предложил им выделить креатинин из мочи. Северо Очоа заинтересовался функциями и метаболизмом креатина и креатинина. Очоа и Вальдекасас предложили простой микрометод для определения концентрации креатина в мышцах[4]. Для применения этого метода и овладения английским языком Очоа провёл 2 месяца в Глазго у профессора Ноэля Патона, который работал над метаболизмом креатина. Вернувшись в Испанию с хорошим знанием английского (у него была прирождённая способность к изучению языков), он предложил Журналу биологической химии (Journal of Biological Chemistry) статью с описанием своего метода количественного определения креатина и с удовольствием обнаружил, что метод был принят после незначительной проверки[5]. Изучение креатина повлекло за собой интерес Очоа к химии сокращения мышц и к работе немецкого ученого Отто Мейерхоффа над фосфокреатином, только что открытом соединении.
Работа в Германии и Англии
Отто Мейерхоф работал в Институте Кайзера Вильгельма (Kaiser Wilhelm Institute, K.W.I.), основанном в 1910 году в Далеме, фешенебельном пригороде Берлина. Промышленниками и банкирами, понимающими, что благосостояние Германии основывается на быстром развитии фундаментальных наук, были обеспечены большие средства. Две значительных фигуры биохимии — Карл Нойберг, директор Института, и Отто Варбург — работали в K.W.I. Мейерхофа интересовала проблема: как потенциальная энергия пищи становится доступной клетке? Он выбрал мышцу как экспериментальную модель, чтобы попытаться найти связь между химическими превращениями и производством тепла и механической работой. Северо Очоа обратился с просьбой к Мейерхофу, чтобы тот позволил ему посвятить в его лаборатории некоторое время изучению как сокращения мышц, так и Германии в целом. К его удовольствию, он был принят там и прибыл в лабораторию осенью 1929. Северо Очоа не знал немецкого, однако Мейерхоф говорил по-английски, и спустя два месяца Северо Очоа выучил немецкий в той степени, которая была достаточна для дальнейшего общения. В числе других аспирантов в K.W.I. работали также Фриц Липман и Дэвид Нахмансон. Одной из замечательных особенностей K.W.I. являлось стремление устранить барьер между физикой, химией и биологией. K.W.I. дал огромный толчок молодым биохимикам, таким, как Северо Очоа и Фриц Липман. Северо Очоа изучал, как сокращение мышц может использовать иную энергию, помимо той, что поступает от распада углеводов, и влияет ли распад фосфокреатинина на сокращения. Ответ пришёл позже (после открытия ATФ), когда Ломан обнаружил, что фосфокреатин регенерирует ATФ путём переноса PO4 к AДФ. В конце 1929 года Мейерхоф перешёл из Далема в Гейдельберг, где Общество Кайзера Вильгельма построило красивое новое здание, включающее четыре исследовательских института (физический, химический, физиологический и экспериментальной медицины). Мейерхоф был назначен директором Физиологического Института, и Северо Очоа переехал с ним в Гейдельберг. Он вернулся в Мадрид в 1930, защитив диссертацию о роли надпочечников в сокращении мышц, и в 1931 женился на Кáрмен Кобиáн Гарси́я. Вскоре он снова выехал заграницу (уже с женой) в лабораторию Генри Дэйла (Национальный институт медицинских исследований в Лондоне), где работал над своим первым ферментом, глиоксилазой, поддерживая дружеские отношения с Мадридским университетом. Очоа оставался в Лондоне два года и вернулся от своих исследований глиоксилазы к роли надпочечников в сокращении мышц.
Конец 1930-х. Переезд в США
В 1935 году Очоа был выдвинут на место директора отдела физиологии в новом институте в Мадриде. Но через несколько месяцев началась Гражданская война в Испании, и он решил покинуть Испанию и вернуться к Мейерхофу. Когда Очоа приехал в Германию, в 1936 году, страна была на пике нацизма, и позиция Мейерхофа была шаткой. Его лаборатория, однако, работала продуктивно, но в ней произошли серьёзные изменения: из лаборатории физиологии она превратилась в лабораторию биохимии. Гликолиз и ферментация в мышцах, выделение дрожжей, частные реакции, катализируемые очищенными ферментами, были главными предметами исследования. Этот период, однако, продлился недолго, пока Мейерхоф в августе 1939 не переехал в Париж, присоединившись к Институту биологии и физической химии. Перед отъездом Мейерхоф устроил Очоа в лабораторию биологии моря в Плимуте на шесть месяцев. Наконец, Очоа работал с Рудольфом Питерсом в Оксфордском университете. Работа с Питерсом над ролью витамина B1 (тиамина) и кокарбоксилазы (пирофосфорного сложного эфира тиамина) в процессе окисления пирувата была очень продуктивна[6][7]. Они установили, что кокарбоксилаза и связанный тиамин являются коферментами в данном процессе, происходящем в голубином мозге. Они также показали необходимость в адениновых нуклеотидах, наводящую на мысль о плотном сосуществовании окисления и фосфорилирования, что увеличило интерес Очоа к окислительному фосфорилированию. Но оксфордский период продлился недолго из-за Второй мировой Войны. Лаборатория была использована для работы на нужды войны, и Очоа как иностранец был уволен. Он решает отправиться в Соединённые Штаты и пишет Карлу и Герти Кори (Медицинский факультет Вашингтонского университета в Сент-Луисе); его туда принимают. Кори находит финансирование, и в августе 1940-го года Кармен и Северо Очоа отплывают в США. Лаборатория Карла и Герти Кори была потрясающим местом: в центре внимания там находились ферменты, особенно гликогенфосфорилаза. Очоа многое узнал, несмотря на то, что его собственная работа над ферментативным механизмом конверсии фруктозы в глюкозу в экстракте печени стала, скорее, разочарованием. Однако он понимал важность техники выделения и характеризации ферментов и овладел ею. В 1942 году он занял должность научного сотрудника на Медицинском факультете Нью-Йоркского Университета (N.Y.U.).
Промежуточный метаболизм
Два года Очоа работал на Медицинском факультете Нью-Йоркского Университета, после чего перешёл на факультет биохимии в старое здание через дорогу, где занял должность помощника профессора биохимии. Два года спустя он стал фармакологом. Факультет Фармакологии также базировался в старом здании и имел новые лаборатории, так что Северо Очоа приобрёл больше пространства и расширил свою деятельность, принимая на работу студентов и работников со степенью. Его первое исследование в Нью-Йоркском Университетe было связано с окислительным фосфорилированием. Ранее, в Оксфорде, Северо Очоа показал, что окисление сопровождает фосфорилирование AMP в ATP, следую за переносом фосфора от ATP к сахару[8]. Обязательное сосуществование фосфорилирования и окисления пирувата, также доказанное Белитцером в СССР и Калкаром в Дании, является значительным открытием. Используя сердечный гомогенат, он определил атомное соотношение эстерифицированного фосфора к затраченному кислороду (отношение P/O). Сравнение фосфорилирования, причиной которого является окисление пировиноградной кислоты с тем, причиной которого является дисмутация пировиноградной кислоты и фосфоглицериновой кислоты в сердечном экстракте дала P/O = 3 для первой реакции[9]. Ранее оно равнялось 2; заниженным значение P/O было вследствие потерь, вызванных гидрозизом ATP ATP-азой. Значение 3 было в дальнейшем подтверждено А. Ленингером с использованием митохондрий. После завершения этой работы, Северо Очоа счёл, что механизм окислительного фосфорилирования, не может быть понят без дополнительных знаний о ферментативных реакциях, протекающих при окислении, особенно о тех, которые сопутствуют фосфорилированию. Как было известно благодаря Кребсу, цикл трикарбоновых кислот является главным окисления пищи в клетке, а Килин и Варбург в своей работе показали, что в этот процесс вовлечены пиридиновые нуклеотиды, флавопротеины и цитохромы. Очоа выбрал для изучения изолимонную дегидрогеназу.
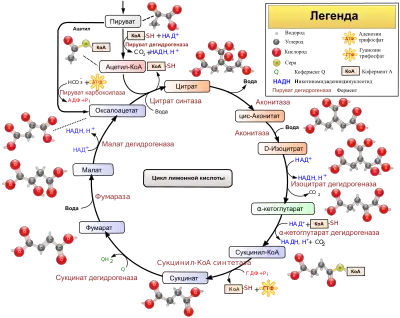
Было известно, что изоцитрат образуется из цитрата с помощью цис-аконитата, но реакция, ведущая к α-кетоглютарату, не была доказана, только предсказана, и Очоа решил приготовить предполагаемый интермедиат «оксалосукциновую кислоту», чего он и достиг после нескольких неудачных попыток. Начав с оксалосукциновой кислоты, он наблюдал образование α-кетоглютарата и сделал заключение о том, что оксалосукциновая кислота действительно является интермедиатом данной реакции. Тем временем, биохимики были поражены явлением фиксации CO2, имеющей место в гетеротрофной бактерии, продемонстрированным Вудом и Веркманом. Очоа пришло на ум, что реакция изолимонной дегидрогеназы обратима и обуславливает механизм процесса фиксации CO2 в клетках животных. Лаборатория Северо Очоа не была оснащена приборами, использующими изотопы; он решил, что может изучить реакцию, которая должна привести к окислению NADPH спектрофотометрическим путём, если изоцитрат образуется путём фиксации CO2 на α-кетоглютарате. Однако, как он пишет в «Ежегодном обозрении» (Annual Reviews), он не верил, что это сработает и оттягивал эксперимент до тех пор, пока не был ободрён Эвраимом Ракером. Последний работал на факультете микробиологии этажом ниже, и между ними было много дискуссий. Когда, наконец, Очоа провёл эксперимент и увидел, как стрелка спектрофотометра пришла в движение, показывая окисление NADPH[10], он настолько обезумел от счастья, что выбежал и закричал: «идите и посмотрите, как двигается стрелка спектрофотометра!». Но, учитывая, что было уже 9 вечера, вокруг никого не оказалось. Спектрофотометр, на котором был произведён эксперимент, был передан в дар Американскому Философскому Обществу и должен был быть возвращённым через год, но успех экспериментов и необходимость в спектрометре для дальнейшей работы заставила Общество разрешить Очоа сохранить прибор у себя. После этого он становится виртуозом спектрофотометрического исследования окислительных ферментов; часто исследуемая реакция могла соединяться с тремя или четырьмя другими ферментативными реакцями до тех пор, пока цепь не завершится, и NAD- или NADP-зависимые реакции, в которых окислялись или восстанавливались пиридиновые нуклеотиды, могли обеспечить основу для непрерывного спектрометрического исследования активности ферментов. Долгое время этот спектрофотометр был единственным на всём факультете — успешные американские лаборатории не были столь обеспечены, как это иногда казалось.
В это время у Северо Очоа был его первый дипломник, Алан Мелер, а также два аспиранта: Сантьяго Грисоли́а и Артур Корнберг. Как-то раз, Алан, наблюдая за образованием пирувата из малата, заметил быстрое окисление малата при добавлении NADP к экстракту голубиной печени. Это привело к открытию «яблочного» фермента — малатдегидрогеназы[11]. Фермент катализирует обратимую реакцию:
«Яблочный» фермент также катализирует образование пирувата из оксалоацетата, протекающее с выделением CO2 и восстановлением малата NADPH. Это работает в окислении жирных кислот, обусловленным коэнзимом А и NADPH. Они заключили, что это — один фермент с двумя активными центрами. Это напомнило им о реакции изолимонной дегидрогеназы и привело к заключению, что изолимонная дегидрогеназа, которая, как говорилось ранее, катализирует две реакции, также имеет два активных центра: один для изоцитрата, другой для окисления оксалосукциновой кислоты, и, что это не смесь двух ферментов — изолимонной дегидрогеназы и оксалосукциновой дегидрогеназы — как считалось ранее.
«Яблочный» фермент был использован Вольфом Вишняком и Очоа для реакции восстановительного карбоксилирования пирувата в малат в присутствии гран шпината и NADPH[12]. Это была первая демонстрация фотохимического восстановления пиридиновых нуклеотидов хлоропластовыми препаратами. В 1948 году Джо Штерн, бывший дипломник Ганса Кребса, в ранге доктора наук переходит в лабораторию Северо Очоа. Очоа решает, что настал момент для работы над самым интересным ферментом цикла Кребса, над тем, который образует цитрат из оксалоацетата и активного ацетата. Он был известен, как «конденсирующийся» фермент. Экстракт тканей животных был, однако, неактивен в цитратном синтезе, но они не унывали и верили, что такое происходит из-за нерастворимости фермента. Они сменили бактерию, надеясь, что фермент растворится. Использовать организмы, наиболее пригодные для решения проблемы было характерной чертой Северо Очоа. Наконец, совместив экстракты кишечной палочки и свиного сердца они добиваются хорошего синтеза цитрата из ацетилфосфата и оксалоацетата в присутствии каталитических количеств коэнзима А. Как было установлено в дальнейшем Эрлом Стадтманом, экстракт кишечной палочки «оберегает» фермент трансацетилазу. Этот фермент катализирует перенос ацетильной группы от ацетилфосфата к коэнзиму А, образуя ацетил CoA + PO4. Экстракт свиного сердца предохраняет конденсирующийся фермент. Они очистили конденсирующийся фермент до гомогенного состояния и Очоа, прибавляя несколько капель сульфата аммония, кристаллизовал его[13]. Он был очень горд и сфотографировал кристаллы. Позже, в совместном с Феодором Линеном исследовании, он показал, что конденсирующийся фермент катализирует обратимую реакцию перехода ацетил CoA и оксалоацетата в CoA + цитрат[14]. Очоа был, действительно, очень зайнтересован в первых стадиях окисления пирувата. В то же время, Ирвин Гонсалус проводит некоторое время, работая по гранту, и, совместно с Сеймуром Коркесом и Элис дель Кампилльо, изучает окисление пирувата в кишечной палочке[15]. Осознавая важность ацетила CoA как интермедиата в метаболизме, лаборатория Очоа занялась исследованием важного вопроса о метаболизме жирных кислот. CoA-трансфераза была открыта Джо Штерном и Минором Куном[16]. Джо Штерн также идентифицировал фермент кротоназу, которую кристаллизовала Элис дель Компильо. Кротоназа катализирует дегидратацию β-гидроксибутирил CoA с образованием кротонила CoA. Кротонил CoA в дальнейшем превращается в бутирил CoA. Этот фермент тесно связан с соединением, получающимся окислением нечётных жирных кислот и некоторых аминокислот.
Было также несколько сообщений о том, что окисление пропионата включает в себя фиксацию CO2 и ведёт к образованию сукцината. Северо Очоа просит Мартина Флавина, присоединившегося к группе, исследовать этот процесс. Флавин, используя экстракт свиного сердца, обнаружил, что данный экстракт переводит пропионат в дикарбоновую кислоту, но кислота эта не сукциновая, а метилмалонат[17][18]. Работа М. Флавина, Й. Казиро, Э. Леоне, П. Лэнгиэла, Р. Мацундера и других показывает, что пропионат сперва переходит в пропионил CoA карбоксилазу — фермент, содержащий биотин; затем метилмалонил CoA изомеризуется до A и B-форм. В-форма даёт сукцинил CoA из метилмалонилмутазы[19]; мутаза — фермент В12. Пропионил CoA карбоксилаза, выкристаллизованная Казиро, карбоксилируется и переносит карбоксильную группу пропионилу CoA.
Интересный фермент цикла трикарбоновых кислот, открытый Кауфманом в шпинате, катализирует синтез ATF из ADF, Pi и сукцинила CoA. Сукцинил CoA был затем деацетилирован в сукцинат и CoA[20][21]. Фермент был обозначен как фосфорилирующий фермент или P-фермент, а затем сукциниктиокеназа. P-фермент участвует в субстраном фосфорилировании, следующем за декарбоксилированем кетоглютарата в цикле Кребса. Этот фермент убедил Очоа вернуться к изучению окислительного фосфорилирования.
Полинуклеотидфосфорилаза
В 1955 году он вместе с аспиранткой Марианной Грюнберг-Манаго (уроженкой России, впоследствии известным биохимиком, работавшей во Франции) выделил из микроорганизма Azotobacter vinelandi новый фермент, который катализировал синтез in vitro сходной с РНК молекулы, состоящей из 4, 3, 2 и даже одного азотистого основания. Ферменту было дано название «полинуклеотидфосфорилаза». Тщательные эксперименты показали, что синтетический полирибонуклеотид напоминает собой натуральную РНК по размеру. Его молекулярная масса варьировала от 30000 до 1-2 х 106 Да. Были сходны и константы седиментации. Для проведения надежной реакции синтеза РНК требовался высокоочищенный фермент, для чего использовали хроматографию. Кроме того, для инициации синтеза необходимо было добавление в раствор небольшого количества олигомера — тогда происходит наращивание полимерной цепочки. При обработке синтезированного РНК-подобного полимера панкреатической рибонуклеазой получается смесь олигонуклеотидов такая же, как и при расщеплении натуральной РНК в сходных условиях. В опытах с гидролизом синтезированного полимера с помощью фосфодиэстеразы, выделенной из змеиного яда и ткани селезёнки, было показано, что полученная экспериментально РНК представляет собой линейную цепочку, нуклеозидные единицы которой связаны 3,5’-фосфодиэфирными мостиками. Через два года Артур Корнберг выделил из кишечной палочки фермент ДНК-полимеразу и с его помощью осуществил синтез ДНК. В 1959 г. обоим учёным была вручена Нобелевская премия[22][23][24][25].
Генетический код
После открытия полинуклеотидфосфорилазы, в лаборатории Северо Очоа занимались, главным образом, двумя вещами: окислением пропионата, изучавшееся докторами, пришедшими после ухода Мартина Флавина, и, собственно, самой полинуклеотидфосфорилазой. Очоа работал с новым учёным из Японии — Санаи Ми — над реакцией синтеза, надеясь, что с дальнейшим очищением фермента выяснятся праймер или матричные ограничения. Фактически, это был единственный случай, когда протеолизирующийся фермент нуждался в праймере для синтеза полимера. Несмотря на то, что в дальнейшем эти исследования не оказались полезными в определении роли фермента in vivo, они принесли чрезвычайно большую пользу в синтезе многих полимеров. Таким образом, лаборатория Очоа была готова к экспериментам in vitro над генетическим кодом.
Общее представление об мРНК было сформулировано в 1960-е, и в 1961 году Ниренберг и Маттаи, на Международном Конгрессе по Биохимии в Москве, сообщили, что экстракт кишечной палочки переносит полиуридилат (poly U) в полифенилаланин. Это была самая будоражащая новость на конгрессе, после которой стало ясно, что открывается большое поле для экспериментов в изучении генетического кода. Между лабораторями Очоа и Ниренберга в следующие месяцы началась гонка по изучению эффекта, оказывающегося различными сополимерами на соединение аминокислот. Вычисляя статистическое построение триплетов в гетерополимерах, было возможно определиль их соотношение для большинства аминокислот[26][27]. В работу были вовлечены Питер Ленгиэл, Джо Спейер, Венди Стэнли и Альберт Вабха, но Очоа лично проводил этот проект, и технические ресурсы факультета были полностью брошены на синтез как можно большего числа соединений, в которых нуждалась работа по декодированию.
Таким образом, чтобы идентифицировать триплеты, кодирующие каждую из 20 аминокислот, не потребовалось много времени, как и на то, чтобы показать, что код был обращённым во многих случаях, некоторые триплеты кодируют одинаковые аминокислоты. Последовательность триплетов, определяющая аминокислоты, была определена Филлипом Ледером и Маршаллом Ниренбергом после открытия того факта, что последовательности триплетов специфических оснований способствовали связыванию особых аминоацил-тРНК с рибосомой. Об этом было объявлено на Международном Конгрессе по Биохимии в Нью-Йорке в 1964 году. Химическим выделением соответствующей мРНК код для аминокислот красиво подтвердил Гобин Хорана, используя синтез олигоксирибонуклеотидов и транскрипцию с использованием РНК-полимеразы. Концевые триплеты были найдены в ходе оригинальных генетических экспериментов Сидни Бреннера в Кэмбридже и Гарена в Йеле. Маркер из Кэмбриджа открыл, что AUG -кодон, инициирующий цепь. Используя полинуклеотиды, начиная с AUG или дргого кодона, приготовленные с помощью полинуклеотидфосфорилазы, лаборатория Северо Очоа определила, что направление чтения — от 5’ к 3’[28][29]. Он также in vitro определил, что UAA — один из концевых кодонов[30].
Инициирующие гены синтеза белка
Сразу три группы — Маргарита Салас и Стэнли у Очоа, Айзенштадт и Браверманн и Ревель с Гросом обнаружили, что природная мРНК, как MS2 и QB бактериофагов переносится неочищенными рибосомами кишечной палочки, а рибосомами, промытыми с 0,5 или 1М сульфатом аммония, не переносится. Однако отмытые рибосомы легко переносят polyA или polyU, но не полимеры, начинающиеся с AUG, которые ведут себя как природные мРНК. Было открыто, что сульфат аммония вымывает содержащийся там белковый ген, названный «геном инициации», нужный для переноса природной мРНК или полинуклеотидов, начинающихся с AUG[31][32]. Первые два гена, а позднее и третий, были выделены и теперь называются IF1, IF2 и IF3[33]. В то же время Кларком и Маркером было показано, что полипептидные цепи бактерий начинаются со специфического метил-тРНКfMet, который эстерифицирует метионин, который, в свою очередь, вырабатывается и обнаруживается в полипептидной цепи в концевой аминной позиции. Метил-тРНКfMet кодируется AUG, и пролонгатор метил-тРНКfMet не может быть выработан специфической формилазой. По поводу понимания роли IF1 и IF3 и последовательности событий, ведущих к инициации образования комплекса в кишечной палочке, велись споры и дебаты, даже в группе Очоа. Теперь это ясно благодаря исследованиям многих учёных.
В начале 1970-го Очоа переключается на изучение инициации трансляции в эукариотах[34]. Ричард Свит в 1968 году первым обнаружил гены инициации в эукариотах. Аналоги IF2 были затем выделены в нескольких лабораториях (Даниэль Левин, Тэо Стаэлин, Наба Гупта). eIF2, как теперь его называют, состоит из цепи из трёх полипептидов, и его функции — образовывать трёхкомпонентный комплекс из GTP и инициатора тРНК метил-тРНК, в котором не вырабатывается метионин. Но эта тРНК, однако, отдельна от пролонгатора метил-тРНК. В присутствии 40S-субъединиц рибосом тройной комплекс даёт начало 40S-инициирующему комплексу. В одно время с некоторыми другими группами (Лондон, Вурма), Очоа и де Харо выделили белковый ген, который они назвали ESP[35]; у этого белка было множество названий, зависящих от группы, которая его открыла, теперь же он называется EiF2B. Его способ действия был объяснён гораздо позже. Он катализирует реакцию обмена между GTP и GDP, выделяя GDP и заменяя его на GTP. eIF2B был выделен в течение работ по изучению роли гема в глобиновом синтезе ретикулоцитлизатом. Гем препятствует фосфорилированию небольших субъединиц eIF2α специфической киназой[36]. Когда eIF2α фосфорилирован, он устойчиво связывается в тройной комплекс и предотвращает выделение eIF2B из катализируемой реакции обмена. Механизм в том, что eIF2B больше, чем eIF2, поэтому, чтобы предотвратить действие eIF2B, изолируя его, достаточно только частичного фосфорилирования eIF2.
Репликация РНК вируса
Северо Очоа был заинтересован в ферменте, ответственном за синтез РНК в вирусном геноме РНК, и, когда в 1961 году к нему на факультет пришёл Чарльз Вайсман, он предложил ему заняться репликацией РНК. Сначала, вместе с Джо Краковым, Вайссманн начал изучать репликацию РНК вируса табачной мозаики в листьях шпината, но вскоре переключился на кишечные палочки с заражёнными f2- или MS2-РНК[37]. Очоа всегда интересовался работой, но сам в ней участия не принимал. К Вайсману в разное время присоединялись многие учёные, такие, как Мартин Биллетер, Рой Бёрдон и Питер Борст. Между группами Вайсмана, Шпигельмана и Августа проходило соревнование. Объяснение механизма синтеза вирусной РНК было сложной задачей, так как фермент не был растворимым. В конечном счёте, выбор вируса Qβ оказался наилучшим. Qβ-РНК-полимеразу очистили до гомогенного состояния и доказали специфические ограничения для матрицы Qβ-РНК. В 1968 году все три группы встретились и пришли к общему заключению по механизму репликации РНК. На первой стадии на плюс-цепи матрицы образуется минус-цепь, промежуточное вещество имеет открытую структуру. Матрица и продукт не образуют двойную спираль, но держатся вместе при репликации. Структура разрушается внутри двуцепочечной структуры только при извлечении белков. На второй стадии репликации минус-цепь используется в качестве матрицы для синтеза плюс-цепи. Этот комплекс аналогичен первому, только матрица по всей длине — минус-цепь.
Последние годы
Летом 1974 года 69-летний Очоа ушёл на отдых с деканского кресла Биохимического Факультета. У него было предложение присоединиться к Институту молекулярной биологии Роше в Натли. Он принял его и до 1985 года продолжил свою работу над обменным геном GTP/GDP в эукариотах и над ролью фосфорилирования в процессе инициирования в эукариотах с Дж. Сикерка. В 1985 году они с Кармен вернулись в Испанию, где он продолжил работать почётным директором Центра молекулярной биологии при Мадридском университете. Центр был основан под его управлением и сейчас является одним из ведущих центров молекулярной биологии. Смерть Кармен в 1986 году опустошила его, и он так и не оправился от этого потрясения, потеряв смысл жизни. Он умер через семь лет после этого, в ноябре 1993 года в Мадриде. Похоронили его в Луарке, городке, где он родился.
Заключение
Жизнь Северо Очоа поучительна, и может рассматриваться, как резюме всей истории современной биохимии. Он любил говорить о своей работе в группе, никаких секретов об этом у него не было. Как только он стал биохимиком, он тянулся к обучению и для этого был во многих лабораториях. Как он сам говорил про себя, он не беспокоился о постоянном месте и всё время удивлялся. Первая должность со штатом служащих пришла к нему только в возрасте 39-40 лет. Биохимия была его хобби[38], однако Кармен пыталась установить в его жизни баланс между работой и досугом. Кармен, также, вероятна ответственна за то, что он, любящий музыку, редко пропускал концерты. Он также любил художественные выставки, театр и хорошие рестораны. У Очоа всегда были аристократические манеры и поведение европейского джентльмена, он редко был напряжён, но всегда был непоколебим в конфликтах, возникающих при интерпретации результатов, написании документов и расстановке приоритетов авторов. Как всякий патриарх, он очень огорчался, когда его лучшие студенты и сотрудники вылетали из-под его крыла в независимую жизнь. Несмотря на то, что он стал гражданином США и наслаждался жизнью в этой стране, он сохранил особую любовь к Испании, и практически всегда у него в группе работал испанец. Любовь эта была взаимна: хоть он и жил заграницей, он, бесспорно, был одним из известнейших людей в своей стране. В большинстве испанских городов есть улица, носящая его имя, его портрет можно увидеть в ресторане в Мадриде, куда он любил ходить, в Валенсии есть его музей, созданный его коллегой Сантьяго Гризолиа, а также его изображение стоит в музее восковых фигур в Барселоне. Он придал импульс карьерам многих своих студентов, начиная с Артура Корнберга и заканчивая Чарльзом Вайсманом, многие из них стали знаменитыми учёными.
Северо Очоа получил множество наград. Он был членом Американской национальной академии наук, Американской академии наук и искусств, иностранным членом Лондонского королевского общества и иностранным членом Академии наук СССР. У него было 36 почётных докторских степеней и более ста медалей и наград. Он также был президентом Международного союза биохимиков с 1961 по 1967 год и в 1959 году получил Нобелевскую премию.
Воспоминания Марианны Грюнберг-Манаго[3]
Первый раз я встретила Северо Очоа в 1952 году в Париже на втором международном конгрессе по биохимии. Высокому и красивому, тогда ему было 47 лет; он выглядел как испанский Идальго с дикими карими глазами и копной белых волос. В Сорбонне Очоа производил сильное впечатление своей понятной и познавательной лекцией о фиксации СО2 в процессе окисления субстрата, показывая красивые кристаллы сконденсированного фермента. Его имя было хорошо известно во Франции, но, главным образом, из литературы, так как Европа только приходила в себя от войны, и международных заседаний было немного. Это была моя первая подобная конференция, так что я волновалась. Являясь к тому моменту аспиранткой, я поняла, что хочу проводить свои исследования в его лаборатории, и мой научный руководитель Евгений Абель, представил меня ему. Северо Очоа свободно говорил по-французски, и я была потрясена, когда он одобрил мой переход к нему в Университет Нью-Йорка, назначив начало работы на сентябрь 1953 года. Мы договорились, что я, для начала, проведу несколько месяцев в лаборатории Ирвина Гонсалуса в Урбане. Очоа был очень доволен тем, что получил аспиранта и тем, что я восхищаюсь работами Гонсалуса. Последний одобрил план.
Когда я, после нескольких месяцев обучения энзимологии в лаборатории Гонсалуса в сентябре 1953 года прибыла в лабораторию Северо Очоа, она всё ещё находилась в старом здании (переехала в новое летом 1954 года). Я была разочарована, особенно тем, что при входе в лабораторию, мы были вынуждены пройти через анатомическую комнату, где студенты-медики препарировали трупы. Но в лаборатории была очень дружная атмосфера: там было тесновато, но очень хорошо организовано. Комнаты были оснащены всем необходимым, чтобы каждый чувствовал себя независимым и был доволен. Мортон Шнайдер, главный техник, и Питер Лозина были ответственными за опытную установку, и если у вас была проблема, вы всегда могли обратиться к Мортону, который оперативно её решал. Группа была достаточно маленькой: Джо Штерн, Элис дель Кампильо, Сеймур Кауфман и грек со степенью С. Алвисатос. Также на факультете, правда довольно обособленно, работал Чарли Гилвард, который занимался лизином и изучал диамины. У него был самое критическое и наделённое большим воображением мышление. Сара Ратнер также была независимым учёным, занималась она ферментативными стадиями мочевинового цикла Кребса. Мартин Флавин и Билл Якоби, который работал с муравьиной гидрогеназой, пришли позже. Ещё один аспирант, Эрни Роуз, пришёл тогда же, когда и я. Северо Очоа обычно приходил в 9, а заканчивал в 7, а дверь в его кабинет почти всегда была открыта. В Британии он научился продуктивно работать, не затрачивая на это много времени. Он обсуждал эксперимент с различными группами каждый день. Когда я пришла в лабораторию, в ней существовала традиция, которой Очоа старался придерживаться, чтобы все вместе собирались за ланчем, причём каждый, как это принято в Америке, со своим сендвичем. Происходило это мероприятие в одной из комнат лаборатории. Мне и Эрни это показалось скучным и формальным и мы решили отделиться от других и ходить в кафе. Через два дня Очоа поймал нас и спросил: «почему я не вижу вас за ланчем?». Мы ответили, что предпочитаем ходить в кафе и что нам уже надоели сендвичи, на что он ответил: «Как здорово, можно мне с вами?». С этого дня он ел с нами, а затем присоединились и остальные. Атмосфера в лаборатории, как это иногда бывает, целиком поменялась: она стала неформальной, расслабленной, насыщенной обменом информацией как о научных делах, так и о мирских. Беседы были очень интересны: кто-то мог задавать вопросы или придумывать методику, и я восхищалась умению Очоа создать высоконаучную и спокойную атмосферу в течение этих ланчей. По субботам мы ходили по разным ресторанам, а также был кофе-брейк и пирожные в полдень, где мы могли продолжить обсуждения.
Перед моим приездом лаборатория была оснащена для работы с изотопами. Механизм реакции P-фермента быстро постигался изучением реакции обмена между мечеными 32-м фосфором ADP или ATP и меченым сукцинатом сукцинилом-CoA. Эти исследования показывали промежуточные соединения фосфорилирования и вели к пониманию деталей механизма реакции. Применяемый метод был очень многообещающим, и Северо Очоа хотел применить его и в других реакциях, связанных с фосфорилированием. В особенности, он считал, что пришло время изучить ключевую и фундаментальную проблему времени: синтез ATP, происходящий во время окислительного фосфорилирования. Проблемой механизма этого процесса, занимались самые престижные и большие группы (Грин, Бойер, Ленинджер, Дарди, Ракер, Конн), конкурирующие между собой. Прежде, чем поручить процесс своим новым учёным (нам с Эрни), Северо Очоа должен был проверить наши способности в очистке ферментов и изучение их свойств. Поэтому, он дал нам начать с другой проблемы, интересовавшей его: механизм фосфорилирования ацетата ацетокиназой (без CoA в качестве интермедиата):
Он дал нам бутылку с высушенными кишечными палочками, и мы поняли, что должны работать над очисткой и механизмом для ацетокиназы с тем, что было в ней. В то время продуктивные методики протеинового фракционирования, такие, как замена заряда и сефадексовая хроматография, ещё не были разработаны. Очистка заключалась во фракционировании с солью в органическом растворителе при низкой температуре и элюировании из различных гелей, таких, как фосфат кальция. Я вспоминаю, сколько же клеток кишечной палочки мы потратили впустую, пока не научились проводить процедуру правильно. Затем мы изучали механизм, который включает в семя одновременное связывание донора фосфата и акцептора ферментом, следующее за заменой фосфата на фермент[22]. В механизм не вовлекался ни один фосфорилированный интермедиат, и механизм не сильно нас впечатлил, но тренировка в очистке и энзимологии была для нас полезна, а ферменты оказались нужны. По предложению Терри Стадтман, которая работала в лаборатории некоторое время, я разработала процедуру определения ацетата с использованием ацетокиназы, а Терри потом использовала этот метод для некоторых своих исследований[22].
Я с удовольствием вспоминаю тот период сотрудничества с Эрни Роуз. Мы успешно преодолели испытательный срок, и под Рождество Северо Очоа решил доверить нам «проект своей мечты» — окислительное фосфорилирование. Эрни Роуз решил исследовать его на крысиных митохондриях. Так как он был восхищён работой Пола Бойера и Милреда Кона по изотопному обмену 18О, он захотел применить метод для своего исследования. Я же не хотела убивать крыс и задумала изучать процесс на бактериях. Я решила, что, выбирая именно аэробные бактерии, как например, Azotobacter vinelandi, которые активно окисляют углеводы, я смогла бы лучше изолировать активную систему для синтеза ATP, совмещённого с окислением. Понимая, что было бы сложным выявить поглощение чистых PO4 в бактериальных экстрактах, загрязнённых фосфатами и различными реакциями, сопровождающимися их поглощением или выделением, я решила использовать реакцию обмена между PO4 и ATP (хорошо владея таковой после изучения ацетокиназы), как метода изоляции некоторых интересных новых фосфорилированных коэнзимов. Идея, кажущаяся теперь наивной, заключалась в том, что реакция, включающая растворимый коэнзим X, который бы фосфорилировался специфическим ферментом в течение синтеза ATP, была бы очень проста:
Разумеется, я наблюдала обмен между 32PO4 и двумя концевыми фосфат-группами ATP в растворе экстракта Azotobacter vinelandi и начала очистку белка, ответственного за обмен. В качестве субстрата я использовала продажный аморфный ATP. В течение этой работы, Сигма объявил об очень чистом кристаллическом производном ATP, которое они только что приготовили. Мне удалось получить немного этого вещества, и, к моему удивлению, я больше не наблюдала реакцию обмена с кристаллическим производным в присутствии частично очищенной мною фракции белка. Этот факт, однако, обрадовал нас с Северо Очоа, так как мы надеялись, что аморфный препарат содержит интересный кофактор. Я решила выделить фракцию из аморфного препарата, которая, при добавлении к кристаллическому ATP, возобновляла обмен. Каково же было моё удивление, когда хроматография идентифицировала это вещество как ADP. По сути, ATP был только меченый, так как аденилаткиназа всё ещё загрязняла белковую фракцию (известно, что очень сложно избавиться от следов аденилаткиназы). Я помнила об этом, когда рассказывала об этом открытии группе за ланчем. Никто мне не верил, и Северо Очоа задел меня, сказав, что это невозможно, однако, затем раскаялся в этом, и, придя в лабораторию, я легко смогла убедить его, что истинный субстрат в реакции обмена — ADP. Он был потрясён, так как никто не знал фермент, способный катализировать такой обмен, и одобрил моё стремление попытаться понять, что в этой реакции ответственно за него. Вскоре я обнаружила, что этот фермент не является специфическим для ADP, а катализирует обмен и с другими дифосфатными нуклеотидами (UDP, CDP, GDP и IDP).
Летом 1954 года Северо Очоа стал деканом Биохимического Факультета и переехал в новое здание через дорогу. Там было больше места, в подвале была опытная установка, управляемая Мортоном Шнайдером и Питером Лозиной; также там было удобнее работать с радиоактивными изотопами. Из группы ушли Сеймур Кауфман, Джо Штерн и Элис дель Кампильо, а Билл Якоби, Мартин Флавин и Чарльз Гилвард остались; новыми сотрудниками были Гегард Плаут и Энрико Кутоло. Здесь у нас было больше удобств для ланча, а также нас посещало большее количество людей. Настало ещё более деятельное и бодрое время. Но, после первого восторга от открытия новой реакции я провела несколько разочаровывающих надежды месяцев, пытаясь добиться хоть какого-либо прогресса. В течение этого времени Северо Очоа от всей души оказывал мне поддержку и одобрял меня в попытках дополнительно очистить фермент. Я проделала это, но всё равно не могла определить реакцию: это было, как если у вас есть белковый кристалл, но вы не можете опознать сам кристаллизующийся белок. Во время обмена выделялось немного фосфата, но это предписывалось остаткам загрязнения фосфатазой. Северо Очоа начинал впадать в уныние из-за того, что в это время Пинчот выделил различные фракции из Alcaligenes faecalis, которые, смешиваясь, катализировали поглощение чистых фосфатных групп, сопровождаемое электронным переносом. Он стал сомневаться в значении обмена и одобрил мою попытку воссоздать эксперимент Пинчота с экстрактом Azotobacter vinelandi. Я вспомнила, что Пинчот посещал нас и производил эксперименты в нашей лаборатории. Однако я не была готова к немедленному решению задачи. В особенности, я была в тупике из-за небольшого выделения фосфата, в то время как точно знала, что фермент хорошо очищен от фосфатазы, и решила выследить причину этого явления.
В это время Северо Очоа отправился в Европу (думаю, по делам, связанным с Международным биохимическим союзом). Я пообещала ему, что, если у меня не будет результатов до его возвращения, я снова начну искать небольшое выделение PO4 в экстрактах Azotobacter vinelandi. Я провела простой эксперимент, который стал решающим в открытии полинуклеотидфосфорилазы: заменила ADP инозиндифосфатом (IDP). Аденилаткиназа неактивна по отношению к производным инозина, и, таким образом, я избежала сложностей с моно- и трипроизводными, образуемыми аденилаткиназой, и построила кривую насыщенности. Дифосфаты были труднодоступными и дорогими веществами и я должна была оправдать использование такого количества их для эксперимента, казавшегося тривиальным. Однако, в состоянии насыщения (у полинуклеотидфосфорилазы низкое сродство к дифосфатным производным) я обнаружила значительное выделение фосфатных групп. Было утешением понять, что я имею дело не только с реакцией обмена, но и с реакцией, в ходе которого образуется PO4. Я тут же стала хроматографически идентифицировать другой продукт реакции. С этой стороны, реакция гидролиза дифосфата в монофосфат до сих пор представляет интерес. В то же самое время, на факультете работал Гегард Плаут, изучавший IDP-азу, которую выделял из митохондрий крысиной печени, однако реакция в моём случае выглядела обратимой, а обратимость гидролитических реакций казалась неправдоподобной. Хроматография реакционной смеси на Дауэксовой колонне показала образование IMP, что обрадовало меня, но, сначала, я не могла идентифицировать какие-либо новые продукты в элюате из колонны. Исходя из этого, синтезируемый фермент, возможно, был соединением, не элюировавшемся в условиях этого эксперимента. Я начала надеяться, до конца в это не веря, что продукт, засевший в колонне, мог быть высокомолекулярным соединением. К счастью, используя хроматографическую бумагу, я смогла идентифицировать свежее пятно ультрафиолета в реакционной смеси после ферментативной инкубации, исходящее не из начала хроматограммы и поняла, что образовавшийся фермент — полинуклеотид. Никогда я не забуду тот день, когда увидела новое пятно — меня настолько переполняли эмоции, что хотелось рассказать о событии всем, кто был в лаборатории, но, к моему разочарованию, как и в случае с Северо Очоа с конденсирующимся ферментом, там никого не оказалось — был какой-то праздник. Наконец, я позвонила Северо домой; он был изумлён случившимся. Он был, конечно же, доволен открытием, но, в глубине души, всё ещё надеялся, что синтезированный продукт имеет пирофосфатную связь и как-то связан с окислительным фосфорилированием. Это хорошо иллюстрирует то, как далеки от молекулярной биологии были интересы тогдашних энзимологов. Энзимология нуклеиновых кислот изучалась тогда в других местах небольшими группами, чаще всего, английскими (Маркэм, Пири, Калькар). Не думаю, что в первый год работы в Нью-Йорке слышала хоть раз слова «нуклеиновая кислота». Но вскоре, мы были шокированы открытием. Северо Очоа рассказал мне, что, проводя в Бесезде семинар по P-ферменту, в конце он кратко упомянул об открытии (мы ещё не поняли структуру полимера) и увидел, как сонный весь семинар Калькар вдруг, проснувшись, подскочил на стуле!
С помощью Леона Хеппеля, Жака Фреско и Алекса Рича результаты пришли скоро. Я смогла показать, что продукт осаждался кислотой (это был ещё один потрясающий момент: я увидела, как полимер образует твёрдый гель; по-моему, Жак Фреско был тогда рядом) и открыла, что полимер обладает высоким значением молекулярной массы, первое определение которой произвёл Алекс Рич. Вскоре я обнаружила, что полимер имеет две сложноэфирные группы. Леон Хеппель имел в своём распоряжении все ферменты, нужные для изучения структуры вещества, и, со свойственной ему щедростью, дал нам всё, что было необходимо[23]. Используя смесь аденозин-, уридин-, цитозин- и гуанозиндифосфатов, я смогла синтезировать РНК-подобный сополимер, в состав которого вошли четыре основания[24].
Мы обсуждали, как же назвать фермент. Северо Очоа надеялся, что in vivo он может участвовать в некоторых видах (возможно, в присутствии праймера) полинуклеотидного синтеза, и был склонен назвать его РНК-синтетазой. Я же, в свою очередь, считала, что фермент участвует в распаде РНК, и полагала, что правильнее было бы назвать его фосфорилазой. В конце концов, Северо сказал мне: «Марианна, так как я очень сильно тебя люблю, я принимаю твоё название».
Я представила работу на встрече Федерации обществ экспериментальной биологии в Сан-Франциско в 1955 году. Помню, что зал был довольно пуст до моего выступления и заполнился до отказа прямо перед ним (молва об открытие уже распространилась). Работа вызвала значительный интерес: это был первый случай внеклеточного синтеза РНК-подобного высокомолекулярного вещества. Открытие полинуклеотидфосфорилазы придало большой импульс исследованиям биохимиков во всём мире: я заставила их изучать не только промежуточный метаболизм и окислительное фосфорилирование, но и другие процессы. Это воодушевило их на исследования ферментов, таких, как РНК- и ДНК-полимеразы, ответственных за синтез нуклеиновых кислот. Биохимики стали интересоваться синтезом белков и нуклеиновых кислот. Это позволило лабораториям Пола Доти, Алекса Рича, Жака Фреско и Гэри Фельзенфельда исследовать структуру ДНК и РНК. Из-за низкой специфичности ферментов, с помощью них можно было синтезировать различные полимеры, что привело к модернизации методики синтеза лабораторией Доти. Во время моего открытия, структуру ДНК разъяснили Уотсон и Крик, но самое сильное его значение, пожалуй, было в использовании его в расшифровке генетического года (см. ниже). Для биохимиков настал новый период — период становления молекулярной биологии. Открытие было отмечено Нобелевской премией по медицине в 1959 году[25]. Приз был разделён с Артуром Корнбергом за его работу с ДНК-полимеразой. Северо Очоа предложил мне работу и посоветовал остаться в США, где у меня было больше возможностей, чем во Франции, приводя в пример свою карьеру, но мой муж и я, в конце концов, решили вернуться во Францию, особенно из-за того, что я ждала дочку.
Вернувшись, я работала над структурой фермента и его ролью in vivo. Это было сложнее, чем казалось вначале. Теперь, из исследований многих учёных, понятно, что он участвует в распаде мРНК, как удаляя информационную РНК, так и обеспечивая прекурсорами синтез РНК и ДНК. Я благодарна Северо Очоа за тот опыт, что получила, работая в его лаборатории, а также за ту атмосферу, царящую в ней, которую он смог создать. До сих пор у меня много друзей и знакомых учёных из его лаборатории, и все мы чувствуем себя частью семьи Северо Очоа.
Примечания
- https://sevilla.abc.es/sevilla/sevi-casi-siglos-formacion-cientifica-y-humanistica-instituto-san-isidoro-sevilla-201805130843_noticia.html
- Информация на сайте Нобелевского комитета (англ.)
- Biogr. Mems Fell. R. Soc. vol. 43 351—365. (1997)
- A MICRO METHOD FOR THE ESTIMATION OF TOTAL CREATININE IN MUSCLE
- (With J.G. Valdecasas) A micro-method for the estimation of creatinine in muscle J. Biol Chem. 81, 351—357. (1929)
- (With R.A. Peters) Vitamin B1 and carboxylase in animal tissures. Biochem. J. 32, 1501—1515.(1938)
- (With I. Banga & R.A. Peters) Pyruvate oxidation in brain. VII. Some dialysable components of the pyruvate oxidation system. Biochem. J. 33, 1980—1996. (1939)
- Coupling of phosphorylation with oxidation of pyruvic acid and brain. J. Biol Chem. 138, 751—773.(1941)
- Efficiency of aerobic phsophorylation in cell free extracts. J. Biol Chem. 151, 493—505.(1943)
- Biosynthesis of tricarboxylic acids by carbon dioxide fixation. III. Enzymatic mechanisms. J. Biol Chem. 174, 133—157.(1948)
- (With A.H. Mehler & A. Kornberg) Biosynthesis of dicarboxylic acids by carbon dioxide fixation. I. Isolation and properties of an enzyme from pigeon liver cayalyzing the reversible oxidative decarboxylation of I-malic acid. J. Biol Chem. 174, 979—1000.
- (With W. Vishniac) Photochemical reduction of pyridine nucleotides by spinach grana and coupled carbon dioxide fixation. Nature 167, 768—769 (1951)
- (With J.R. Stern & M.C. Schneider) Enzymatic synthesis of citric acid. II. Crystalline condensing enzyme. J. Biol. Chem. 193, 691—702
- (With J.R. Stern & E Lynen,) Enzymatic synthesis of citric acid. V. Reaction of acetyl coenzyme A. J. Biol. Chem. 198, 313—321 (1952)
- (With S. Korke & A. del Campillo) Biosynthesis of dicarboxylie acids by carbon dioxide fixation IV. Isolation and properties of an adaptative malic enzyme from Lactobacillus arabinosus. J. Biol Chem. 187, 891—905. (1950)
- Stern, J.R., Coon, M.J., del Campillo, A. & Schneider, M.C. 1956 Enzymes of fatty ecid metabolism. IV. Preparation and properties of coenzyme a transferase. J. Biol. Chem. 221, 15-31
- (With M. Flavin) Metabolism of propionic acid in animal tissues. I. Enzymatic conversion of propionate to succinate. J. Biol. Chem. 229, 965—979 (1957)
- (With M. Flavin & H. Castro-Mendoza) Metabolism of propionic acid in animal tissues. II. Propionyl coenzyme A carboxylation system. J. Biol. Chem. 229, 981—996
- (With Y. Kaziro & E. Leone) Biotin and propionyl carboxylase. Proc. Natn. Acad. Sci. U.S.A. 46, 1319—1327. (1960)
- (With S. Kaufman, C. Gilvarg & O. Cori) Enzymatic oxidation of a-ketoglutarate and couple phosphorylation. J. Biol. Chem. 203, 869—888. (1953)
- Kaufman, S. Studies on the mechanism of the reaction catalyzed by the phosphorylating enzyme. J. Biol. Chem. 216, 153—164. (1955)
- (With I.A. Rose, M. Grunberg-Manago & S.R. Korey) Enzymatic phosphorylation of acetate. J. Biol. Chem. 211, 737—756. (1954)
- (With M. Grunberg-Manago) Enzymatic synthesis and breakdown of polynucleotides; polynucleotide phosphorylase. J. Am. Chem. Soc. 77, 3165-3166. (1955)
- (With M. Grunberg-Manago & P.J. Ortiz) Enzymatic synthesis of polynucleotides. I. Polynucleotide phosphorylase of Azotobacter vinalandii. Biochim. Biophys. Acta 20, 269—285. (1956)
- Nobel Lectures 1959. Stockholm, pp. 146—164.
- (With P. Lengyel & J.F. Speyer) Synthetic polynucleotides and the amino-acid code.Proc. Natn. Acad. Sci. U.S.A. 47, 1936—1942.
- Lengyel, P. 1962 The use of synthetic polynucleotides in the deciphering of the genetic code. Ph.D thesis. New York University. J. Biol Chem. 216, 153—164.
- (With M. Salas, M.A Smith, W.M. Stanley Jr & A.J. Wahba) Direction of reading of the genetic message. J. Biol Chem. 240, 3988-3995. (1965)
- (With M.A. Smith, M. Salas, W.M. Stanley Jr & A.J. Whaba) Direction of reading of the genetic message. Proc. Natn. Acad.Sci. U.S.A. 55, 141—147
- (With J.A. Last, W.M. Stanley Jr., M. Salas, M.B. Hille & A.J. Wahba) Translation of the genetic message, IV UAA as a chain termination codon. Proc. Natn. Acad. Sci U.S.A. 57, 1062—1067
- (With W.M. Stanley Jr, M. Salas & A.J. Wahba) Tranlation of the generic message : Factors involved in the initiation of protein synthesis. Proc. Natn. Acad. Sci. U.S.A. 56, 290—295. (1966)
- (With M. Salas, M.B. Hille, J.A. Last & A.J. Wahba) Translation of the genetic code message. II. Effect fo initiation factors on the binding of formyl-methionyl-tRNA to ribosomes.Proc. Natn. Acad.Sci U.S.A. 57, 387—394. (1967)
- (With K. Iawasaki, S. Sabo & A.J. Wahba) Translation of the genetic message. VII. Role of initiation factors in formation of the chain initiations complex with Escherichia coli ribosomes. Archs Biochem. Biophys. 125, 542—547. (1968)
- (With M. Zasloff) Polypeptide chain initiation in Eukaryotes. IV. Purification and properties of supernatant initiation factor from Artemia salina embryos. J. Mol. Biol. 73, 65-76. (1973)
- (With C. de Haro) Further studies on the mode of action of the heme-contolled translational inhibitor. Proc. Natn. Acad. Sci U.S.A. 76,1741-1745. (1979)
- (With A. Datta, C. de Haro & J.M. Sierra) Mechanism of translational control by hemin in reticulotcyte lysates. Proc. Natn. Acad. Sci .U.S.A. 74, 3326-3329. (1977)
- Weismann, C. 1976 In Reflections on biochemistry (ed. A. Kornberg, B.L. Horecker, L. Cornudella & J. Oro), pp. 283—292. New York: Pergamon.
- The pursuit of a hobby. Л. Rev. Biochem., 491—530. (1980)