16S рРНК
16S рРНК — один из трёх основных типов рРНК, образующих основу рибосом прокариот. Цифры в названии рРНК равны значению константы седиментации. Соответственно, для данной молекулы это значение равно 16S (единиц Сведберга). Всего в прокариотических микроорганизмах обнаружено три типа рРНК: 23S и 5S в большой субъединице рибосомы (50S), 16S в малой субъединице рибосомы (30S). Аналогично, константы двух других молекул рРНК равны 23 и 5 S соответственно. Эукариотическим аналогом 16S рРНК является 18S рРНК[1].
К настоящему времени изучены последовательности нуклеотидов в 16S рРНК и 18S рРНК для более чем 400 видов из разных царств живой природы. Последовательность гена 16S рРНК главным образом используется в исследовании филогенетики бактерий и архей. С 2010 года был запущен проект «Микробиом Земли», объединяющий исследования по этой теме. Также последовательность гена 16S рРНК применяется для медицинских исследований патогенных бактерий.
История открытия
Впервые 16S рРНК была выделена Айзенбергом и Литауром в 1959 г в ходе проведения экспериментов по выделению и изучению физических свойств РНК Escherichia coli. На основании сравнения вязкости растворов РНК и ДНК они предположили, что РНК является одноцепочечной молекулой. При разделении молекул РНК, выделенных из клеток бактерий, были обнаружены две фракции РНК, различающиеся по значениям коэффициентов седиментации. Для более лёгкой фракции коэффициент был равен 16S, а для более тяжёлой — 25S[2].
Далее в 1960-х годах А. Белозёрским и А. Спириным было установлено, что на долю рРНК приходится 80—90 % всей РНК клетки. Также они впервые описали разницу в строении и составе рРНК в прокариотических и эукариотитиеских организмах. Обнаружение в митохондриях и хлоропластах рибосом и рРНК прокариотического типа стало одним из доказательств теории симбиогенеза[3][4][5].
Структура
Первичная структура
Первичная структура 16S рРНК представлена одноцепочечной последовательностью, состоящей из 1600 рибонуклеотидов. На протяжении всей последовательности равномерно расположены консервативные для многих видов и гипервариабельные участки. Консервативными называются участки, последовательности которых различаются незначительно или вообще не различаются у рассматриваемых организмов. Гипервариабельными называют те участки, последовательности которых сильно различаются у далёких организмов, но у близкородственных имеют некоторый процент сходства[6][7].
Ген 16S рРНК содержит девять гипервариабельных участков, обозначаемых V1 — V9. Каждый участок имеет длину от 30 до 100 пар оснований. Эти участки вовлечены в образование вторичной структуры малой субъединицы рибосомы. Между гипервариабельными областями ген 16S рРНК содержит высоко консервативные последовательности. Степень консервативности гипервариабельных участков не одинакова — показано, что последовательности более консервативных участков сходны у организмов на уровне таксонов высоких рангов, а менее консервативные — на уровне низких таксономических рангов таких, как роды и виды[8][9].
Вторичная структура
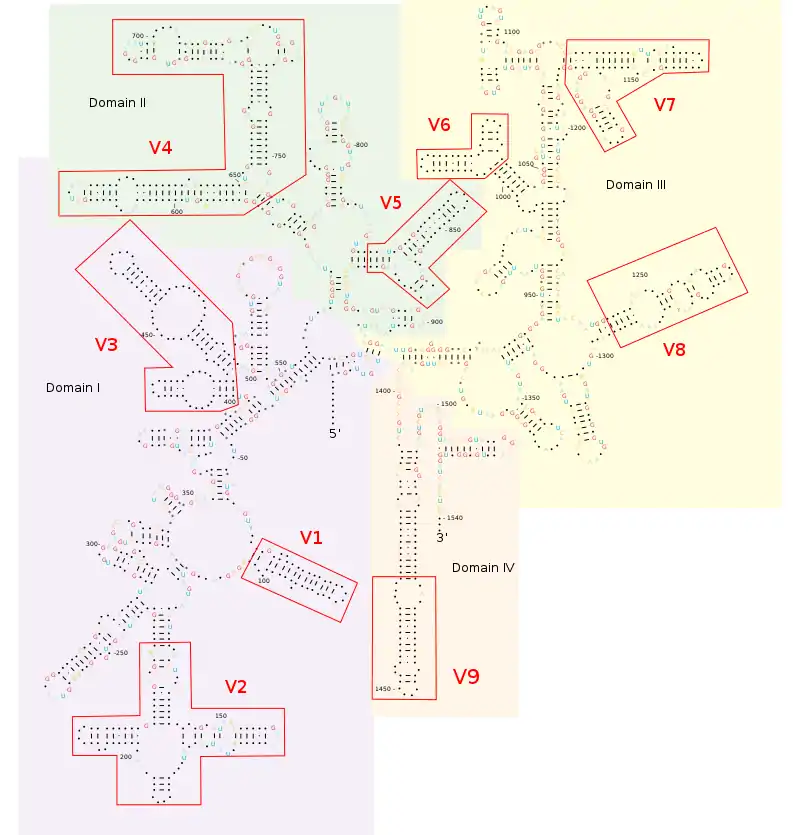
Во вторичной структуре 16S рРНК можно выделить 4 хорошо различимых домена (подобно домену белка, домен РНК является стабильной, самостоятельно собирающейся структурой молекулы): 5′-домен (остатки 1—556), центральный (остатки 564—912) и два домена на 3′-конце (большой домен 926—1391 и малый домен 1392—1542). Различные домены отделены друг от друга с помощью спиралей, которые на конце имеют РНК-шпильки. Также вторичная структура 16S рРНК содержит 5′- и 3′-неспаренные основания, которые образуют петли. Предполагается, что эти основания могут участвовать в формировании третичной структуры 16S рРНК, соединяясь с помощью водородных связей не по каноническому Уотсон-Криковскому связыванию оснований[11].
Функции 16S РНК
Для 16S рРНК описаны следующие функции:
- Как и 23S рРНК, 16S рРНК играет структурную роль, выступая в качестве каркаса, определяющего положение рибосомальных белков;
- 3′-конец содержит последовательность анти-Шайна-Дальгарно, с помощью которой 16S рРНК связывается с мРНК;
- 3′-конец связывается с факторами, участвующими в инициации трансляции (S1 и S21)[12];
- 16S рРНК взаимодействует с 23S рРНК, способствуя связыванию большой и малой рибосомальных субъединиц (50S и 30S);
- Стабилизирует правильное спаривание кодона и антикодона в А-сайте большой субъединицы рибосомы, посредством образования водородной связи между атомом азота (N1) 1492 или 1493 остатка аденина и группой 2’OH основной цепи мРНК[11].
Биосинтез 16S рРНК
Все три прокариотические гена рРНК (16S, 23S и 5S) находятся в ко-транскрибируемом опероне и разделены генами тРНК и спейсерными последовательностями. Во время процессинга первичного транскрипта, осуществляемого эндонуклеазами, удаляются спейсерные последовательности и в качестве продукта появляются интермедиаты, а в конечном итоге созревшие РНК[13].
16S рРНК является компонентом малой субъединицы рибосомы и играет важную роль в декодировании мРНК. Предшественником рРНК является 17S рРНК, которая высвобождается из первичного транскрипта нуклеазой РНКазой III. Дальнейший процессинг 5′-конца осуществляется РНКазами E и G. Как происходит процессинг 3′-конца, на данный момент остаётся неясно[13].
Применение 16S рРНК
Филогенетические исследования
Последовательность 16S рРНК представлена девятью гипервариабельными участками и разделяющими их консервативными последовательностями. Благодаря этим особенностям первичной структуры было предложено использовать ген 16S рРНК для филогенетических исследований. Первым учёным, применившим 16S рРНК для установления родственных связей между группами бактерий, был Карл Вёзе. Он предположил, что ген 16S рРНК может быть использован в качестве надёжных молекулярных часов, так как было установлено, что 16S рРНК из эволюционно далёких видов бактерий имеют сходные участки последовательности и функции[14][1][15].
Итак, гипервариабельные области позволяют отличать разные виды друг от друга, а наличие высоко консервативных участков позволяет создавать универсальные праймеры, которые можно применять для исследования бактерий и архей, вне зависимости от их таксономической принадлежности. Первая пара универсальных праймеров, получившая широкое распространение, разработана Вайзбургом и др.[14]
Стоит также отметить, что выбранная область отжига праймеров настолько консервативна, что универсальные праймеры можно использовать для амплификации 16S рРНК митохондрий и хлоропластов — потомков альфа-протеобактерий и цианобактерий соответственно[16].
Методы секвенирования с универсальными праймерами применяются в медицинской микробиологии как быстрая и дешёвая альтернатива морфологическому способу идентификации бактерий, который требует большого числа манипуляций, в том числе нередко необходимо продолжительное время культивировать потенциальный патоген в лабораторных условиях. Кроме того секвенирование даёт более надёжные результаты[17]. В этой отрасли применяются определённые гипервариабельные участки: например, участок V3 лучше всего показывает себя при идентификации родов патогенов, а V6 для идентификации видов[18].
Микробиом Земли
В 2010 году был запущен проект «Микробиом Земли», который поставил перед собой амбициозную задачу — создание глобального каталога биоразнообразия некультивируемых микроорганизмов нашей планеты, то есть таких, которые трудно выращиваются и поддерживаются в лабораторных условиях. В ходе данного широкомасштабного исследования планируется проанализировать микробные сообщества из более чем 200 000 проб окружающей среды, предоставленных лабораториями со всего мира. Для определения таксономической принадлежности микроорганизмов в образцах используют последовательности генов 16S рРНК. Из собранных образцов выделяют ДНК, а затем проводится ПЦР с праймерами на 16S рРНК. Полученные в ходе ПЦР ампликоны секвенируют. В подобного рода исследованиях могут использоваться технологии секвенирования Illumina, Ion Torrent, возможно использование и других платформ. Как правило, полные последовательности интересующих гипервариабельных участков могут быть получены после одного акта секвенирования[19]. В рамках проекта на данный момент проанализировано более 30 000 образцов[20].
В таких исследованиях с особой тщательностью подходят к выбору праймеров и амплифицируемого фрагмента. Основными критериями являются полный охват исследуемых организмов (в данном случае это археи и бактерии) и филогенетическая разрешающая способность последовательности, то есть то, насколько детально возможно определить таксономическую принадлежность организма по последовательности[21].
В проекте «Микробиом Земли» для классификации микроорганизмов используют гипервариабельные области V4 и V4-V5, так как эти участки считаются оптимальными для классификации микробных сообществ. Праймеры для ПЦР этих фрагментов представляют собой улучшенный вариант использовавшихся ранее праймеров 515F, 907R и 806R. Улучшение старой версии праймеров потребовалось для возможности получения ампликонов большей длины, что позволило лучше определять организмы из групп Crenarachaeota/Thaumarchaeota, точную классификацию которых ранее определить не удавалось[22][23].
| Амплифицируемая область | Название праймера | Последовательность праймера (5′-3′) |
|---|---|---|
| V4 | 515F | GTG YCA GCM GCC GCG GTA A |
| V4[24] | 806R | GGA CTA CHV GGG TWT CTA AT |
| V4-V5 | 515F | GTG YCA GCM GCC GCG GTA A |
| V4-V5 | 926R | CCG YCA ATT YMT TTR AGT TT |
| V4-V5[23] | 907R | CCG TCA ATT CCT TTG AGT TT |
Реклассификация на основе 16S рРНК
С накоплением большого числа данных было обнаружено, что некоторые виды бактерий были неверно классифицированы по морфологическим признакам. На основании секвенирования 16S рРНК были выделены новые виды, в том числе те, которые не удавалось культивировать в лабораторных условиях[25][26], и даже роды[27]. С появлением секвенирования третьего поколения во многих лабораториях стала возможна одновременная идентификация тысяч последовательностей 16S рРНК в течение нескольких часов, что позволяет проводить метагеномные исследования, например, исследования микрофлоры кишечника[28].
Ограничения использования гена 16S рРНК для филогенетических исследований
Наравне с множеством плюсов, которые имеет описанный метод установление родственных связей между группами организмов (универсальность использования и относительная быстрота выполнения), есть и минусы. В частности, гипервариабельные участки почти не справляются с распознаванием близкородственных видов. Например, последовательности гена 16S рРНК у представителей семейств Enterobacteriaceae, Clostridiaceae и Peptostreptococcaceae схожи на 99 %. То есть гипервариабельный участок V4 может различаться всего на несколько нуклеотидов, что делает невозможным достоверное различие таксонов бактерий низкого ранга. Если ограничивать исследование таксономии бактерий анализом гипервариабельных участков 16S рРНК, можно ошибочно объединить близкородственные группы в один таксон и недооценить разнообразие исследуемой группы бактерий[29][30].
Более того, бактериальный геном может содержать несколько генов 16S рРНК, гипервариабельные участки V1, V2 и V6 которых представляют наибольшее внутривидовое разнообразие. Будучи не самым точным методом классификации видов бактерий, анализ гипервариабельных участков остаётся одним из самых используемых методов, применимым к исследованию бактериальных сообществ[31].
В свете допущения, что эволюцией движет вертикальный перенос генетического материала от предков к потомкам, гены 16S рРНК долгое время считались видоспецифичными и оттого весьма точными маркерами для определения родства между группами прокариот. Однако возрастающее число наблюдений позволяют предположить возможность горизонтального переноса этих генов. В дополнение к наблюдениям горизонтального переноса генов в природе были представлены экспериментальные доказательства этих событий. В исследовании использовался мутантный штамм Escherichia coli, лишённый собственного гена 16S рРНК. Однако наблюдалась сборка функциональной рибосомы с использованием 16S рРНК, заимствованной от неродственной E. coli бактерии[32][15]. Подобная функциональная совместимость также наблюдалась у Thermus thermophilus. Более того, у T. thermophilus наблюдался как полный, так и частичный перенос гена. Частичный перенос выражался в спонтанном образовании, по-видимому, случайной химерной последовательности между геном бактерии-хозяина и чужеродным геном[33].
Итак, ген 16S рРНК мог эволюционировать несколькими путями, включая вертикальный и горизонтальный перенос генов. Частота последнего варианта может быть значительно выше, чем считалось ранее.
Базы данных 16S рРНК
Полные последовательности генов 16S рРНК, как и многих других, собирают из чтений — определённых нуклеотидных последовательностей, полученных после секвенирования. Секвенирование проводится на платформе Illumina (длина чтений достигает 250 пар оснований); с использованием технологии секвенирования по Сэнгеру (длина чтений — до 1000 пар оснований); с использованием ионного полупроводникового секвенирования (длина чтений — до 200 пар оснований). Далее чтения сопоставляются с референсной последовательностью гена 16S рРНК, таким образом из множества чтений собирается полная последовательность гена.
Последовательности генов 16S рРНК определены для типовых штаммов бактерий и архей и собраны в открытые базы данных, таких как NCBI. Тем не менее, качество отсеквенированных последовательностей, содержащихся в подобных базах данных, часто не проверяется. В результате этого широко используются вторичные базы данных, содержащие только последовательности генов 16S рРНК[34]. Наиболее часто используемые базы данных перечислены ниже.
EzBioCloud
База данных EzBioCloud, ранее известная как EzTaxon, состоит из полной иерархической таксономической системы, содержащей 65 342 последовательности 16S рРНК бактерий и архей на февраль 2020. База данных EzBioCloud систематически курируется и регулярно обновляется. Кроме того, веб-сайт базы данных предоставляет биоинформатические инструменты, такие как калькулятор ANI, для выявления процента сходства двух последовательностей прокариотических геномов, инструмент для парного выравнивания двух последовательностей и многие другие[35].
Ribosomal Database Project (RDP)
RDP — это курируемая база данных, предоставляющая информацию по последовательностям рРНК и сопутствующие программы и сервисы. Предлагаемый контент включает сгруппированные на основе филогении выравнивания рРНК, полученные на основе выравниваний филогенетические деревья, вторичные структуры рРНК и различные программы для визуализации и анализа информации для исследований генов рРНК. Большинство пакетов программ доступно для скачивания и локального использования[36].
SILVA
SILVA является базой данных, содержащей проверяемый вручную и регулярно обновляемый набор выравниваний последовательностей рРНК малых субъединиц рибосом (16S/18S) и больших субъединиц рибосом (23S/28S), относящимся ко всем трём доменам жизни. Также на основе базы данных создан сервис для дизайна праймеров и построения филогенетических выравниваний[37].
Примечания
- Woese C. R., Fox G. E. Phylogenetic structure of the prokaryotic domain: the primary kingdoms. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 1977. — November (vol. 74, no. 11). — P. 5088—5090. — PMID 270744.
- Littauer, U. Z., Eisenberg, H. Biochimica et Biophysica Acta. — 1959. — С. 320—337.
- А. С. Спирин. Биоорганическая химия. — М.: Высшая школа, 1986. — С. 10.
- А. С. Спирин. Принципы структуры рибосом. — 1998. — С. 65—70.
- James Frederick Bonner. Plant Biochemistry. — 1976. — С. 18—19.
- Yarza P., Yilmaz P., Pruesse E., Glöckner F. O., Ludwig W., Schleifer K. H., Whitman W. B., Euzéby J., Amann R., Rosselló-Móra R. Uniting the classification of cultured and uncultured bacteria and archaea using 16S rRNA gene sequences. (англ.) // Nature Reviews. Microbiology. — 2014. — September (vol. 12, no. 9). — P. 635—645. — doi:10.1038/nrmicro3330. — PMID 25118885.
- Mitreva Makedonka. The Microbiome in Infectious Diseases (англ.) // Infectious Diseases. — 2017. — P. 68—74.e2. — ISBN 9780702062858. — doi:10.1016/B978-0-7020-6285-8.00008-3.
- Yang B., Wang Y., Qian P. Y. Sensitivity and correlation of hypervariable regions in 16S rRNA genes in phylogenetic analysis. (англ.) // BMC Bioinformatics. — 2016. — 22 March (vol. 17). — P. 135—135. — doi:10.1186/s12859-016-0992-y. — PMID 27000765.
- Gray M. W., Sankoff D., Cedergren R. J. On the evolutionary descent of organisms and organelles: a global phylogeny based on a highly conserved structural core in small subunit ribosomal RNA. (англ.) // Nucleic Acids Research. — 1984. — 25 July (vol. 12, no. 14). — P. 5837—5852. — doi:10.1093/nar/12.14.5837. — PMID 6462918.
- Van de Peer Y., Chapelle S., De Wachter R. A quantitative map of nucleotide substitution rates in bacterial rRNA. (англ.) // Nucleic Acids Research. — 1996. — 1 September (vol. 24, no. 17). — P. 3381—3391. — doi:10.1093/nar/24.17.3381. — PMID 8811093.
- Noller H. F., Woese C. R. Secondary structure of 16S ribosomal RNA. (англ.) // Science (New York, N.Y.). — 1981. — 24 April (vol. 212, no. 4493). — P. 403—411. — doi:10.1126/science.6163215. — PMID 6163215.
- Czernilofsky A. P., Kurland C. G., Stöffler G. 30S ribosomal proteins associated with the 3'-terminus of 16S RNA. (англ.) // FEBS Letters. — 1975. — 15 October (vol. 58, no. 1). — P. 281—284. — doi:10.1016/0014-5793(75)80279-1. — PMID 1225593.
- Smith B. A., Gupta N., Denny K., Culver G. M. Characterization of 16S rRNA Processing with Pre-30S Subunit Assembly Intermediates from E. coli. (англ.) // Journal Of Molecular Biology. — 2018. — 8 June (vol. 430, no. 12). — P. 1745—1759. — doi:10.1016/j.jmb.2018.04.009. — PMID 29660326.
- Weisburg W. G., Barns S. M., Pelletier D. A., Lane D. J. 16S ribosomal DNA amplification for phylogenetic study. (англ.) // Journal Of Bacteriology. — 1991. — January (vol. 173, no. 2). — P. 697—703. — doi:10.1128/jb.173.2.697-703.1991. — PMID 1987160.
- Tsukuda M., Kitahara K., Miyazaki K. Comparative RNA function analysis reveals high functional similarity between distantly related bacterial 16 S rRNAs. (англ.) // Scientific Reports. — 2017. — 30 August (vol. 7, no. 1). — P. 9993—9993. — doi:10.1038/s41598-017-10214-3. — PMID 28855596.
- Jay Z. J., Inskeep W. P. The distribution, diversity, and importance of 16S rRNA gene introns in the order Thermoproteales. (англ.) // Biology Direct. — 2015. — 9 July (vol. 10). — P. 35—35. — doi:10.1186/s13062-015-0065-6. — PMID 26156036.
- Clarridge J. E. Impact of 16S rRNA gene sequence analysis for identification of bacteria on clinical microbiology and infectious diseases (англ.) // Clinical Microbiology Reviews : journal. — 2004. — October (vol. 17, no. 4). — P. 840–62, table of contents. — doi:10.1128/CMR.17.4.840-862.2004. — PMID 15489351.
- Chakravorty S., Helb D., Burday M., Connell N., Alland D. A detailed analysis of 16S ribosomal RNA gene segments for the diagnosis of pathogenic bacteria (англ.) // Journal of Microbiological Methods : journal. — 2007. — May (vol. 69, no. 2). — P. 330—339. — doi:10.1016/j.mimet.2007.02.005. — PMID 17391789.
- Burke C. M., Darling A. E. A method for high precision sequencing of near full-length 16S rRNA genes on an Illumina MiSeq (англ.) // PeerJ : journal. — 2016. — 20 September (vol. 4). — P. e2492. — doi:10.7717/peerj.2492. — PMID 27688981.
- Gilbert J. A., Jansson J. K., Knight R. Earth Microbiome Project and Global Systems Biology. (англ.) // MSystems. — 2018. — May (vol. 3, no. 3). — doi:10.1128/mSystems.00217-17. — PMID 29657969.
- Parada A. E., Needham D. M., Fuhrman J. A. Every base matters: assessing small subunit rRNA primers for marine microbiomes with mock communities, time series and global field samples. (англ.) // Environmental Microbiology. — 2016. — May (vol. 18, no. 5). — P. 1403—1414. — doi:10.1111/1462-2920.13023. — PMID 26271760.
- 16S Illumina Amplicon Protocol (недоступная ссылка). Earth Microbiome Project. Дата обращения: 26 марта 2020. Архивировано 26 марта 2020 года.
- Caporaso J. G., Lauber C. L., Walters W. A., Berg-Lyons D., Lozupone C. A., Turnbaugh P. J., Fierer N., Knight R. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2011. — 15 March (vol. 108 Suppl 1). — P. 4516—4522. — doi:10.1073/pnas.1000080107. — PMID 20534432.
- Yang B., Wang Y., Qian P. Y. Sensitivity and correlation of hypervariable regions in 16S rRNA genes in phylogenetic analysis (англ.) // BMC Bioinformatics : journal. — 2016. — March (vol. 17, no. 1). — P. 135. — doi:10.1186/s12859-016-0992-y. — PMID 27000765.
- Schmidt T. M., Relman D. A. Phylogenetic identification of uncultured pathogens using ribosomal RNA sequences (англ.). — 1994. — Vol. 235. — P. 205–222. — (Methods in Enzymology). — ISBN 978-0-12-182136-4. — doi:10.1016/0076-6879(94)35142-2.
- Gray J. P., Herwig R. P. Phylogenetic analysis of the bacterial communities in marine sediments (англ.) // Applied and Environmental Microbiology : journal. — 1996. — November (vol. 62, no. 11). — P. 4049—4059. — PMID 8899989.
- Brett P. J., DeShazer D., Woods D. E. Burkholderia thailandensis sp. nov., a Burkholderia pseudomallei-like species (англ.) // International Journal of Systematic Bacteriology : journal. — 1998. — January (vol. 48 Pt 1, no. 1). — P. 317—320. — doi:10.1099/00207713-48-1-317. — PMID 9542103.
- Sanschagrin S., Yergeau E. Next-generation sequencing of 16S ribosomal RNA gene amplicons (англ.) // Journal of Visualized Experiments : journal. — 2014. — August (no. 90). — doi:10.3791/51709. — PMID 25226019.
- Vetrovsky T., Baldrian P. The variability of the 16S rRNA gene in bacterial genomes and its consequences for bacterial community analyses (англ.) // PLOS ONE : journal. — 2013. — 27 February (vol. 8, no. 2). — P. e57923. — doi:10.1371/journal.pone.0057923. — . — PMID 23460914.
- Jovel J., Patterson J., Wang W., Hotte N., O'Keefe S., Mitchel T., Perry T., Kao D., Mason A. L., Madsen K. L., Wong G. K. Characterization of the Gut Microbiome Using 16S or Shotgun Metagenomics (англ.) // Frontiers in Microbiology : journal. — 2016. — 1 January (vol. 7). — P. 459. — doi:10.3389/fmicb.2016.00459. — PMID 27148170.
- Coenye T., Vandamme P. Intragenomic heterogeneity between multiple 16S ribosomal RNA operons in sequenced bacterial genomes (англ.) // FEMS Microbiology Letters : journal. — 2003. — November (vol. 228, no. 1). — P. 45—9. — doi:10.1016/S0378-1097(03)00717-1. — PMID 14612235.
- Kitahara K., Yasutake Y., Miyazaki K. Mutational robustness of 16S ribosomal RNA, shown by experimental horizontal gene transfer in Escherichia coli. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2012. — 20 November (vol. 109, no. 47). — P. 19220—19225. — doi:10.1073/pnas.1213609109. — PMID 23112186.
- Miyazaki K., Tomariguchi N. Occurrence of randomly recombined functional 16S rRNA genes in Thermus thermophilus suggests genetic interoperability and promiscuity of bacterial 16S rRNAs. (англ.) // Scientific Reports. — 2019. — 2 August (vol. 9, no. 1). — P. 11233—11233. — doi:10.1038/s41598-019-47807-z. — PMID 31375780.
- Park S. C., Won S. Evaluation of 16S rRNA Databases for Taxonomic Assignments Using Mock Community. (англ.) // Genomics & Informatics. — 2018. — December (vol. 16, no. 4). — P. e24—24. — doi:10.5808/GI.2018.16.4.e24. — PMID 30602085.
- Yoon S. H., Ha S. M., Kwon S., Lim J., Kim Y., Seo H., Chun J. Introducing EzBioCloud: a taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies. (англ.) // International Journal Of Systematic And Evolutionary Microbiology. — 2017. — May (vol. 67, no. 5). — P. 1613—1617. — doi:10.1099/ijsem.0.001755. — PMID 28005526.
- Cole J. R., Wang Q., Fish J. A., Chai B., McGarrell D. M., Sun Y., Brown C. T., Porras-Alfaro A., Kuske C. R., Tiedje J. M. Ribosomal Database Project: data and tools for high throughput rRNA analysis. (англ.) // Nucleic Acids Research. — 2014. — January (vol. 42). — P. D633—642. — doi:10.1093/nar/gkt1244. — PMID 24288368.
- Pruesse E., Quast C., Knittel K., Fuchs B. M., Ludwig W., Peplies J., Glöckner F. O. SILVA: a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB. (англ.) // Nucleic Acids Research. — 2007. — Vol. 35, no. 21. — P. 7188—7196. — doi:10.1093/nar/gkm864. — PMID 17947321.
Литература
- Gutell R. R., Larsen N., Woese C. R. Lessons from an evolving rRNA: 16S and 23S rRNA structures from a comparative perspective. (англ.) // Microbiological Reviews. — 1994. — March (vol. 58, no. 1). — P. 10—26. — PMID 8177168.
