Кольцевые РНК
Кольцевы́е РНК (англ. Circular RNA, circRNA) — тип молекул РНК, концы которых замкнуты друг на друга с помощью ковалентной связи между концевыми нуклеотидами. Кольцевые РНК могут образовываться из интронов или в результате выпетливания различных участков созревающего транскрипта. Хотя кольцевые РНК обычно относят к числу некодирующих РНК, в настоящее время накапливаются свидетельства того, что они могут кодировать пептиды[1]. Конкретные функции кольцевых РНК до конца не изучены, но, вероятно, они задействованы в регуляции экспрессии генов. Кольцевых РНК особенно много в головном мозге, они свободно циркулируют в плазме крови. Возможно, в будущем кольцевые РНК будут использовать в качестве биомаркеров различных видов рака.
Биогенез
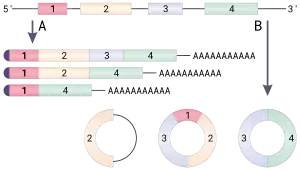
Теоретически кольцевую РНК можно получить тремя разными способами. Во-первых, в ходе сплайсинга интроны удаляются из созревающего транскрипта не в виде линейного фрагмента, а в виде лассо. Если от этого лассо отрезать «хвост», то получится кольцевая РНК. Такие интронные кольцевые молекулы накапливаются преимущественно в ядре и обозначаются ciRNA (от англ. circular intronic long non-coding RNAs). Во-вторых, в созревающем транскрипте отдельные экзоны могут выпетливаться, и такие петли могут вырезаться сплайсосомой и ковалентно замыкаться в кольцо. Так образуются кольцевые РНК, состоящие только из одного экзона. Кольцевые РНК, которые состоят исключительно из экзонов — одного или нескольких, объединяют в группу ecircRNA (от англ. exonic circRNAs) и обычно находят в цитоплазме. В-третьих, выпетливаться может участок, содержащий несколько интронов и экзонов. При вырезании и замыкании сплайсосомой такой петли формируются кольцевые РНК, содержащие и экзоны, и интроны. Они локализуются преимущественно в ядре и обозначаются EIciRNA (от англ. exon-intron circRNAs). Эти молекулы могут продолжить сплайсироваться, и после удаления интронов из них получатся кольцевые РНК, состоящие из нескольких экзонов[2].
Процесс вырезания сплайсосомой выпетливающихся участков транскрипта называется бэксплайсингом (англ. backsplicing). Зачастую интроны, окружающие один экзон, содержат комплементарные друг другу инвертированные повторы, которые, образуя водородные связи, формируют «стебелёк» петли. Выпетливание может происходить при участии специальных белков: два мономера такого белка связываются с двумя концами будущей петли, димеризуются и сближают концы так, что сплайсосома может ковалентно сшить их. Пока известны три белка, регулирующих образование некоторых кольцевых РНК: Quaking (QKI), Muscleblind (Mbl/MBNL1—3) и Fusedinsarcoma (FUS). Так, Muscleblind регулирует образование circRNA своего же гена, связываясь с особыми участками в интронах незрелого транскрипта. Кроме того, образование кольцевых РНК зависит от белков, которые связываются с незрелой мРНК в сайтах вырезания кольцевых РНК, делая их недоступными для сплайсосомы. Обобщая, можно сказать, что биогенез кольцевых РНК — это сложный процесс, регулируемый комбинацией многих факторов, в том числе расположением инвертированных повторов и взаимодействием с белками, которые опосредуют выпетливание или, напротив, делают бэксплайсинг невозможным[2].
Интересно, что у некоторых архей образование рРНК протекает через стадию кольцевой молекулы-предшественницы, которая далее нарезается на отдельные рРНК[3].
Численность
Уровень синтеза кольцевых РНК варьирует в зависимости от типа клеток. В среднем соответствующие кольцевые РНК выявляются для 5—20 % активных генов, и в отдельной клетке одновременно содержится 5000—25 000 circRNA. Однако на их долю приходится совсем небольшая часть транскриптома: за редким исключением circRNA составляют 5—10 % от количества линейных матричных РНК, синтезируемых с того же гена. С одного гена, как правило, транскрибируется несколько изоформ кольцевых РНК, причём чаще всего в состав circRNA входит второй экзон гена, а первый и последний экзоны в кольцевой форме почти никогда не остаются. Образование той или иной изоформы может регулироваться. Уровень синтеза кольцевых РНК в целом сильно меняется в ходе дифференцировки клеток, однако для его существенного изменения обычно требуется несколько дней или даже недель[2].
Кругооборот
Лишённые свободных концов, кольцевые РНК не могут быть разрушены ферментами экзонуклеазами, которые разрушают многие транскрипты упорным отщеплением концевых нуклеотидов. В связи с этим средняя кольцевая РНК более стабильна, чем линейная мРНК: circRNA живёт 19—24 часа (иногда до 48 часов), что в 2—5 (до 10) раз превышает срок жизни линейных молекул. Существует несколько гипотез насчёт того, как разрушаются кольцевые РНК. Кольцевые РНК могут расщеплять эндонуклеазы, которые разрушают нуклеиновые кислоты не с концов, а вносят разрывы во внутренние части молекулы. Вероятно, в этом случае за разрушение отвечает комплекс, содержащий микроРНК, «наводящие» эндонуклеазы группы Argonaute на молекулы-мишени. В circRNA, подлежащих разрушению, некоторые остатки аденозина могут специфически метилироваться. Такие метилированные РНК распознаются особыми белками, переносящими их в места деградации рибонуклеиновых кислот — так называемые P-тельца. В разрушении circRNA могут быть задействованы особые органеллы — аутофагосомы, среди прочего содержащие эндонуклеазы. Клетки могут выбрасывать излишние circRNA в кровь в составе внеклеточных везикул. Если для первого гипотетического пути разрушения кольцевых РНК есть некоторые экспериментальные подтверждения, то остальные модели ещё ожидают своей проверки опытом[2].
Функции
Описаны биологические эффекты как самих кольцевых РНК, так и процесса их образования. Кроме того, кольцевые РНК могут кодировать пептиды, которые тоже выполняют определённые клеточные функции. Хотя бэксплайсинг, приводящий к образованию circRNA, — событие в 100 раз более редкое, чем обычный линейный сплайсинг, вполне вероятно, что эти два процесса конкурируют друг с другом и взаимоподавляются. Возможно, именно подавление линейного сплайсинга в ходе формирования кольцевых РНК — основная клеточная функция этих молекул. Выпетливание участка незрелого транскрипта за счет комплементарного связывания инвертированных повторов в интронах само по себе может эффективно подавлять линейный сплайсинг. Кроме того, для протекания как бэксплайсинга, так и линейного сплайсинга необходимы одни и те же участки транскрипта; обычно они задействованы именно в линейном процессе, что в большинстве случаев подавляет бэксплайсинг. Действительно, показано, что с одного и того же гена кольцевые РНК и обычные линейные мРНК не синтезируются одновременно. Однако экспериментальные данные свидетельствуют о более сложной, чем обычное конкурентное подавление, связи между линейным и бэксплайсингом. Возможно, важную роль в том, какая РНК будет считываться с гена — мРНК или кольцевая, может играть скорость транскрипции. Так, альтернативный сплайсинг часто приводит к образованию лассо, содержащих интроны (то есть возможных предшественников кольцевых РНК), а это нередко происходит при ускорении транскрипции. Выбор между бэксплайсингом и линейным сплайсингом может быть основан и на более сложных механизмах. Предполагают, например, что кольцевая РНК, которая считывается с гена mbl, забирает на себя весь белковый продукт этого гена — Muscleblind. Известно, что этот белок необходим для образования линейных mbl-мРНК, поэтому, связываясь с ним и не давая ему функционировать, кольцевые mbl-РНК (circMbl) подавляют синтез своих линейных «собратьев». Не исключена и возможность комплементарного связывания кольцевых РНК с участками породивших их генов, то есть с ДНК[2].
Ряд экспериментов свидетельствует в пользу того, что EIciRNA (экзон-интронные) и ciRNA (интронные) влияют на транскрипцию собственных генов, стимулируя РНК-полимеразу II. Исследователям удалось осадить с помощью антител комплекс EIciRNA с РНК-полимеразой II, причём выяснилось, что для стимуляции полимеразы необходим ещё один компонент — малая ядерная РНК U1. Возможно, при взаимодействии с EIciRNA U1 располагается таким образом, что стимулирует работу полимеразы. В то же время ciRNA, похоже, могут связываться непосредственно с хроматином в области «родительских» генов и повышать скорость их транскрипции. Удалось осадить, например, ciRNA под названием ci-ankrd52 в комплексе с активно работающей РНК-полимеразой II (активная форма фермента отличается особым фосфорилированием С-концевого домена). Поскольку ciRNA способны связываться и с «чужими» последовательностями ДНК, их роль в контроле экспрессии генов может быть значительной[2].
Для двух ecircRNA (экзонных, локализованных в цитоплазме) экспериментально показана способность влиять на синтез белка. Кольцевая РНК circANRIL нарушает работу комплекса белков, процессирующих рРНК, уменьшая тем самым количество функциональных рибосом и выход белка. В то же время circPABPN1 подавляет работу белка HuR, необходимого для трансляции ряда мРНК[2].
Кольцевые РНК могут служить структурной основой для сборки белковых комплексов и тем самым обеспечивать межбелковые взаимодействия. Например, благодаря circ-Foxo3 циклинзависимая киназа 2 (Cdk2) взаимодействует со своим ингибитором, p21, что приводит к остановке клеточного цикла. Кроме того, кольцевые РНК могут секвестрировать белки — ограничивать их перемещение к рабочим местам. Так, вышеупомянутая circ-Foxo3 может «запирать» в цитоплазме транскрипционный фактор E2F1 и некоторые другие белки[3].
Некоторые экзонные кольцевые РНК содержат сайты связывания негативных регуляторов экспрессии генов — микроРНК. В англоязычной литературе такие circRNA часто называют microRNA sponges — «губки, впитывающие микроРНК». Связываясь с ними, микроРНК уже не могут взаимодействовать с комплементарными мРНК-мишенями и мешать их трансляции. Например, кольцевая РНК CDR1as содержит 74 сайта связывания с микроРНК miR-7, а мышиная кольцевая РНК, считанная с гена Sry (важен для определения пола), — 16 сайтов связывания с miR-138. Стоит, однако, отметить, что лишь для немногих кольцевых РНК показана способность связываться с микроРНК, то есть это скорее исключение, чем правило. Интересно, что circRNA найдены у некоторых одноклеточных эукариот, у которых вообще нет микроРНК, а именно — у дрожжей Saccharomyces cerevisiae и малярийного плазмодия Plasmodium falciparum. Таким образом, связывание с микроРНК не может быть основной функцией кольцевых РНК[2].
Ряд кольцевых РНК играет важную роль в противовирусном иммунитете. Например, у кур, устойчивых к вирусу птичьего лейкоза, 12 circRNA образуются в бόльших количествах, чем у обычных кур. Многие из этих молекул связываются с микроРНК, регулирующими экспрессию генов, которые связаны с такими иммунными процессами, как активация В-лимфоцитов и презентация антигена. Любопытно, что иммунная система тоже влияет на синтез кольцевых РНК. Например, иммунные факторы NF90 и NF110 (сплайс-варианты гена ILF3) стимулируют образование circRNA из созревающего транскрипта в ядре. В условиях же вирусной инфекции эти белки уходят в цитоплазму, где связываются с вирусными мРНК и тормозят жизненный цикл вируса; количество ядерной circRNA при этом снижается, что может модулировать экспрессию генов. Кольцевые РНК могут участвовать в подавлении инфекции и путём связывания вирусных или клеточных микроРНК, мешающих иммунному ответу[3].
Известно, что большинство событий бэксплайсинга затрагивает экзоны и происходит в РНК генов, кодирующих белки. Трансляция большинства мРНК начинается с распознавания рибосомой видоизменённого нуклеотида на 5′-конце мРНК, так называемого кэпа. У кольцевых РНК нет свободного 5′-конца, поэтому у них не может быть и кэпа. Однако некоторые клеточные и вирусные РНК могут транслироваться в отсутствие кэпа при участии особой последовательности — IRES. С кольцевыми РНК могло бы происходить то же самое[2][3].
И действительно, искусственные circRNA, содержащие IRES и кодирующие какой-нибудь пептид, удавалось транслировать. Однако показано, что большинство кольцевых РНК в живых клетках не связаны с рибосомами, поэтому вряд ли их трансляция носит массовый характер. Пока известны две кольцевые РНК, по которым, вероятно, синтезируются белки in vivo, — это circMbl и circZNF609. Стоит отметить, что эти молекулы образуются несколько нестандартно: в первом случае бэксплайсинг затрагивает первый экзон, который, как мы помним, обычно в состав кольцевых РНК не включается, а во втором в circRNA попадает фрагмент 5′-нетранслируемой области исходного транскрипта, который обладает свойствами IRES. Возможно, синтез белков по circRNA возможен только в особых условиях, например, при стрессе — тепловом шоке или голодании[2].
Если предположить, что какая-то кольцевая РНК содержит открытую рамку считывания с числом нуклеотидов, кратным трём, то теоретически трансляция такой РНК может протекать по механизму катящегося кольца. Результатом такой трансляции была бы теоретически бесконечная цепочка повторяющихся блоков аминокислот, и рост её ограничивался бы процессивностью рибосом. Подобные случаи пока не известны для клеточных кольцевых РНК, однако нечто похожее происходит с вироидной кольцевой РНК, ассоциированной с вирусом жёлтой пятнистости риса[2].
Методы изучения и базы данных
Последние успехи в обнаружении кольцевых РНК связаны с усовершенствованиями технологии секвенирования РНК, такими как увеличение длины одиночных прочтений, улучшение алгоритмов сопоставления РНК с известными генами и расширение библиотек РНК. Кольцевые РНК можно отличить от линейных с помощью биоинформатического подхода (по результатам секвенирования) или «мокрым» способом — с помощью экзонуклеаз. Как упоминалось выше, эти ферменты быстро расщепляют линейные РНК, но не трогают кольцевые. С помощью экзонуклеаз идентифицировали тысячи кольцевых РНК, но всё же большинство circRNA описали благодаря высокопроизводительному секвенированию с использованием специальных алгоритмов[4].
В настоящее время функционирует несколько баз данных, посвящённых кольцевым РНК, и онлайн-инструментов для работы с ними. В их числе[5]:
- Circ2Traits— содержит информацию о кольцевых РНК, связанных с заболеваниями человека;
- CircInteractome — онлайн-инструмент для определения сайтов связывания с микроРНК и белками в кольцевых РНК;
- CircRNADb— содержит детальную информацию о хорошо изученных кольцевых РНК;
- HumanViCe — хранилище последовательностей кольцевых РНК, которые могут связываться с клеточными или вирусными микроРНК в заражённых клетках.
Клиническое значение
Кольцевые РНК в разном количестве выявляются в плазме крови, причём в периферической крови их даже больше, чем в клетках органов. Причины этого неясны, особенно если учесть тот факт, что в 25-процентной сыворотке circRNA распадаются всего через 30 секунд (в клетке средняя кольцевая РНК существует 1—2 дня). Как бы то ни было, наличие и количество некоторых кольцевых РНК в плазме крови могут служить важным показателем здоровья организма. Иными словами, кольцевые РНК можно использовать в качестве биомаркеров для диагностики и определения стадии таких патологий, как коронарные заболевания сердца, различные виды рака (в том числе лейкемия), диабет и рассеянный склероз[2].
Некоторые кольцевые РНК связаны с клеточным старением. Так, circPVT1 действует как ингибитор старения пролиферирующих фибробластов[4]. Ряд кольцевых РНК ассоциирован с возрастными изменениями организма: например, идентифицированы молекулы, связанные со старением мышц у мартышек[6].
К настоящему моменту известны 10 кольцевых РНК, вовлечённых в развитие сердечно-сосудистых и метаболических заболеваний (например, сахарного диабета). Уже упоминавшаяся circANRIL может защищать от атеросклероза, подавляя созревание рРНК и сдерживая этим деление клеток, избыточная пролиферация которых ведёт к формированию атеросклеротических бляшек. Кольцевая РНК под названием MICRA может сигнализировать о нарушениях работы левого желудочка, возникших вследствие инфаркта миокарда. При гипертрофии сердца и сердечной недостаточности наблюдается снижение синтеза ряда кольцевых РНК[2].
Для некоторых клеточных РНК показана связь с сахарным диабетом. Известно, что гиперпродукция микроРНК miR-7 в β-клетках поджелудочной железы способствует развитию диабета, а гиперпродукция ciRS-7 — кольцевой РНК, связывающей miR-7, — в этих клетках, напротив, улучшает секрецию инсулина[4].
В нервных тканях различных организмов (от плодовой мушки до человека) находят особенно много кольцевых РНК. Возможно, это связано с большей распространённостью альтернативного сплайсинга в нейронах. Кроме того, кольцевые РНК в них могут выполнять особые функции, связанные с проведением нервных импульсов. Белок Qki, задействованный в образовании circRNA, участвует в развитии олигодендроцитов и регулирует миелинизацию, а также подавляет образование дендритов в центральной нервной системе. Мутации гена этого белка связывают с атаксией и шизофренией[2]. Есть свидетельства и о связи кольцевых РНК с болезнью Альцгеймера[4][6].
Более 20 кольцевых РНК связаны с развитием разных видов рака, таких как колоректальный рак, рак яичника, мочевого пузыря, молочной железы, печени, желудка, почек и предстательной железы. Онкологические процессы часто сопровождаются транслокациями, которые приводят к появлению специфичных для определённых опухолей видов circRNA. Чаще всего кольцевые РНК, ассоциированные с развитием рака, функционируют как «губки» для микроРНК[2].
Примечания
- Pamudurti Nagarjuna Reddy, Bartok Osnat, Jens Marvin, Ashwal-Fluss Reut, Stottmeister Christin, Ruhe Larissa, Hanan Mor, Wyler Emanuel, Perez-Hernandez Daniel, Ramberger Evelyn, Shenzis Shlomo, Samson Moshe, Dittmar Gunnar, Landthaler Markus, Chekulaeva Marina, Rajewsky Nikolaus, Kadener Sebastian. Translation of CircRNAs (англ.) // Molecular Cell. — 2017. — April (vol. 66, no. 1). — P. 9—21.e7. — ISSN 1097-2765. — doi:10.1016/j.molcel.2017.02.021.
- Holdt Lesca M., Kohlmaier Alexander, Teupser Daniel. Molecular roles and function of circular RNAs in eukaryotic cells (англ.) // Cellular and Molecular Life Sciences. — 2017. — 7 November (vol. 75, no. 6). — P. 1071—1098. — ISSN 1420-682X. — doi:10.1007/s00018-017-2688-5.
- Wang Man, Yu Fei, Wu Wei, Zhang Yuan, Chang Wenguang, Ponnusamy Murugavel, Wang Kun, Li Peifeng. Circular RNAs: A novel type of non-coding RNA and their potential implications in antiviral immunity (англ.) // International Journal of Biological Sciences. — 2017. — Vol. 13, no. 12. — P. 1497—1506. — ISSN 1449-2288. — doi:10.7150/ijbs.22531.
- Greene John, Baird Anne-Marie, Brady Lauren, Lim Marvin, Gray Steven G., McDermott Raymond, Finn Stephen P. Circular RNAs: Biogenesis, Function and Role in Human Diseases (англ.) // Frontiers in Molecular Biosciences. — 2017. — 6 June (vol. 4). — ISSN 2296-889X. — doi:10.3389/fmolb.2017.00038.
- Szabo Linda, Salzman Julia. Detecting circular RNAs: bioinformatic and experimental challenges (англ.) // Nature Reviews Genetics. — 2016. — November (vol. 17, no. 11). — P. 679—692. — ISSN 1471-0056. — doi:10.1038/nrg.2016.114.
- Panda Amaresh C., Grammatikakis Ioannis, Munk Rachel, Gorospe Myriam, Abdelmohsen Kotb. Emerging roles and context of circular RNAs (англ.) // Wiley Interdisciplinary Reviews: RNA. — 2016. — 9 September (vol. 8, no. 2). — P. e1386. — ISSN 1757-7004. — doi:10.1002/wrna.1386.
Ссылки
- Минина Е. Власть колец: всемогущие кольцевые РНК. Биомолекула (13 февраля 2018). Дата обращения: 13 декабря 2018. Архивировано 2 ноября 2018 года.
- Kristensen, L. S., Andersen, M. S., Stagsted, L. V., Ebbesen, K. K., Hansen, T. B., & Kjems, J. (2019). The biogenesis, biology and characterization of circular RNAs. Nature Reviews Genetics, 1-17.