E2F1
Фа́ктор транскри́пции E2F1 — белок, кодируемый у человека геном E2F1[1].
Функция
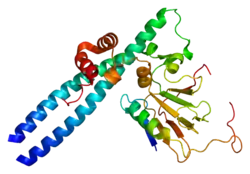
Белок, кодируемый этим геном, относится к семейству факторов транскрипции E2F. Семейство E2F играет решающую роль в контроле клеточного цикла и действии белков опухолевых супрессоров, а также в преобразовании белков мелких опухолевых ДНК-содержащих вирусов. Белки E2F содержат несколько эволюционно консервативных доменов, имеющихся у большинства членов семейства. Эти домены включают ДНК-связывающий домен, домен димеризации, который определяет взаимодействие с регулируемыми дифференцировкой факторами транскрипции (англ. differentiation regulated transcription factor proteins, DP), домен трансактивации, обогащенный кислыми аминокислотами, и домен связывания с белком-супрессором опухолей, который встроен в домен трансактивации. Этот белок и еще два члена этого семейства (E2F2 и E2F3) имеют дополнительный циклин-связывающий домен. E2F1 связывается преимущественно с белком ретинобластомы (pRB) в зависимости от фазы клеточного цикла, что может опосредовать как клеточную пролиферацию, так и p53-зависимый/независимый апоптоз[2].
Взаимодействия с другими белками
E2F1, как было выявлено, взаимодействует с:
См. также
Примечания
- Neuman E., Sellers W. R., McNeil J. A., Lawrence J. B., Kaelin W. G. Jr. Structure and partial genomic sequence of the human E2F1 gene. (англ.) // Gene. — 1996. — Vol. 173, no. 2. — P. 163—169. — PMID 8964493.
- Entrez Gene: E2F1 E2F transcription factor 1.
- Suzuki M., Okuyama S., Okamoto S., Shirasuna K., Nakajima T., Hachiya T., Nojima H., Sekiya S., Oda K. A novel E2F binding protein with Myc-type HLH motif stimulates E2F-dependent transcription by forming a heterodimer. (англ.) // Oncogene. — 1998. — Vol. 17, no. 7. — P. 853—865. — doi:10.1038/sj.onc.1202163. — PMID 9780002.
- Marti A., Wirbelauer C., Scheffner M., Krek W. Interaction between ubiquitin-protein ligase SCFSKP2 and E2F-1 underlies the regulation of E2F-1 degradation. (англ.) // Nature cell biology. — 1999. — Vol. 1, no. 1. — P. 14—19. — doi:10.1038/8984. — PMID 10559858.
- Yang R., Müller C., Huynh V., Fung Y. K., Yee A. S., Koeffler H. P. Functions of cyclin A1 in the cell cycle and its interactions with transcription factor E2F-1 and the Rb family of proteins. (англ.) // Molecular and cellular biology. — 1999. — Vol. 19, no. 3. — P. 2400—2407. — PMID 10022926.
- Xu M., Sheppard K. A., Peng C. Y., Yee A. S., Piwnica-Worms H. Cyclin A/CDK2 binds directly to E2F-1 and inhibits the DNA-binding activity of E2F-1/DP-1 by phosphorylation. (англ.) // Molecular and cellular biology. — 1994. — Vol. 14, no. 12. — P. 8420—8431. — PMID 7969176.
- Vandel L., Kouzarides T. Residues phosphorylated by TFIIH are required for E2F-1 degradation during S-phase. (англ.) // The EMBO journal. — 1999. — Vol. 18, no. 15. — P. 4280—4291. — doi:10.1093/emboj/18.15.4280. — PMID 10428966.
- Strachan G. D., Jordan-Sciutto K. L., Rallapalli R., Tuan R. S., Hall D. J. The E2F-1 transcription factor is negatively regulated by its interaction with the MDMX protein. (англ.) // Journal of cellular biochemistry. — 2003. — Vol. 88, no. 3. — P. 557—568. — doi:10.1002/jcb.10318. — PMID 12532331.
- Kong H. J., Yu H. J., Hong S., Park M. J., Choi Y. H., An W. G., Lee J. W., Cheong J. Interaction and functional cooperation of the cancer-amplified transcriptional coactivator activating signal cointegrator-2 and E2F-1 in cell proliferation. (англ.) // Molecular cancer research : MCR. — 2003. — Vol. 1, no. 13. — P. 948—958. — PMID 14638867.
- Taniura H., Taniguchi N., Hara M., Yoshikawa K. Necdin, a postmitotic neuron-specific growth suppressor, interacts with viral transforming proteins and cellular transcription factor E2F1. (англ.) // The Journal of biological chemistry. — 1998. — Vol. 273, no. 2. — P. 720—728. — PMID 9422723.
- Kuwako K., Taniura H., Yoshikawa K. Necdin-related MAGE proteins differentially interact with the E2F1 transcription factor and the p75 neurotrophin receptor. (англ.) // The Journal of biological chemistry. — 2004. — Vol. 279, no. 3. — P. 1703—1712. — doi:10.1074/jbc.M308454200. — PMID 14593116.
- Sansal I., Dupont E., Toru D., Evrard C., Rouget P. NPDC-1, a regulator of neural cell proliferation and differentiation, interacts with E2F-1, reduces its binding to DNA and modulates its transcriptional activity. (англ.) // Oncogene. — 2000. — Vol. 19, no. 43. — P. 5000—5009. — doi:10.1038/sj.onc.1203843. — PMID 11042687.
- Darbinian N., Gallia G. L., Kundu M., Shcherbik N., Tretiakova A., Giordano A., Khalili K. Association of Pur alpha and E2F-1 suppresses transcriptional activity of E2F-1. (англ.) // Oncogene. — 1999. — Vol. 18, no. 46. — P. 6398—6402. — doi:10.1038/sj.onc.1203011. — PMID 10597240.
- Joshi B., Ko D., Ordonez-Ercan D., Chellappan S. P. A putative coiled-coil domain of prohibitin is sufficient to repress E2F1-mediated transcription and induce apoptosis. (англ.) // Biochemical and biophysical research communications. — 2003. — Vol. 312, no. 2. — P. 459—466. — PMID 14637159.
- Fusaro G., Dasgupta P., Rastogi S., Joshi B., Chellappan S. Prohibitin induces the transcriptional activity of p53 and is exported from the nucleus upon apoptotic signaling. (англ.) // The Journal of biological chemistry. — 2003. — Vol. 278, no. 48. — P. 47853—47861. — doi:10.1074/jbc.M305171200. — PMID 14500729.
- Wang S., Zhang B., Faller D. V. Prohibitin requires Brg-1 and Brm for the repression of E2F and cell growth. (англ.) // The EMBO journal. — 2002. — Vol. 21, no. 12. — P. 3019—3028. — doi:10.1093/emboj/cdf302. — PMID 12065415.
- Wang S., Nath N., Fusaro G., Chellappan S. Rb and prohibitin target distinct regions of E2F1 for repression and respond to different upstream signals. (англ.) // Molecular and cellular biology. — 1999. — Vol. 19, no. 11. — P. 7447—7460. — PMID 10523633.
- Dyson N., Dembski M., Fattaey A., Ngwu C., Ewen M., Helin K. Analysis of p107-associated proteins: p107 associates with a form of E2F that differs from pRB-associated E2F-1. (англ.) // Journal of virology. — 1993. — Vol. 67, no. 12. — P. 7641—7647. — PMID 8230483.
- Nicolas E., Ait-Si-Ali S., Trouche D. The histone deacetylase HDAC3 targets RbAp48 to the retinoblastoma protein. (англ.) // Nucleic acids research. — 2001. — Vol. 29, no. 15. — P. 3131—3136. — PMID 11470869.
- Pardo P. S., Leung J. K., Lucchesi J. C., Pereira-Smith O. M. MRG15, a novel chromodomain protein, is present in two distinct multiprotein complexes involved in transcriptional activation. (англ.) // The Journal of biological chemistry. — 2002. — Vol. 277, no. 52. — P. 50860—50866. — doi:10.1074/jbc.M203839200. — PMID 12397079.
- Choubey D., Li S. J., Datta B., Gutterman J. U., Lengyel P. Inhibition of E2F-mediated transcription by p202. (англ.) // The EMBO journal. — 1996. — Vol. 15, no. 20. — P. 5668—5678. — PMID 8896460.
- Fajas L., Paul C., Zugasti O., Le Cam L., Polanowska J., Fabbrizio E., Medema R., Vignais M. L., Sardet C. pRB binds to and modulates the transrepressing activity of the E1A-regulated transcription factor p120E4F. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2000. — Vol. 97, no. 14. — P. 7738—7743. — doi:10.1073/pnas.130198397. — PMID 10869426.
- Wu C. L., Zukerberg L. R., Ngwu C., Harlow E., Lees J. A. In vivo association of E2F and DP family proteins. (англ.) // Molecular and cellular biology. — 1995. — Vol. 15, no. 5. — P. 2536—2546. — PMID 7739537.
- Rotheneder H., Geymayer S., Haidweger E. Transcription factors of the Sp1 family: interaction with E2F and regulation of the murine thymidine kinase promoter. (англ.) // Journal of molecular biology. — 1999. — Vol. 293, no. 5. — P. 1005—1015. — doi:10.1006/jmbi.1999.3213. — PMID 10547281.
- Lin S. Y., Black A. R., Kostic D., Pajovic S., Hoover C. N., Azizkhan J. C. Cell cycle-regulated association of E2F1 and Sp1 is related to their functional interaction. (англ.) // Molecular and cellular biology. — 1996. — Vol. 16, no. 4. — P. 1668—1675. — PMID 8657142.
- Karlseder J., Rotheneder H., Wintersberger E. Interaction of Sp1 with the growth- and cell cycle-regulated transcription factor E2F. (англ.) // Molecular and cellular biology. — 1996. — Vol. 16, no. 4. — P. 1659—1667. — PMID 8657141.
- Sardet C., Vidal M., Cobrinik D., Geng Y., Onufryk C., Chen A., Weinberg R. A. E2F-4 and E2F-5, two members of the E2F family, are expressed in the early phases of the cell cycle. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1995. — Vol. 92, no. 6. — P. 2403—2407. — PMID 7892279.
- Helin K., Wu C. L., Fattaey A. R., Lees J. A., Dynlacht B. D., Ngwu C., Harlow E. Heterodimerization of the transcription factors E2F-1 and DP-1 leads to cooperative trans-activation. (англ.) // Genes & development. — 1993. — Vol. 7, no. 10. — P. 1850—1861. — PMID 8405995.
- Liu K., Lin F. T., Ruppert J. M., Lin W. C. Regulation of E2F1 by BRCT domain-containing protein TopBP1. (англ.) // Molecular and cellular biology. — 2003. — Vol. 23, no. 9. — P. 3287—3304. — PMID 12697828.
- Yu X., Chini C. C., He M., Mer G., Chen J. The BRCT domain is a phospho-protein binding domain. (англ.) // Science (New York, N.Y.). — 2003. — Vol. 302, no. 5645. — P. 639—642. — doi:10.1126/science.1088753. — PMID 14576433.
- Zhou F., Zhang L., Wang A., Song B., Gong K., Zhang L., Hu M., Zhang X., Zhao N., Gong Y. The association of GSK3 beta with E2F1 facilitates nerve growth factor-induced neural cell differentiation. (англ.) // The Journal of biological chemistry. — 2008. — Vol. 283, no. 21. — P. 14506—14515. — doi:10.1074/jbc.M706136200. — PMID 18367454.
Литература
- Dupont E., Sansal I., Toru D., Evrard C., Rouget P. Identification of NPDC-1, gene involved in the control of proliferation and differentiation of neural and glial precursors (фр.) // Comptes rendus des seances de la Societe de biologie et de ses filiales. — 1997. — Vol. 191, no 1. — P. 95—104. — PMID 9181131.
- Stevens C., La Thangue N. B. The emerging role of E2F-1 in the DNA damage response and checkpoint control. (англ.) // DNA repair. — 2004. — Vol. 3, no. 8-9. — P. 1071—1079. — doi:10.1016/j.dnarep.2004.03.034. — PMID 15279795.
- Zhang Z., Wang H., Li M., Rayburn E., Agrawal S., Zhang R. Novel MDM2 p53-independent functions identified through RNA silencing technologies. (англ.) // Annals of the New York Academy of Sciences. — 2005. — Vol. 1058. — P. 205—214. — doi:10.1196/annals.1359.030. — PMID 16394138.
- Schild C., Wirth M., Reichert M., Schmid R. M., Saur D., Schneider G. PI3K signaling maintains c-myc expression to regulate transcription of E2F1 in pancreatic cancer cells. (англ.) // Molecular carcinogenesis. — 2009. — Vol. 48, no. 12. — P. 1149—1158. — doi:10.1002/mc.20569. — PMID 19603422.