Циклическая АДФ-рибоза
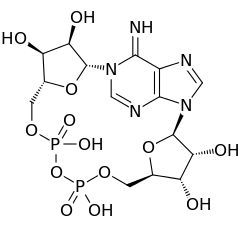
Циклическая АДФ-рибоза (англ. Cyclic ADP Ribose, cADPR) — это циклический адениновый нуклеотид (как cAMP) с двумя фосфатными группами на 5' гидроксильной группе аденозина (как ADP), соединенный с другой молекулой рибозы по 5' положению. Это в свою очередь приводит к замыканию кольца, при этом образуется гликозидная связь с первым атомом азота того же аденозина, который девятым атомом присоединен гликозидной связью к другой рибозе (см. рисунок). cADPR образуется из никотинамидадениндинуклеотида (NAD+) ферментом ADP-рибозилциклазой (EC 3.2.2.5) и является частью системы вторичных посредников.
Функция
cADPR это клеточный посредник в системе сигнализации Ca2+.[1] cADPR увеличивыет выброс Ca2+ из саркоплазматического ретикулума (СР) за счёт активации его закачки в СР Ca2+-АТФазой (SERCA). Увеличение количества выброшенного из СР Ca2+ опосредовано снятием тормозящего влияния фосфоламбана на SERCA и последующим увеличением концентрации интралюминального Ca2+.[2]
Метаболизм
cADPR синтезируется из NAD+ бифункциональным ферментом семейства CD38 (которое также включает в себя ADP-рибозилциклазу).[3] И этот же фермент может гидролизовать его до ADPR. Катализ осуществляется через ковалентно-связанный интермедиат. Реакция гидролиза ингибируется АТР и поэтому циклические формы APDR могут накапливаться.
Примечания
- Guse A.H. Regulation of calcium signaling by the second messenger cyclic adenosine diphosphoribose (cADPR) (англ.) // Curr. Mol. Med. : journal. — 2004. — Vol. 4, no. 3. — P. 239—248. — doi:10.2174/1566524043360771. — PMID 15101682.
- V.; Lukyanenko; Györke, I.; Wiesner, T. F.; Györke, S. Potentiation of Ca(2+) release by cADP-ribose in the heart is mediated by enhanced SR Ca(2+) uptake into the sarcoplasmic reticulum (англ.) // Circulation Research : journal. — 2001. — Vol. 89, no. 7. — P. 614—622. — doi:10.1161/hh1901.098066. — PMID 11577027.
- Guse A.H. Biochemistry, biology, and pharmacology of cyclic adenosine diphosphoribose (cADPR) (англ.) // Curr. Med. Chem. : journal. — 2004. — Vol. 11, no. 7. — P. 847—855. — doi:10.2174/0929867043455602. — PMID 15078169.
Литература
- Lee, H.C., Walseth, T.F., Bratt, G.T., Hayes, R.N., and Clapper, D.L. (1989) Structural determination of a cyclic metabolite of NAD+ with intracellular Ca+2 mobilizing activity. J. Biol. Chem. 264, 1608—1615.
- Lee, H.C., Aarhus, R. and Levitt, D. (1994) The crystal structure of cyclic ADP-ribose. Nature Structural Biology 1, 143—144.
- Prasad, G.S., McRee, D.E., Stura, E.A., Levitt, D.G., Lee, H.C., Stout, C.D. (1996) Crystal structure of Aplysia ADP-ribosyl cyclase, a homolog of the bifunctional ectozyme CD38. Nature Struct. Biol. 3, 957—964.
- Lukyanenko, V., Györke, I., Wiesner, T.F., Györke, S. (2001). Potentiation of Ca2+ release by cADPR in heart is mediated by enhanced Ca2+ uptake into the sarcoplasmic reticulum. Circulation Research 89:614-622.
- Liu, Q., Kriksunov, I.A., Graeff, R., Munshi, C. Lee, H.C. and Hao, Q. (2005) Crystal structure of the human CD38 extracellular domain. Structure 13, 1331—1339.