Гемоглобин
Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1]. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода[2]. Один грамм гемоглобина может переносить до 1,34 мл кислорода[3].

История
Гемоглобин появился более чем 400 миллионов лет назад у последнего общего предка человека и акул в результате 2 мутаций, приведших к формированию четырёхкомпонентного комплекса гемоглобина, сродство которого к кислороду достаточно для связывания кислорода в насыщенной им среде, но недостаточно, чтобы удерживать его в других тканях организма.[4][5]
В 1825 году Иоганн Фридрих Энгельхарт обнаружил, что соотношение железа и белка одинаково в гемоглобинах нескольких видов[6][7]. Из известной атомной массы железа он рассчитал молекулярную массу гемоглобина до n × 16000 (n = число атомов железа в гемоглобине, теперь известное как 4). Этот «поспешный вывод» вызвал в то время много насмешек со стороны учёных, которые не могли поверить, что какая-либо молекула может быть такой большой. Гилберт Смитсон Адэр подтвердил результаты Энгельхарта в 1925 году, измерив осмотическое давление растворов гемоглобина[8].
Хотя кровь была известна как переносчик кислорода по крайней мере с 1794 года[9][10], свойство гемоглобина переносить кислород было описано Хюнефельдом в 1840 году[11]. В 1851 году немецкий физиолог Отто Функе опубликовал серию статей, в которых он описал выращивание кристаллов гемоглобина путём последовательного разбавления эритроцитов растворителем, таким как чистая вода, спирт или эфир, с последующим медленным испарением растворителя из полученного белкового раствора[12][13]. Обратимая оксигенация гемоглобина была описана несколько лет спустя Феликсом Хоппе-Сейлером[14].
В 1959 году Макс Фердинанд Перуц определил молекулярную структуру гемоглобина методом рентгеновской кристаллографии[15][16]. Эта работа привела к тому, что он разделил с Джоном Кендрю Нобелевскую премию по химии 1962 года за их исследования структур глобулярных белков[17].
Гемоглобин в крови человека
Нормальным содержанием гемоглобина в крови человека считается: у мужчин — 130—160 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин — 120—160 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимален и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня — 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови[18].
Во время беременности в организме женщины происходит задержка и накопление жидкости, что является причиной гемоделюции — физиологического разведения крови. В результате наблюдается относительное снижение концентрации гемоглобина (при беременности уровень гемоглобина в норме составляет 110—155 г/л). Кроме этого, в связи с внутриутробным ростом ребёнка происходит быстрое расходование запасов железа и фолиевой кислоты. Если до беременности у женщины был дефицит этих веществ, проблемы, связанные со снижением гемоглобина, могут возникнуть уже на ранних сроках беременности[19].
Главные функции гемоглобина: перенос кислорода и буферная функция. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином образуя оксигемоглобин. Потоком крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается от связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество (около 1/3) диоксида углерода (CO2) образуя карбгемоглобин и освобождать его в лёгких (2/3 углекислого газа переносится в растворённом виде или в виде солей плазмой крови и цитоплазмой эритроцитов)[20].
Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее (в 250 раз[21]), чем кислород, образуя карбоксигемоглобин (HbCO). Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в лёгких. Некоторые процессы (к примеру, отравление нитратами, нитритами, анилином, пиридином) приводят к окислению иона железа в гемоглобине до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от «мета-» и «гемоглобин», иначе гемиглобин или ферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода.
Строение
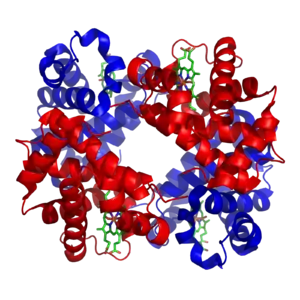
Гемоглобин является сложным белком класса гемопротеинов, то есть в качестве простетической группы здесь выступает гем — порфириновое ядро, содержащее железо. Гемоглобин человека является тетрамером, то есть состоит из 4 протомеров. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α-, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами от A до H (от N-конца к C-концу).
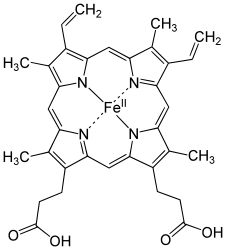
Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа(II). Этот кофактор нековалентно связан с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо(II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две другие координационные позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93-м положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64-м положении цепи (участок E).
Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы. Гемоглобин в лёгких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и монооксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин.
Связь гемоглобина с монооксидом углерода более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с монооксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология
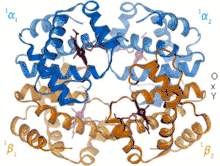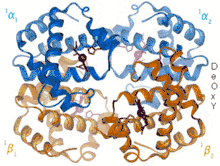
В отличие от миоглобина гемоглобин имеет четвертичную структуру, которая придаёт ему способность регулировать присоединение и отщепление кислорода и характерную кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Структура может находиться в двух устойчивых состояниях (конформациях): оксигемоглобин (содержит 4 молекулы кислорода; напряжённая конформация) и дезоксигемоглобин (кислорода не содержит; расслабленная конформация).
Устойчивое состояние структуры дезоксигемоглобина усложняет присоединение к нему кислорода. Поэтому для начала реакции необходимо достаточное парциальное давление кислорода, что возможно в альвеолах лёгких. Изменения в одной из 4 субъединиц влияют на оставшиеся, и после присоединения первой молекулы кислорода связывание последующих облегчается.
Отдав кислород тканям, гемоглобин присоединяет к себе ионы водорода и углекислый газ, перенося их в лёгкие[22].
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение мутациям относится аномалия гемоглобина, приводящая к серповидноклеточной анемии. Однако, к несчастью, эти аномалии (как и аномалии строения гемоглобина, не имеющие явно приспособительного значения) сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями.
Гемоглобин высокотоксичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях). Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией — ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина — железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности.
Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина. Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезёнкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается.
Другой частью гемоглобинообезвреживающей системы является белок гемопексин, специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других жёлчных пигментов или выпускается в рециркуляцию в комплексе с трансферринами для повторного использования костным мозгом в процессе эритропоэза.
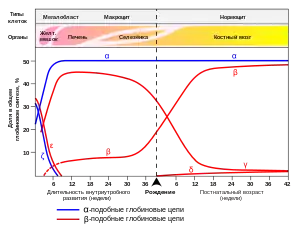
Также указаны типы клеток и органы, в которых происходит экспрессия гена (данные по Wood W. G., (1976). Br. Med. Bull. 32, 282.).[23]
Гемоглобин при заболеваниях крови
Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см. анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода.
Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии. Если дефицит кислорода в организме в общем называют гипоксией, то местные нарушения кислородоснабжения называют ишемией.
Прочие причины низкого гемоглобина разнообразны: кровопотеря, пищевой дефицит, болезни костного мозга, химиотерапия, отказ почек, атипичный гемоглобин.
Повышенное содержание гемоглобина в крови связано с увеличением количества или размеров эритроцитов, что наблюдается также при истинной полицитемии. Это повышение может быть вызвано: врождённой болезнью сердца, лёгочным фиброзом, слишком большим количеством эритропоэтина.
См. также
- Гемоглобин А
- Гемоглобин С (мутантная форма)
- Эмбриональный гемоглобин
- Гемоглобин S (мутантная форма)
- Гемоглобин F (фетальный)
- Цветной показатель
- Кобоглобин
- Нейроглобин
- Анемия
- Порфирия
- Талассемия
- Гемосидерин (гемосидероз)
- Метгемоглобинурия[24]
- Метгемоглобинредуктаза
- Эффект Вериго — Бора
- Леггемоглобин
Примечания
- Haemoglobins of invertebrate tissues. Nerve haemoglobins of Aphrodite, Aplysia and Halosydna
- Costanzo, Linda S. Physiology. — Hagerstwon, MD : Lippincott Williams & Wilkins, 2007. — ISBN 978-0-7817-7311-9.
- Dominguez de Villota ED, Ruiz Carmona MT, Rubio JJ, de Andrés S (1981). “Equality of the in vivo and in vitro oxygen-binding capacity of hemoglobin in patients with severe respiratory disease”. Br J Anaesth. 53 (12): 1325—28. DOI:10.1093/bja/53.12.1325. PMID 7317251. Неизвестный параметр
|s2cid=(справка) - Ученые выяснили происхождение гемоглобина. РИА Новостей, 20.05.2020, 18:59
- Michael Berenbrink. Evolution of a molecular machine/Nature, NEWS AND VIEWS, 20 MAY 2020
- Engelhart, Johann Friedrich. Commentatio de vera materia sanguini purpureum colorem impertientis natura : [лат.]. — Göttingen : Dietrich, 1825.
- “Engelhard & Rose on the Colouring Matter of the Blood”. Edinburgh Medical and Surgical Journal. 27 (90): 95—102. 1827. PMC 5763191. PMID 30330061.
- Adair, Gilbert Smithson (1925). “A critical study of the direct method of measuring the osmotic pressure of hǣmoglobin”. Proc. R. Soc. Lond. A 108 (750): 292—300. Bibcode:1925RSPSA.109..292A. DOI:10.1098/rspa.1925.0126.
- Parry, CH. Letters from Dr. Withering, ... Dr. Ewart, ... Dr. Thorton ... and Dr. Biggs ... together with some other papers, supplementary to two publications on asthma, consumption, fever, and other diseases, by T. Beddoes : [англ.]. — Google Books, 1794. — P. 43.
- Beddoes, T. Considerations on the Medicinal Use, and on the Production of Factitious Airs: Part I. By Thomas Beddoes, M.D. Part II. By James Watt, Engineer; "Part 1, section 2, "Of the breathing of man and familiar animals" : [англ.]. — Bulgin and Rosser, 1796. — P. Part 1, p. 9–13.
- Hünefeld, Friedrich Ludwig. Der Chemismus in der thierischen Organisation : [нем.]. — Leipzig : F. A. Brockhaus, 1840.
- Funke O (1851). “Über das milzvenenblut”. Z Rat Med. 1: 172—218.
- A NASA Recipe For Protein Crystallography. Educational Brief. National Aeronautics and Space Administration. Дата обращения: 12 октября 2008. Архивировано 10 апреля 2008 года.
- Hoppe-Seyler F (1866). “Über die oxydation in lebendem blute”. Med-chem Untersuch Lab. 1: 133—40.
- Perutz, M.F.; Rossmann, M.G.; Cullis, A.F.; Muirhead, H.; Will, G.; North, A.C.T. (1960). “Structure of haemoglobin: a three-dimensional Fourier synthesis at 5.5-A. resolution, obtained by X-ray analysis”. Nature. 185 (4711): 416—22. Bibcode:1960Natur.185..416P. DOI:10.1038/185416a0. PMID 18990801. Неизвестный параметр
|s2cid=(справка) - Perutz MF (1960). “Structure of haemoglobin”. Brookhaven Symposia in Biology. 13: 165—83. PMID 13734651.
- Лауреаты нобелевской премии. Макс Перуц.
- Назаренко Г. И., Кишкун А. А. Клиническая оценка результатов лабораторных исследований. — 2005.
- Общий анализ крови и беременность Архивная копия от 10 марта 2014 на Wayback Machine
- Карбгемоглобин // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Hall, John E. Guyton and Hall textbook of medical physiology (англ.). — 12th ed.. — Philadelphia, Pa.: Saunders/Elsevier, 2010. — P. 502. — 1120 p. — ISBN 978-1416045748.
- Степанов В. М. Структура и функции белков : Учебник. — М. : Высшая школа, 1996. — С. 167—175. — 335 с. — 5000 экз. — ISBN 5-06-002573-X.
- Айала Ф., Кайгер Дж.. Современная генетика: В 3-х т = Modern Genetics / Пер. А. Г. Имашевой, А. Л. Остермана, Н. К. Янковского. Под ред. Е. В. Ананьева. — М.: Мир, 1987. — Т. 2. — 368 с. — 15 000 экз. — ISBN 5-03-000495-5.
- Метгемоглобинурия / Токарев Ю. Н. // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1981. — Т. 15 : Меланома — Мудров. — 576 с. : ил.
Литература
- Mathews, CK; van Holde, KE & Ahern, KG (2000), Biochemistry (3rd ed.), Addison Wesley Longman, ISBN 0-8053-3066-6
- Levitt, M & Chothia, C (1976), Structural patterns in globular proteins, Nature
Ссылки
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). “An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure”. Am Heart J. 151 (1): 91.e1—91.e6. DOI:10.1016/j.ahj.2005.10.008. PMID 16368297.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). “Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds”. J Mol Biol. 356 (2): 335—53. DOI:10.1016/j.jmb.2005.11.006. PMID 16368110.
- Hardison, Ross C. (2012). “Evolution of Hemoglobin and Its Genes”. Cold Spring Harbor Perspectives in Medicine. 2 (12): a011627. DOI:10.1101/cshperspect.a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182.