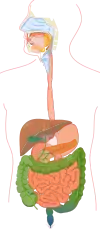
Печень
Пе́чень (лат. hepar, др.-греч. ἧπαρ) — жизненно важная железа внешней секреции позвоночных животных, в том числе и человека, находящаяся в брюшной полости (полости живота) под диафрагмой и выполняющая большое количество различных физиологических функций. Печень является самой крупной железой позвоночных.
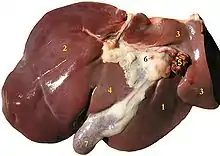
Анатомия печени
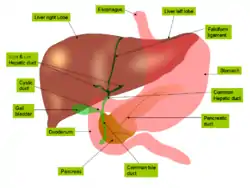
Печень состоит из двух долей: правой и левой. В правой доле выделяют ещё две вторичные доли: квадратную и хвостатую. По современной сегментарной схеме, предложенной Клодом Куино (1957), печень разделяется на восемь сегментов, образующих правую и левую доли. Сегмент печени представляет собой пирамидальный участок печёночной паренхимы, обладающий достаточно обособленным кровоснабжением, иннервацией и оттоком желчи. Хвостатая и квадратная доли, располагающиеся сзади и спереди от ворот печени, по этой схеме соответствуют SI и SIV левой доли. Помимо этого, в левой доле выделяют SII и SIII печени, правая доля делится на SV — SVIII, пронумерованные вокруг ворот печени по ходу часовой стрелки.
Гистологическое строение печени
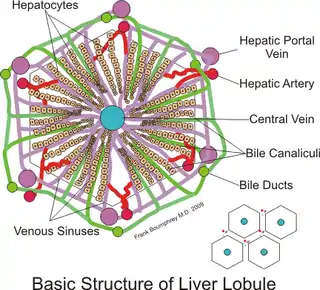
Паренхима — дольчатая. Печёночная долька является структурно-функциональной единицей печени. Основными структурными компонентами печёночной дольки являются:
- печёночные пластинки (радиальные ряды гепатоцитов);
- внутридольковые синусоидные гемокапилляры (между печёночными балками);
- жёлчные капилляры (лат. ductuli beliferi) внутри печёночных балок, между двумя слоями гепатоцитов;(расширения жёлчных капилляров при их выходе из дольки);
- перисинусоидное пространство Диссе (щелевидное пространство между печёночными балками и синусоидными гемокапиллярами);
- центральная вена (образована слиянием внутридольковых синусоидных гемокапилляров).
Строма состоит из наружной соединительнотканной капсулы, междольковых прослоек РВСТ (рыхлой волокнистой соединительной ткани), кровеносных сосудов, нервного аппарата.
Функции печени
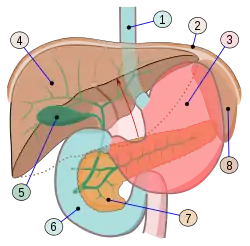
- обезвреживание различных чужеродных веществ (ксенобиотиков), в частности, аллергенов, ядов и токсинов, путём превращения их в безвредные, менее токсичные или легче удаляемые из организма соединения; функция печени плода незначительна, поскольку её выполняет плацента;
- обезвреживание и удаление из организма избытков гормонов, медиаторов, витаминов, а также токсичных промежуточных и конечных продуктов обмена веществ, например, аммиака, фенола, этанола, ацетона и кетоновых кислот;
- обеспечение энергетических потребностей организма глюкозой и конвертация различных источников энергии (свободных жирных кислот, аминокислот, глицерина, молочной кислоты и др.) в глюкозу (так называемый глюконеогенез);
- пополнение и хранение быстро мобилизуемых энергетических резервов в виде гликогена и регуляция углеводного обмена;
- пополнение и хранение депо некоторых витаминов (особенно велики в печени запасы жирорастворимых витаминов А, D, водорастворимого витамина B12), а также депо катионов ряда микроэлементов — металлов, в частности, катионов железа, меди и кобальта. Также печень непосредственно участвует в метаболизме витаминов А, В, С, D, E, К, РР и фолиевой кислоты;
- участие в процессах кроветворения (только у плода), в частности, синтез многих белков плазмы крови — альбуминов, альфа- и бета-глобулинов, транспортных белков для различных гормонов и витаминов, белков свёртывающей и противосвёртывающей систем крови и многих других; печень является одним из важных органов гемопоэза в пренатальном развитии;
- синтез холестерина и его эфиров, липидов и фосфолипидов, липопротеидов и регуляция липидного обмена;
- синтез жёлчных кислот и билирубина, продукция и секреция жёлчи;
- также служит депо для довольно значительного объёма крови, который может быть выброшен в общее сосудистое русло при кровопотере или шоке за счёт сужения сосудов, кровоснабжающих печень;
- синтез гормонов (например, инсулиноподобных факторов роста).
Особенности кровоснабжения печени
Особенности кровоснабжения печени отражают её важную биологическую функцию детоксикации: кровь от кишечника, содержащая токсичные вещества, потреблённые извне, а также продукты жизнедеятельности микроорганизмов (скатол, индол и т. д.) по воротной вене (v. portae) доставляются в печень. Далее воротная вена разделяется до более мелких междольковых вен. Артериальная кровь поступает в печень по собственной печёночной артерии (a. hepatica propria), разветвляясь до междольковых артерий. Междольковые артерии и вены выбрасывают кровь в синусоиды, где, таким образом, течёт смешанная кровь, дренаж которой происходит в центральную вену. Центральные вены собираются в печёночные вены и далее в нижнюю полую вену. В эмбриогенезе к печени подходит т. н. аранциев проток, несущий кровь к печени для эффективного пренатального гемопоэза.
Механизм обезвреживания токсинов
Обезвреживание веществ в печени заключается в их химической модификации, которая обычно включает в себя две фазы. В первой фазе вещество подвергается окислению (отсоединению электронов), восстановлению (присоединению электронов) или гидролизу. Во второй фазе ко вновь образованным активным химическим группам присоединяется какое-либо вещество. Такие реакции именуются реакциями конъюгации, а процесс присоединения — конъюгированием. Так же, при попадании токсичных веществ в печень, в клетках последней увеличивается площадь агранулярной ЭПС, что позволяет их обезвреживать.
Болезни печени
Цирроз печени — хроническое прогрессирующее заболевание печени, характеризующееся нарушением её дольковой структуры за счёт разрастания соединительной ткани и патологической регенерации паренхимы; проявляется функциональной недостаточностью печени и портальной гипертензией.
Наиболее частыми причинами заболевания являются хронический алкоголизм (удельный вес алкогольных циррозов печени составляет в разных странах от 20 до 95 %), вирусный гепатит (составляет 10—40 % от всех циррозов печени), наличие в печени гельминтов (чаще всего описторхис, фасциола, клонорхис, токсокара, нотокотилус), а также простейших, в том числе, трихомонад.
Рак печени — тяжёлое заболевание. Среди опухолей, которые поражают человека, это заболевание находится на седьмом месте. Большинство исследователей выделяет ряд факторов, с которыми связан повышенный риск развития рака печени. К ним относятся: цирроз печени, вирусный гепатит B и С, паразитарные инвазии печени, злоупотребление алкоголем, контакт с некоторыми канцерогенами (микотоксинами) и другие.
Возникновение доброкачественных аденом, ангиосарком печени, гепатоцеллюлярной карциномы связаны с воздействием на человека андрогенных стероидных контрацептивных и анаболических препаратов.
-Aflatoxin_B1_Structural_Formulae_V.1.svg.png.webp)
Афлатоксикоз — острая или хроническая интоксикация афлатоксинами, сильнейшими гепатотоксинами и гепатоканцерогенами, возникает исключительно алиментарным путём, то есть через пищу. Афлатоксины представляют собой вторичные метаболиты, которые продуцируют микроскопические плесневые грибы рода Аспергилл, в частности Aspergillus flavus и Aspergillus parasiticus.
Аспергиллы поражают практически все пищевые продукты, но основу составляют растительные продукты, произведённые из зерновых, бобовых и масличных культур таких, как арахис, рис, кукуруза, горох, семена подсолнечника и др. При однократном употреблении контаминированных (загрязнённых) пищевых продуктов аспергиллами возникает острый афлатоксикоз — сильнейшая интоксикация, сопровождаемая острым токсическим гепатитом. При достаточно долгом употреблении контаминированных пищевых продуктов возникает хронический афлатоксикоз, при котором развивается почти в 100 % случаев гепатоцеллюлярная карцинома.
Гемангиомы печени — аномалии развития сосудов печени.
Основные симптомы гемангиомы:
- тяжесть и ощущение распирания в правом подреберье;
- дисфункции желудочно-кишечного тракта (потеря аппетита, тошнота, изжога, отрыжка, метеоризм).
Непаразитарные кисты печени.
Жалобы у больных появляются, когда киста достигает больших размеров, вызывает атрофические изменения ткани печени, сдавливает анатомические структуры, но и они не носят специфического характера.
Основные симптомы:
- боль постоянного характера в правом подреберье;
- быстро наступающее чувство насыщения и дискомфорт в животе после приёма пищи;
- слабость;
- повышенная потливость;
- потеря аппетита, временами тошнота;
- одышка, диспепсические явления;
- желтуха.
Паразитарные кисты печени.
Гидатидный эхинококкоз печени — паразитарное заболевание, вызываемое внедрением и развитием в печени личинок ленточного червя Echinococcus granulosus. Появление различных симптомов заболевания может возникнуть через несколько лет после заражения паразитом.
Основные симптомы:
- болезненность;
- чувство тяжести, давления в правом подреберье, иногда в грудной клетке;
- слабость, недомогание, одышка;
- повторяющаяся крапивница, понос, тошнота, рвота.
Другие инфекции печени: клонорхоз, описторхоз, фасциолёз.
Регенерация печени

Печень является одним из немногих органов, способных восстанавливать первоначальный размер даже при сохранении всего лишь 25 % нормальной ткани. Фактически регенерация происходит, но очень медленно, а быстрый возврат печени к своим первоначальным размерам происходит скорее из-за увеличения объёма оставшихся клеток.[1]
В зрелой печени человека и других млекопитающих обнаружены четыре разновидности стволовых клеток/клеток-предшественников печени — так называемые овальные клетки, малые гепатоциты, эпителиальные клетки печени и мезенхимоподобные клетки.
Овальные клетки в печени крысы были открыты в середине 1980-х г.г.[2] Происхождение овальных клеток неясно. Возможно, они происходят из клеточных популяций костного мозга[3], но данный факт подвергается сомнению.[4] Массовая продукция овальных клеток происходит при различных поражениях печени. Например, существенное увеличение числа овальных клеток отмечено у больных хроническим гепатитом C, гемохроматозом, алкогольным отравлением печени и напрямую коррелирует с остротой поражения печени.[5] У взрослых грызунов овальные клетки активируются для последующего размножения в том случае, когда блокирована репликация самих гепатоцитов. Способность овальных клеток к дифференцировке в гепатоциты и холангиоциты (бипотенциальная дифференцировка) показана в нескольких исследованиях.[3] Также показана возможность поддерживать размножение данных клеток в условиях in vitro.[3] Недавно из печени взрослых мышей были выделены овальные клетки, способные к бипотенциальной дифференцировке и клональной экспансии в условиях in vitro и in vivo.[6] Эти клетки экспрессировали цитокератин-19 и другие поверхностные маркеры клеток-предшественников печени и при пересадке в иммунодефицитный штамм мышей индуцировали регенерацию данного органа.
Малые гепатоциты впервые описаны и выделены Митакой и соавт.[7] из непаренхимной фракции печени крыс в 1995 г. Малые гепатоциты из печени крыс с искусственным (химически индуцированным) поражением печени или с частичным удалением печени (гепатотектомией) могут быть выделены методом дифференциального центрифугирования.[8] Данные клетки обладают меньшим размером, чем обычные гепатоциты, могут размножаться и превращаться в зрелые гепатоциты в условиях in vitro.[9] Показано, что малые гепатоциты экспрессируют типичные маркеры печеночных клеток- предшественников — альфа-фетопротеин и цитокератины (СК7, СК8 и СК18), что свидетельствует об их теоретической способности к бипотенциальной дифференцировке.[10] Регенеративный потенциал малых гепатоцитов крысы проверен на животных моделях с искусственно вызванным поражением печени: введение данных клеток в воротную вену животным вызывало индукцию репарации в различных участках печени с появлением зрелых гепатоцитов.[10]
Популяция эпителиальных клеток печени была впервые обнаружена у взрослых крыс в 1984 г.[11] Эти клетки имеют репертуар поверхностных маркеров, перекрывающийся, но всё же несколько отличающийся от фенотипа гепатоцитов и дуктальных клеток.[12] Пересадка эпителиальных клеток в печень крыс привела к формированию гепатоцитов, экспрессирующих типичные гепатоцитарные маркеры — альбумин, альфа-1-антитрипсин, тирозиновую трансаминазу и трансферрин. Недавно данная популяция клеток-предшественников была обнаружена и у взрослого человека.[13] Эпителиальные клетки фенотипически отличаются от овальных клеток и могут в условиях in vitro дифференцироваться в гепатоцитоподобные клетки. Опыты по пересадке эпителиальных клеток в печень мышей линии SCID (с врождённым иммунодефицитом) показали способность данных клеток дифференцироваться в гепациты, экспрессирующие альбумин спустя месяц после трансплантации.[13]
Мезенхимоподобные клетки также были получены из зрелой печени человека.[14] Подобно мезенхимальным стволовым клеткам (МСК), данные клетки обладают высоким пролиферативным потенциалом. Наряду с мезенхимальными маркерами (виментин, альфа-актин гладкой мышцы) и маркерами стволовых клеток (Thy-1, CD34), эти клетки экспрессируют гепатоцитарные маркеры (альбумин, CYP3A4, глутатионтрансферазу, СК18) и маркеры дуктальных клеток (CK19).[15] Будучи пересажены в печень иммунодефицитных мышей, образуют мезенхимоподобные функциональные островки человеческой печеночной ткани, вырабатывающие человеческий альбумин, преальбумин и альфа-фетопротеин.[16]
Требуются дальнейшие исследования свойств, условий культивирования и специфических маркеров клеток-предшественников зрелой печени для оценки их регенеративного потенциала и клинического использования.
Стимуляторы регенерации печени
Недавно были обнаружены биологически активные вещества, которые способствуют регенерации печени при травмах и токсических повреждениях. Известны различные подходы к стимуляции регенерации печени при ее повреждениях или массивных резекциях. Предприняты попытки стимулировать регенерацию посредством введения аминокислот, тканевых гидролизатов, витаминов, гормонов, факторов роста[17], например, таких как фактор роста гепатоцитов (HGF), эпидермальный фактор роста (EGF), фактор роста эндотелия сосудов (VEGF), а также стимулирующее вещество из печени (hepatic stimulator substance, HSS).[18][19]
Стимулирующее вещество из печени
Стимулирующее вещество из печени (hepatic stimulator substance, HSS) представляет собой экстракт, полученный из печени после 30 % её резекции. Субстанция, известная как hepatic stimulator substance (HSS), была впервые описана в середине 1970-х годов. Основным действующим веществом в составе HSS считается открытый в 1980—1990 годах белок ALR (augmenter of liver regeneration, продукт гена GFER). Кроме ALR, на регенерацию печени могут также оказывать влияние фактор некроза опухоли, инсулиноподобный фактор роста 1, фактор роста гепатоцитов, эпидермальный фактор роста и другие уже известные и, возможно, еще не идентифицированные гуморальные факторы, содержащиеся в таких препаратах.[20] Известны различные способы получения HSS[21], отличающиеся по вариантам очистки экстрактов регенерирующей печени животных.
Трансплантация печени
Первая в мире пересадка печени была осуществлена американским трансплантологом Томасом Старзлом в 1963 г. в Далласе.[22] Позднее Старзл организовал в Питтсбурге (США) первый в мире центр трансплантологии, ныне носящий его имя. К концу 1980-х годов в Питтсбурге под руководством Т. Старзла выполняли более 500 трансплантаций печени в год. Первый в Европе (и второй в мире) медицинский центр по пересадке печени был создан в 1967 г. в Кембридже (Великобритания). Его возглавил Рой Кэлн.[23]
По мере совершенствования хирургических методов пересадки, открытием новых центров трансплантологии и условий по хранению и транспортировке трансплантируемой печени число операций по пересадке печени неуклонно возрастало. Если в 1997 г. в мире ежегодно проводилось до 8000 операций по пересадке печени, то сейчас это число возросло до 11000, причём на долю США приходится свыше 6000 пересадок и до 4000 — на долю западноевропейских стран. Среди европейских стран ведущую роль в трансплантации печени играют Германия, Великобритания, Франция, Испания и Италия.[24]
В настоящее время в США функционируют 106 центров по пересадке печени[25]. В Европе организован 141 центр, в том числе во Франции — 27, в Испании — 25, в Германии и Италии — по 22, в Великобритании — 7[26].
Несмотря на то, что первая в мире экспериментальная пересадка печени была выполнена в Советском Союзе основоположником мировой трансплантологии В. П. Демиховым в 1948 г.[27], в клиническую практику эта операция в стране была внедрена лишь в 1990 г. В 1990 г. в СССР было выполнено не более 70 трансплантаций печени. Ныне в России регулярные операции по пересадке печени проводятся в пяти медицинских центрах, включая три московских (Московский центр трансплантации печени НИИ скорой помощи имени Н. В. Склифосовского, НИИ трансплантологии и искусственных органов имени академика В. И. Шумакова, Российский научный центр хирургии имени академика Б. В. Петровского) и Центральный научно-исследовательский институт Росздрава в Санкт-Петербурге, центр трансплантации и хирургии печени в Новосибирске. Недавно пересадку печени стали проводить в Екатеринбурге (Областная клиническая больница № 1), Нижнем Новгороде, Белгороде, Красноярске, Кемерово, Иркутске, Барнауле и Самаре.[28]
Несмотря на постоянный рост количества операций по пересадке печени, ежегодная потребность в трансплантации этого жизненно важного органа удовлетворяется в среднем на 50 %. Частота пересадок печени в ведущих странах составляет от 7,1 до 18,2 операции на 1 млн населения. Истинная же потребность в таких операциях сейчас оценивается в 50 на 1 млн населения.[24]
Первые операции по пересадке печени человека не принесли большого успеха, поскольку реципиенты, как правило, умирали в течение первого года после операции из-за отторжения транспланта и развития тяжёлых осложнений. Использование новых хирургических приемов (кавокавального шунтирования и других) и появление нового иммуносупрессанта — циклоспорина А — способствовали экспоненциальному росту количества трансплантаций печени. Циклоспорин А впервые успешно использован при пересадке печени Т. Старзлом в 1980 г.[29], а его широкое клиническое применение разрешено в 1983 г. Благодаря различным нововведениям была значительно увеличена постоперационная продолжительность жизни. По данным Единой системы пересадки органов (UNOS — United Network for Organ Sharing), современное выживание пациентов с пересаженной печенью составляет 85—90 % спустя год после операции и 75—85 % — спустя пять лет.[30] По прогнозам, 58 % реципиентов имеют шансы прожить до 15 лет.[31]
Трансплантация печени является единственным радикальным методом лечения больных с необратимым, прогрессирующим поражением печени, когда другие альтернативные методы лечения отсутствуют. Основным показанием к пересадке печени являются наличие хронического диффузного заболевания печени с прогнозом жизни менее 12 месяцев при условии неэффективности консервативной терапии и паллиативных хирургических методов лечения. Наиболее частой причиной пересадки печени является цирроз печени, вызванный хроническим алкоголизмом, вирусным гепатитом C и аутоиммунным гепатитом (первичный билиарный цирроз). К менее распространённым показаниям к трансплантации относятся необратимые поражения печени вследствие вирусных гепатитов B и D, лекарственных и токсических отравлений, вторичного билиарного цирроза, врождённого фиброза печени, кистозного фиброза печени, наследственных метаболических заболеваний (болезнь Вильсона-Коновалова, синдром Рейе, дефицит альфа-1-антитрипсина, тирозинемия, гликогенозы типа 1 и типа 4, болезнь Неймана-Пика, синдром Криглера-Найяра, семейная гиперхолестеринемия и т. д.).[32]
Пересадка печени является очень дорогостоящей медицинской процедурой. По оценке UNOS, необходимые затраты на стационарное обслуживание и подготовку больного к операции, оплату медперсонала, изъятие и перевозку донорской печени, проведение операции и послеоперационные процедуры в течение первого года составляют 314600 долларов США, а на последующее наблюдение и терапию — до 21900 долларов в год.[33] Для сравнения, в США стоимость аналогичных затрат на единичную пересадку сердца в 2007 г. составила 658800 долл., легкого — 399000 долл., почки — 246000 долл.[34]
Таким образом, хроническая нехватка донорских органов, доступных для трансплантации, длительность ожидания операции (в США срок ожидания в 2006 г. составил в среднем 321 день[35]), срочность операции (донорская печень должна быть пересажена в течение 12 ч) и исключительная дороговизна традиционной пересадки печени создают необходимые предпосылки для поиска альтернативных, более экономичных и эффективных стратегий трансплантации печени.
В настоящее время самым перспективным методом трансплантации печени является трансплантация печени от живого донора (ТПЖД). Он эффективней, проще, безопасней и намного дешевле, чем классическая трансплантация трупной печени, как цельной, так и расщепленной. Суть метода состоит в том, что у донора извлекается, сегодня часто и эндоскопически, то есть малотравматично, левая доля (2, 3, иногда 4 сегмента) печени. ТПЖД дала очень важную возможность родственного донорства — когда донором является родственник реципиента, что значительно упрощает как административные проблемы, так и подбор тканевой совместимости. При этом, благодаря мощной системе регенерации, через 4-6 месяцев печень донора полностью восстанавливает свою массу. Реципиенту донорская доля печени пересаживается либо ортотопически, с удалением собственной печени, либо, реже, гетеротопически, оставляя печень реципиента. При этом, естественно, донорский орган практически не подвергается гипоксии, так как операции у донора и реципиента идут в одной операционной и одновременно.
Биоинженерная печень
Биоинженерную печень, сходную по строению и свойствам с природным органом, ещё предстоит создать, однако активные работы в этом направлении уже ведутся.
Так, в октябре 2010 г. американскими исследователями из Института регенеративной медицины при медицинском центре Университета Уэйк-Форест (Уинстон-Сейлем, штат Северная Каролина) был разработан биоинженерный органоид печени, выращенный на основе биокаркаса из натурального ВКМ из культур клеток-предшественников печени и эндотелиальных клеток человека[36]. Биокаркас печени с сохраненной после децеллюляризации системой кровеносных сосудов был заселён популяциями клеток-предшественников и эндотелиальных клеток через воротную вену. После инкубации биокаркаса в течение недели в специальном биореакторе при непрерывной циркуляции питательной среды было отмечено формирование печеночной ткани с фенотипом и метаболическими характеристиками печени человека. В 2013 году Министерством обороны России было разработано техническое задание на прототип биоинженерной печени.[37]
В марте 2016 года ученым университета Йокогама удалось создать печень, которая может заменить человеческий орган. Клинические испытания предположительно будут проводиться в 2019 году.[38]
Печень в культуре
В гомеровских представлениях печень олицетворяла средоточие жизни в человеческом организме[39]. В древнегреческой мифологии бессмертный Прометей за дарование людям огня был прикован к Кавказскому хребту, куда прилетал гриф (или орёл) и клевал его печень, которая восстанавливалась за последующую ночь. Многие древние народы Средиземноморья и Ближнего Востока практиковали гадание на печени овец и других животных.
У Платона печень считается источником отрицательных эмоций (в первую очередь, гнева, зависти и жадности). В Талмуде печень считается источником злобы, а желчный пузырь — источником противодействия этой злобе.
В фарси, урду и хинди печень (جگر или जिगर или джигар) является образом смелости или сильных чувств. Выражение джан э джигар (дословно: сила моей печени) в урду является одним из выражений нежности. В персидском сленге джигар может обозначать красивого человека или предмет желаний. В зулусском языке понятия «печень» и «храбрость» выражаются одним словом (isibindi).
В языке гбайя (убангийские языки) печень (sèè) является источником человеческих чувств. Выражение «счастье» (dí sèè) дословно переводится как «хорошая печень», а «недовольство» (dáng sèè) — как «плохая печень»; глагол «завидовать» (ʔáá sèè) дословно переводится как «помещать в печень». Также печень в этом языке выражает понятие центра.
В казахском языке печень обозначается словом «бауыр». Этим же словом (слова-омонимы) часто называют родного и близкого человека[40]. Очень распространено обращение «бауырым» (мой родной), как правило, по отношению к человеку, младшему по возрасту. Причём таким образом могут обратиться не только к родственнику, но и к незнакомому человеку мужского пола. Такое обращение часто используется при общении казахов друг с другом, а также чтобы подчеркнуть степень близости (по отношению к земляку, представителю своего рода и т. п.). У казахов есть мужское имя «Бауыржан» (родная душа, в русском варианте иногда пишут «Бауржан»). В частности, так звали Героя Советского Союза, Народного героя Казахстана (Халық Қаһарманы) Бауыржана Момышулы, панфиловца, героического командира батальона во время Обороны Москвы 1941 года.
В русском языке есть выражение «сидеть в печёнках[41]», что означает очень сильно беспокоить или надоедать кому-либо.
В лезгинском языке для обозначения орла и печени используется одно слово — «лекь». Это связано с существовавшим давно обычаем горцев выставлять тела умерших на съедение хищным орлам, которые прежде всего старались добраться до печени покойника. Поэтому лезгины считали, что именно в печени заключается душа человека, которая теперь переходила в тело птицы. Существует гипотеза, что древнегреческий миф о Прометее, которого боги приковали к скале, а орёл ежедневно клевал его печень, является аллегорическим описанием такого обряда погребения горцев[42].
См. также
Примечания
- Robbins and Cotran Pathologic Basis of Disease (англ.). — 7th. — 1999. — P. 101. — ISBN 0-8089-2302-1.
- Evarts R.P., Nagy P., Marsden E., Thorgeirsson S.S. A precursor product relationship exists between oval cells and hepatocytes in rat liver. Carcinogenesis (англ.). — 1987.
- Oh S.H., Witek R.P., Bae S.H., Zheng D., Jung Y., Piscaglia A.C., Petersen B.E. Bone marrow-derived hepatic oval cells differentiate into hepatocytes in 2-acetylaminofluorene/ partial hepatectomy-induced liver regeneration. Gastroenterology (англ.). — 2007.
- Kanazawa Y., Verma I.M. Little evidence of bone marrow-derived hepatocytes in the replacement of injured liver. Proc Natl Acad Sci USA (англ.). — 2003.
- Lowes K.N., Brennan B.A., Yeoh C.C, Olynyk J.K. Oval cell numbers in human chronic liver diseases are directly related to disease severity. Am J Pathol (англ.). — 1999.
- Fougere-Deschatrette C., Imaizumi-Scherrer T., Strick-Marchand H., Morosan S., Charneau P., Kremsdorf D., Faust D.M., Weiss M.C. Plasticity of hepatic cell differentiation: bipotential adult mouse liver clonal cell lines competent to differentiate in vitro and in vivo. Stem Cells (англ.). — 2006.
- Mitaka T., Kojima T., Mizuguchi T., Mochizuki Y. Growth and maturation of small hepatocytes isolated from adult rat liver. Biochem Biophys Res Commun (англ.). — 1995.
- Gordon G.J., Butz G.M., Grisham J.W., Coleman W.B. Isolation, short-term culture, and transplantation of small hepatocyte-like progenitor cells from retrorsine-exposed rats. Transplantation (англ.). — 2002.
- Ikeda S., Mitaka T., Harada K., Sugimoto S., Hirata K., Mochizuki Y. Proliferation of rat small hepatocytes after long-term cryopreservation. J Hepatol (англ.). — 2002.
- Zhang H., Liu Z., Li R., Wang D., Liu W., Li J., Yu H., Zhang F., Dou K. Transplantation of embryonic small hepatocytes induces regeneration of injured liver in adult rat. Transplant Proc (англ.). — 2009.
- Tsao M.S., Smith J.D., Nelson K.G., Grisham J.W. A diploid epithelial cell line from normal adult rat liver with phenotypic properties of 'oval' cells. Exp Cell Res (англ.). — 1984.
- Grisham JW, Coleman WB, Smith GJ. Isolation, culture, and transplantation of rat hepatocytic precursor (stem-like) cells. Proc Soc Exp Biol Med (англ.). — 1993.
- Khuu D.N., Najimi M., Sokal E.M. Epithelial cells with hepatobiliary phenotype: is it another stem cell candidate for healthy adult human liver? World J Gastroenterol (англ.). — 2007.
- Herrera M.B., Bruno S., Buttiglieri S., Tetta C., Gatti S., Deregibus M.C., Bussolati B., Camussi G. Isolation and characterization of a stem cell population from adult human liver. Stem Cells (неопр.). — 2006.
- Tarnowski M., Koryciak-Komarska H., Czekaj P., Sebesta R., Czekaj T.M., Urbanek K., Likus W., Malinowska-Kolodziej I., Plewka D., Nowaczyk-Dura G., Wiaderkiewicz R., Sieron A.L. The comparison of multipotential for differentiation of progenitor mesenchymal-like stem cells obtained from livers of young and old rats. Folia Histochem Cytobiol (неопр.). — 2007.
- Najimi M., Khuu D.N., Lysy P.A., Jazouli N., Abarca J., Sempoux C., Sokal E.M. Adult derived human liver mesenchymal-like cells as a potential progenitors reservoir of hepatocytes? Cell Transplant (англ.). — 2007.
- Michalopoulos G.K., DeFrance M.C. Liver regeneration. Science. 1997; 276(5309): 66-70.
- La Breque D.R. The role of hepatotrophic factors in liver regeneration-a brief review including a preliminary report of the in vitro effects of hepatic regenerative stimulator substance (SS). Yale J. Bio.l Med. 1979; 52(1): 49-60.
- Margeli A.P., Skaltsas S.D., Spiliopoulou C.A., Mykoniatis M.G., Theocharis S.E. Hepatic stimulator substance activity in the liver of thioacetamide-intoxicated rats. Liver. 1999; 19(6): 519—525.
- Куимов А.Н., Жожикашвили А.С., Никифорова А.И. и др. Влияние экстракта из растущей печени на пролиферацию гепатоцитов (экспериментальное исследование) // Анналы хирургической гепатологии. — 2012. — Т. 17, № 4. — С. 66—74. — ISSN 1995-5464.
- Гальперин Э. И., Дюжева Т. Г., Абакумова О. Ю., Платонова Л. В. (2015) Способ получения вещества, стимулирующего регенерацию поврежденной печени. Патент РФ 2548750.
- Starzl T.E., Marchioro T.L., von Kaaulla K.N., Hermann G., Btittain R.S., Waddell W.R. Homotransplantation of the liver in humans. Surg Gynec Obstet. 1963; 117: 659—676
- Calne RY, Williams R. Liver transplantation in man. I. Observations on technique and organization in five cases. Br Med J. 1968; 4: 535—540
- Общество помощи детям с билиарным циррозом печени (недоступная ссылка). Дата обращения: 16 февраля 2012. Архивировано 20 июня 2009 года.
- List of Liver Transplant Hosptials (недоступная ссылка). Дата обращения: 16 февраля 2012. Архивировано 6 марта 2012 года.
- European Liver Transplant Registry — ELTR
- Демихов В. П. Пересадка жизненно важных органов в эксперименте. М.: Медгиз, 1960. — 259 c.
- Медицинский Олимп — Официальный портал Екатеринбурга
- Starzl T.E., Klintmalm G.B., Porter K.A., Iwatsuki S., Schröter G.P. Liver transplantation with use of cyclosporin A and prednisone. N Engl J Med. 1981; 305: 266—269.
- Request Rejected
- Adult Transplant Services — TRANSPLANT — University of Texas Health Science Center — School of Medicine
- Indications and Contraindications for Liver Transplants | University of Maryland Medical Center
- Liver Transplant Costs | California Pacific Medical Center, San Francisco
- How Much Do Organ Transplants Cost? | eHow
- Liver Transplant Waiting List
- Creating Functional Hepatic Tissue in a Bioengineered Human Liver.
- Шифр «Прометей»: Министерству обороны понадобилась биоинженерная печень. https://lenta.ru/articles/2013/02/20/prometeiliver/
- Японские ученые вырастили мини-печень. Риановости. Дата обращения: 17 марта 2016.
- Диссертация на тему «Эволюция представлений о душе в культуре Древней Греции» автореферат по специальности ВАК 24.00.01 — Теория и история культуры | disserCat — электронная б…
- Статья из казахско-русского словаря.
- Статья из русского словаря.
- Десять фактов о кавказских языках // Это Кавказ.