Аммиак
Аммиа́к (нитрид водорода, аммониа́к, химическая формула — NH3) — бинарное неорганическое химическое соединение, состоящее из одной молекулы азота и трёх молекул водорода.
| Аммиак | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Нитрид водорода | ||
| Традиционные названия |
Аммиак аммониак |
||
| Хим. формула | NH3 | ||
| Рац. формула | NH3 | ||
| Физические свойства | |||
| Состояние | Газообразное | ||
| Молярная масса | 17,0306 г/моль | ||
| Плотность | 0,7723 (н. у.) | ||
| Энергия ионизации | 10,18 ± 0,01 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −77,73 °C | ||
| • кипения | −33,34 °C | ||
| • самовоспламенения | 651 ± 1 °C[2] | ||
| Пределы взрываемости | 15 ± 1 об.%[1] | ||
| Критическая точка | 132,25 °C | ||
| Энтальпия | |||
| • образования | −45,94 кДж/моль | ||
| Удельная теплота испарения | 1370 кДж/кг | ||
| Давление пара | 8,5 ± 0,1 атм[1] | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 9,21 ± 0,01[3] | ||
| Растворимость | |||
| • в воде | 89,9 (при 0 °C) | ||
| Классификация | |||
| Рег. номер CAS | [7664-41-7] | ||
| PubChem | 222 | ||
| Рег. номер EINECS | 231-635-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | BO0875000 | ||
| ChEBI | 16134 | ||
| Номер ООН | 1005 | ||
| ChemSpider | 217 | ||
| Безопасность | |||
| Предельная концентрация | 20 мг/м3 | ||
| ЛД50 | 200—1490 мг/кг | ||
| Токсичность | Зарегистрированные препараты аммиака относятся к 4-му классу опасности для человека, обладают общетоксичным действием. | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
При нормальных условиях, аммиак — это бесцветный газ с резким характерным запахом.
Плотность аммиака почти вдвое меньше, чем у воздуха. Токсичен[4], ПДКр.з. составляет 20 мг/м3 — 4-й класс опасности (малоопасные вещества) в соответствии ГОСТ 12.1.007-76. Растворимость аммиака в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — англ. refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство превышает 180 млн тонн.
Молекула аммиака имеет форму треугольной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи ), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония . Несвязывающее двухэлектронное облако строго ориентировано в пространстве, поэтому молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также меньшие плотность, вязкость (в 7 раз меньше вязкости воды), проводимость (почти не проводит электрический ток) и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность водородных связей в жидком аммиаке существенно ниже, чем у воды; а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не даёт возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м3, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — кубические кристаллы.
Химические свойства
- Благодаря наличию неподелённой электронной пары во многих реакциях аммиак выступает как основание Брёнстеда или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
- .
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
- , Ko=1,8⋅10−5.
- Взаимодействуя с кислотами, даёт соответствующие соли аммония:
- .
- Аммиак также способен образовывать с металлами соли — амиды, имиды и нитриды. Соединения, содержащие ионы , называются амидами, — имидами, а — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
- .
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы и , а также молекулы и изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
- .
и в спиртах:
- .
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
- .
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: — нерастворим, — малорастворим, , и — хорошо растворимы.
- При нагревании аммиак разлагается, проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
- (реакция обратима),
- (без катализатора, при повышенной температуре),
- (в присутствии катализатора, при повышенной температуре).
На восстановительной способности основано применение нашатыря для очистки поверхности металла от оксидов при их пайке:
- .
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
- .
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- (гидрохлорид метиламмония).
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя синильную кислоту и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
- ,
- .
- C солями меди и с серебром образует комплексные соли-аммиакаты
- ,
- ,
- ,
- .

История
Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году, который назвал его «щелочной воздух» (англ. alkaline air)[5]. Через одиннадцать лет, в 1785 году К. Бертолле установил точный химический состав аммиака[6]. С того времени в мире начались исследования по получению аммиака из азота и водорода. Аммиак был очень нужен для синтеза соединений азота, поскольку получение их из чилийской селитры ограничивалось постепенным истощением запасов последней. Проблема уменьшения запасов селитры обострилась к концу XIX века. Только в начале XX века удалось изобрести процесс синтеза аммиака, пригодный для промышленности. Это осуществил Ф. Габер, начавший трудиться над этой задачей в 1904 году и к 1909 году создавший небольшой контактный аппарат, в котором использовал повышенное давление (в соответствии с принципом Ле-Шателье) и катализатор из осмия. 2 июля 1909 года Габер устроил испытания аппарата в присутствии К. Боша и А. Митташа, оба — от Баденского анилинового и содового завода (BASF), и получил аммиак. К. Бош к 1911 году создал крупномасштабную версию аппарата для BASF, а затем был построен и 9 сентября 1913 года вступил в строй первый в мире завод по синтезу аммиака, который был расположен в Оппау (ныне район в черте города Людвигсхафен-на-Рейне) и принадлежал BASF. В 1918 году Ф. Габер стал лауреатом Нобелевской премии по химии «за синтез аммиака из составляющих его элементов». В России и СССР первая партия синтетического аммиака была получена в 1928 году на Чернореченском химическом комбинате[7].
Происхождение названия
Аммиак (в европейских языках его название звучит как «аммониак») от др.-греч. hals ammöniakos — название нашатыря, который получали в оазисе Аммониум в Ливийской пустыне[8], расположенном на перекрёстке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали минерал нашатырь (NH4Cl), который при нагревании испаряет аммиак.
Жидкий аммиак
Аммиак сжижается при температуре −36 °С, или комнатной температуре и давлении около 8,5 атмосфер, что делает удобным его хранение и транспортировку в жидком виде (см. аммиакопровод).
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
- .
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л2).
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, , , а также и . В отличие от воды, с жидким аммиаком данные металлы не реагируют, а именно растворяются и могут быть выделены в исходном виде при испарении растворителя. Растворимость щелочных металлов в жидком составляет несколько десятков процентов. В жидком аммиаке также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например, .
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щёлочноземельные — в виде комплексов с аммиаком , обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и .
Растворённый в металл постепенно реагирует с образованием амида:
- .
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион , который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от к . Реакция значительно ускоряется в присутствии даже небольших примесей .
Металлоаммиачные растворы обладают металлической проводимостью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окружённые молекулами . Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам молекулы NH3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
- .
- .
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет () переходит в тёмно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной () в сине-фиолетовую. Наиболее прочные комплексы с образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является важным источником азота для живых организмов. Несмотря на высокое содержание свободного азота в атмосфере (более 75 %), очень мало живых существ способны использовать свободный, нейтральный двухатомный азот атмосферы, газ . Поэтому для включения азота атмосферы в биологический оборот, в частности в синтез аминокислот и нуклеотидов, необходим процесс, который называется «азотфиксацией». Некоторые растения зависят от доступности аммиака и других нитрогенных соединений, образующихся в почве в результате разложения органических (растительных и животных) остатков. Другие, такие как бобовые, используют преимущества симбиоза с азотфиксирующими бактериями (ризобиями), которые способны синтезировать аммиак из атмосферного азота[10] с помощью ферментов, называемых нитрогеназами.
Аммиак является также конечным побочным продуктом метаболизма аминокислот, а именно продуктом их дезаминирования, катализируемого такими ферментами, как глутамат-дегидрогеназа. Экскреция аммиака в неизменённом виде является обычным путём детоксикации аммиака у водных существ (рыбы, водные беспозвоночные, отчасти амфибии). У млекопитающих, включая человека, аммиак обычно быстро превращается в мочевину, которая гораздо менее токсична и, в частности, имеет менее щелочную реакцию и меньшую реакционную способность в качестве восстановителя. Мочевина является основным компонентом сухого остатка мочи. Большинство птиц, пресмыкающихся, насекомых, паукообразных, однако, выделяют в качестве основного нитрогенного остатка не мочевину, а мочевую кислоту.
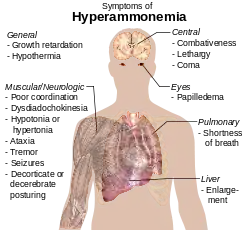
Аммиак также играет важную роль как в нормальной, так и в патологической физиологии животных. Аммиак производится в процессе нормального метаболизма аминокислот, однако весьма токсичен в высоких концентрациях[11]. Печень животных преобразует аммиак в мочевину с помощью серии последовательных реакций, известных как цикл мочевины. Нарушение функции печени, такое, например, какое наблюдается при циррозе печени, может приводить к нарушению способности печени обезвреживать аммиак и образовывать из него мочевину и, как следствие, к повышению уровня аммиака в крови — состоянию, называемому гипераммониемия. К аналогичному результату — повышению уровня свободного аммиака в крови и развитию гипераммониемии — приводит наличие врождённых генетических дефектов в ферментах цикла мочевины, таких, например, как орнитин-карбамилтрансфераза. К тому же результату может приводить нарушение выделительной функции почек при тяжёлой почечной недостаточности и уремии: вследствие задержки выделения мочевины её уровень в крови возрастает настолько, что «цикл мочевины» начинает работать «в обратную сторону» — избыток мочевины гидролизуется обратно почками в аммиак и углекислый газ, и, как следствие, уровень аммиака в крови возрастает. Гипераммониемия привносит свой вклад в нарушения сознания и развитие сопорозных и коматозных состояний при печёночной энцефалопатии и уремии, а также в развитие неврологических нарушений, часто наблюдаемых у больных со врождёнными дефектами ферментов цикла мочевины или с органическими ацидуриями[12].
Менее выраженная, однако клинически существенная, гипераммониемия может наблюдаться при любых процессах, при которых наблюдается повышенный катаболизм белков, например при обширных ожогах, синдроме сдавления или размозжения тканей, обширных гнойно-некротических процессах, гангрене конечностей, сепсисе и т. д., а также при некоторых эндокринных нарушениях, таких как сахарный диабет, тяжёлый тиреотоксикоз. Особенно высока вероятность возникновения гипераммониемии при этих патологических состояниях в тех случаях, когда патологическое состояние, помимо повышенного катаболизма белков, вызывает также выраженное нарушение детоксицирующей функции печени или выделительной функции почек.
Аммиак важен для поддержания нормального кислотно-щелочного баланса крови. После образования аммиака из глютамина альфа-кетоглутарат может быть далее расщеплён с образованием двух молекул гидрокарбоната, которые затем могут использоваться как буфер для нейтрализации кислот, поступающих с пищей. Полученный из глютамина аммиак затем выделяется с мочой (как непосредственно, так и в виде мочевины), что, с учётом образования двух молекул бикарбоната из кетоглутарата, приводит в сумме к потере кислот и сдвигу pH крови в щелочную сторону. Кроме того, аммиак может диффундировать через почечные канальцы, соединяться с ионом водорода и экскретироваться совместно с ним () и тем самым ещё больше способствовать выведению кислот из организма[13].
Аммиак и ионы аммония являются токсическим побочным продуктом метаболизма у животных. У рыб и водных беспозвоночных аммиак выделяется непосредственно в воду. У млекопитающих (включая водных млекопитающих), земноводных и у акул аммиак в цикле мочевины преобразуется в мочевину, поскольку мочевина гораздо менее токсична, менее химически реакционноспособна и может более эффективно «храниться» в организме до момента возможности её выделения. У птиц и пресмыкающихся (рептилий) аммиак, образовавшийся в процессе метаболизма, преобразуется в мочевую кислоту, которая является твёрдым остатком и может быть выделена с минимальными потерями воды[14].
Поскольку аммиак образуется при гниении белка, наличие его в природных водах служит признаком их загрязнённости[15].
Физиологическое действие и токсикология

Аммиак относится к токсичным веществам[16], по ГОСТ 12.1.007-76 его относят к 4-му уровню опасности.
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы[17]. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³[18].
Предельно допустимая концентрация аммиака в воздухе рабочей зоны производственного помещения (ПДКр.з.) составляет 20 мг/м3 [19]. В атмосферном воздухе населённых пунктов и в жилых помещениях среднесуточная концентрация аммиака (ПДКс.с.) не должна превышать 0,04 мг/м3 [20]. Максимальная разовая концентрация в атмосфере — 0,2 мг/м3. Таким образом, ощущение запаха аммиака свидетельствует о превышении допустимых норм.
Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м3, глаз — 490 мг/м3. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м3 — эритематозный, 21 г/м3 и более — буллёзный дерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м3. Кратковременное воздействие аммиака в концентрации 3,5 г/м3 и более быстро приводит к развитию общетоксических эффектов.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м3) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Туркестанской (ранее — Южно-Казахстанской) области Казахстана[21].
Применение
В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты (контактным методом), соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717) (см. Аммиачная холодильная установка).
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5—1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипячёной воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Противоморозная добавка для сухих строительных растворов, относящаяся к ускорителям. Рекомендуемая дозировка — 2…8 % массы компонентов сухой смеси в зависимости от температуры применения. Аммиачная вода — продукт, представляющий собой газообразный аммиак , растворённый в воде.
В цветоводстве пары нашатырного спирта используются для изменения окраски цветов. Например, голубые и синие лепестки становятся зелёными, ярко-красные — чёрными[22]. Некоторые цветы, такие как астры, не имеющие запаха от природы, после обработки аммиаком приобретают приятный аромат[22].
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
- + 91,84 кДж.
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит, и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Выход аммиака (в объёмных процентах) за один проход катализатора при различных температурах и давлении имеет следующие значения[23]:
100 ат 300 ат 1000 ат 1500 ат 2000 ат 3500 ат 400 °C 25,12 47,00 79,82 88,54 93,07 97,73 450 °C 16,43 35,82 69,69 84,07 89,83 97,18 500 °C 10,61 26,44 57,47 Нет данных 550 °C 6,82 19,13 41,16
Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
- .
Обычно лабораторным способом аммиак получают слабым нагреванием смеси хлорида аммония с гашёной известью.
- .
Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление (при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер)[24]. В промышленности аммиак осушают в абсорбционных колоннах.
Расходные нормы на тонну аммиака
На производство одной тонны аммиака в России на 2007 год расходуется в среднем 1200 н.м3 природного газа, в Европе — 900 н.м3 [25] [26][27][28][29].
Белорусский «Гродно Азот» расходует 1200 н.м3 природного газа на тонну аммиака, после модернизации ожидается снижение расхода до 876 н.м3[30].
Украинские производители потребляют от 750 н.м3[31] до 1170 н.м3[32] природного газа на тонну аммиака.
По технологии UHDE заявляется потребление 6,7—7,4 Гкал энергоресурсов на тонну аммиака[33].
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт.
Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания.
Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов.
При случайном поражении аммиаком слизистой оболочки глаза промыть глаза водой (по 15 раз через каждые 10 мин) или 5 % раствором борной кислоты, не растирая глаза. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приёма внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка.
Взаимодействие с другими лекарственными средствами малоизученно.
Производители аммиака
Производители аммиака в России
Компания 2006, тыс. т 2007, тыс. т ОАО «Тольяттиазот» 2634 2 403,3 ОАО НАК «Азот» 1526 1 514,8 ОАО «Акрон» 1526 1 114,2 ОАО «Невинномысский азот», г. Невинномысск 1065 1 087,2 ОАО «Минудобрения» (г. Россошь) 959 986,2 ОАО «АЗОТ» г. Кемерово 854 957,3 ОАО «Азот»[прояснить] 869 920,1 ОАО «ЗМУ КЧХК» 956 881,1 ОАО Череповецкий «Азот» 936 790,6 ЗАО «Куйбышевазот» 506 570,4 ОАО «Газпром Нефтехим Салават» 492 512,8 «Минеральные удобрения» (г. Пермь) 437 474,6 ОАО «Дорогобуж» 444 473,9 ОАО «Воскресенские минеральные удобрения» 175 205,3 ОАО «Щекиноазот» 58 61,1 АО «Аммоний» (г. Менделеевск) — — Итого 13 437 12 952,9
На долю России приходится около 9 % мирового выпуска аммиака. Россия — один из крупнейших мировых экспортёров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
По итогам 2014 года в России было произведено 14,8 млн тонн аммиака (+2 % к 2013 году) (по данным Росстата). Производство аммиака в России сконцентрировано в Приволжском федеральном округе (46 % по итогам 2014 года). Далее следуют Центральный федеральный округ (23 %) и Северо-Западный федеральный округ (16 %).
Порядка 25 % российского производства аммиака отправляется на экспорт. Так, в 2014 году объём российского экспорта аммиака (по данным ФТС) составил 3,6 млн тонн (+6 % к 2013 году) на сумму 1,6 млрд долл. США.
Ключевыми странами-получателями в 2014 году стали Украина, Финляндия и Литва[34].
Производители аммиака на Украине
Компания 2008 ПАО «Концерн Стирол» 1331 Одесский припортовый завод 1128 Северодонецкое объединение Азот 1015 «Азот» (Черкассы) 778 «Днепроазот» 515 «Ровноазот» 382 Итого 5149
См. также
Примечания
- http://www.cdc.gov/niosh/npg/npgd0028.html
- http://www.cdc.gov/niosh/ipcsneng/neng0414.html
- Hall H. K. Correlation of the Base Strengths of Amines 1 (англ.) // J. Am. Chem. Soc. / P. J. Stang — American Chemical Society, 1957. — Vol. 79, Iss. 20. — P. 5441—5444. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01577A030
- name=https://docs.cntd.ru_Аммиак
- Priestley, Joseph. Observations on Alkaline Air // Experiments and Observations on Different Kinds of Air (англ.). — Second edition. — 1775. — Vol. I. — P. 163—177.
- Berthollet. Analyse de'l Alkali volatil (фр.) // Histoire de l'Académie Royale des Sciences. Année M. DCCLXXXV. Avec les Mémoires de Mathématique & de Physique pour la même Année. — 1788. — P. 316—326.
- Малина И.К. Синтез аммиака // Книга для чтения по неорганической химии. Пособие для учащихся. Ч. II. — М.: Просвещение, 1975. — С. 52—62.
- Словарь иностранных слов. — М.: «Русский язык», 1989. — 624 с. ISBN 5-200-00408-8
- Karl S. Roth, MD. Hyperammonemia (англ.). Medscape (31 мая 2007). Дата обращения: 7 июля 2009. Архивировано 23 декабря 2008 года.
- M. B. Adjei, K. H. Quesenberry, C. G. Chamblis. Nitrogen Fixation and Inoculation of Forage Legumes (англ.). University of Florida IFAS Extension (июнь 2002). Архивировано 20 мая 2007 года.
- PubChem Substance Summary (англ.). Дата обращения: 7 июля 2009.
- Johannes Zschocke, Georg Hoffman. Vademecum Metabolism (нем.). — Friedrichsdorf, Germany: Milupa GmbH, 2004.
- Burton D. Rose, Helmut G. Rennke. Renal Pathophysiology (англ.). — Baltimore: Williams & Wilkins, 1994. — ISBN 0-683-07354-0.
- Neil A. Campbell, Jane B. Reece. 44 // Biology (англ.). — 6th ed.. — San Francisco: Pearson Education, 2002. — P. 937—938. — 1175 p. — ISBN 0-8053-6624-5. — ISBN 978-0805366242.
- Белки гниение
- name=https://docs.cntd.ru_base.safework.ru_Аммиак
- Фердман Д. Л., Лепахин В. К., Марченко Е. Н., Швайкова М. Д. Аммиак // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1974. — Т. 1. А — Антибиоз. — 576 с. — 150 000 экз.
- Учебное пособие по РХБЗ. Характеристика аварийно химически опасных веществ (недоступная ссылка). rhbz.info. Дата обращения: 28 марта 2021. Архивировано 30 декабря 2011 года.
- ГОСТ 12.1.005-88. Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
- СанПиН 2.1.2.1002-00. Санитарно-эпидемиологические требования к жилым зданиям и помещениям
- Пётр Образцов. Хорошо, что аммиака у нас мало. Плохо, что мало и коров. Известия (30 июня 2009). Дата обращения: 28 марта 2021.
- Искусственное изменение окраски лепестков цветов. Удивительный мир растений. Дата обращения: 28 марта 2021.
- Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 19. Взаимодействие азота с водородом // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 38—41. — 2 350 000 экз.
- Гордон А., Форд Р. Спутник химика / Пер. с англ. Розенберга Е. Л., Коппель С. И.. — М.: Мир, 1976. — 544 с.
- ФАКТОРЫ КОНКУРЕНТНОСТИ НА РЫНКЕ АММИАЧНО-НИТРАТНЫХ УДОБРЕНИЙ.
- АММИАЧНЫЕ УСТАНОВКИ НА РОССИЙСКИХ ПРЕДПРИЯТИЯХ.
- ПРОИЗВОДИТЕЛИ АММИАКА И КАРБАМИДА В РОССИИ (Часть I).
- ПРОИЗВОДИТЕЛИ АММИАКА И КАРБАМИДА В РОССИИ (Часть II).
- ПРОИЗВОДИТЕЛИ АММИАКА И КАРБАМИДА В РОССИИ (Часть III).
- Лукашенко потребовал ускорить модернизацию «Гродно Азота». 21.by.
- Селитра аммиачная 095-2471996: Удар по гривне.
- Селитра аммиачная 095-2471996: Наши химики — впереди российских.
- Технология производства аммиака (недоступная ссылка). Дата обращения: 16 августа 2011. Архивировано 13 июня 2013 года.
- Четверть российского аммиака уходит на экспорт (недоступная ссылка). Архивировано 4 марта 2016 года.
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
- Акимова Л. Д. Изучающим основы холодильной техники. — М., 1996.
- Ельницкий А. П., Василевская Е. И., Шарапа Е. И., Шиманович И. Е. Химия. — Мн.: Народная асвета, 2007.
Ссылки
- Аммиак, газ // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Аммиак водный // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Аммониак // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Аммониемия // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Ammonia (англ.). NIST Chemistry WebBook. U.S. Secretary of Commerce on behalf of the United States of America. Дата обращения: 28 марта 2021.