Кинетопласт
Кинетопла́ст (англ. kinetoplast) — сеть молекул кольцевых ДНК (кДНК), находящаяся в гигантских митохондриях и содержащая множество копий митохондриального генома[1][2]. Чаще всего кинетопласт имеет форму диска, хотя из этого правила известны и исключения. Кинетопласт имеется только у простейших класса кинетопластиды. Вариации структуры кинетопласта могут отражать филогенетические связи внутри кинетопластид[3]. Кинетопласт обычно находится вблизи базального тельца жгутика, поэтому, вероятно, прочно связан с цитоскелетом. Кинетопласт можно легко визуализировать в клетках при помощи окрашивания DAPI[4].
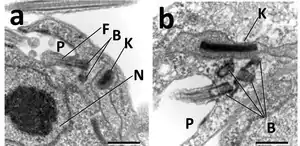
Структура
Кинетопласт содержит ДНК в двух формах: миникольца и максикольца. Максикольца содержат от 20 до 40 тысяч пар оснований (килобаз, кб) и имеются в кинетопласте в числе нескольких десятков. Один кинетопласт содержит несколько тысяч миниколец, содержащих 0,5—1 кб. Максикольца кодируют белки, необходимые для функционирования гигантской митохондрии, в которой находится кинетопласт. Единственная известная на данный момент функция миниколец заключается в регуляции экспрессии максиколец путём образования направляющих РНК. Максикольца и миникольца катенированы друг с другом, образуя плоскую сеть, похожую на кольчугу. При репликации кДНК сначала происходит разъединение колец, а в дочерних кинетопластах они снова катенируются[4][5]. Структура кДНК наиболее изучена у Crithidia fasciculata, которая представляет собой катенированный диск из мини- и максиколец, большинство из которых не сверхспирализованы[3]. С внешней стороны к кДНК непосредственно примыкают два белковых комплекса, повернутые на 180° относительно друг друга и участвующие в репликации миниколец[1][2][4][5].
У разных представителей кинетопластид кинетопласт и его ДНК имеют разное строение. Известны следующие варианты, отличающиеся от описанной выше типичной схемы[3]:
- про-кДНК: кинетопласт представляет собой вытянутую, похожую на пучок нитей структуру, расположенную в матриксе митохондрии проксимальнее базального тельца жгутика. В противоположность типичному строению кДНК, лишь небольшой процент колец зацеплены друг за друга. При этом мини- и максикольца находятся в расслабленном (не суперскрученном) состоянии. Такое строение описано у Bodo saltans, Bodo designis, Procryptobia sorokini syn. Bodo sorokini, Rhynchomonas nasuta и Cephalothamnium cyclopi[3];
- поли-кДНК: строение кинетопласта сходно с предыдущим вариантом, содержит мало сцепленных колец и не содержит суперскрученных. Отличительная особенность — этот тип кинетопласта не представляет собой единого тельца, а распределен в виде отдельных скоплений ДНК по всему матриксу митохондрии. Этот вариант обнаружен у Dimastigella trypaniformis (комменсала, живущего в кишечнике термитов), Dismastigella mimosa (свободноживущей кинетопластиды) и Cruzella marina (паразит кишечника асцидий)[3];
- пан-кДНК: как и предыдущие типы, содержит небольшой процент сцепленных колец, но может содержать сверхспирализованные миникольца. Пан-кДНК занимает почти весь митохондриальный матрикс, а не разбросана по нему в виде отдельных скоплений. Обнаружена у Cryptobia helicis (паразит, обитающий в семяприёмнике улиток), Bodo caudatus и Cryptobia branchialis (паразит рыб);
- мега-кДНК: распределена равномерно по матриксу митохондрии, при этом не содержит миниколец. Последовательности, сходные с таковыми миниколец других кинетопластов, тандемно объединены в более крупные молекулы длиной около 200 кб. Мега-кДНК или сходные по структуре варианты обнаружены у Trypanoplasme borreli (паразит рыб) и Jarrellia sp. (паразит китов)[3].
Репликация
Удвоение кинетопласта происходит одновременно с удвоением соседнего жгутика сразу перед началом репликации ядерной ДНК. В типичном кинетопласте (как у Crithidia fasciculata) инициация репликации происходит при размыкании миниколец кДНК топоизомеразой II. Свободные миникольца выходят в пространство между кинетопластом и внутренней митохондриальной мембраной, известное как кинетофлагеллярная зона[2][3][5]. Далее миникольца посредством неизвестного механизма перемещаются в противоположно расположенные антиподиальные белковые комплексы, которые содержат эндонуклеазу, хеликазу, ДНК-полимеразу, ДНК-праймазу и ДНК-лигазу, которые устраняют ошибки репликации в только что удвоенных миникольцах[4]. Только что реплицированные миникольца можно отличить от зрелых миниколец по наличию узкой щели. Миникольца, не подвергавшиеся удвоению, остаются ковалентно замкнутыми. Сразу после репликации все новоудвоенные миникольца присоединяются к сети кДНК, и их щели частично репарируются[1][5].
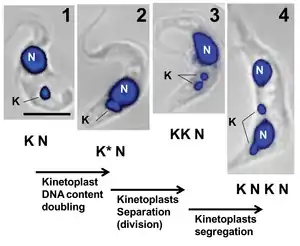
Пока продолжается репликация миниколец, сеть кДНК непрерывно вращается вокруг центральной оси диска, чтобы не допустить присоединения новых миниколец к материнскому кинетопласту. Считается, что вращение непосредственно связывается с удвоением соседнего жгутика, поскольку дочернее базальное тельце вращается вокруг материнского в такт с вращением кинетопласта. Благодаря вращению миникольца дочернего кинетопласта соединяются в спираль и постепенно смещаются к центру диска, по мере того как другие миникольца отщепляются от материнской кДНК и отправляются в кинетофлагеллярную зону для репликации[2][4][5].
Механизм удвоения максиколец не изучен так подробно, как миниколец. Удалось выявить структуру под названием nabelschnur (с немецкого «пуповина»), которая связывает дочернюю кДНК с исходной до их разделения. С помощью FISH удалось доказать, что nabelschnur состоит из максиколец кДНК[4].
В процессе репликации кинетопласта выделяют пять стадий, каждая из которых связана с удвоением соседнего жгутика. 1. Стадия I. Кинетопласт не начал реплицироваться, в нём нет антиподиальных белковых комплексов. 2. Стадия II. В кинетопласте начинают выявляться антиподиальные комплексы. Начинается удвоение базального тельца жгутика. 3. Стадия III. Начинается отделение нового жгутика, кинетопласт приобретает двухчастный облик. 4. Стадия IV. Дочерние кинетопласты практически разделены и связываются только nabelschnur. 5. Стадия V. Дочерние кинетопласты окончательно разъединяются, nabelschnur разрушается. Структура кинетопластов идентична таковой на первой стадии[4].
Репарация
Trypanosoma cruzi способна осуществлять репарацию нуклеотидов и в ядерной ДНК, и в кДНК, которые были повреждены активными формами кислорода, образовавшимися в организме хозяина в ходе инфекции[6]. ДНК-полимераза β клеток T. cruzi устраняет окислительные повреждения ДНК с помощью эксцизионной репарации оснований. Вероятно, этот фермент устраняет окислительные повреждения кДНК, вызванные генотоксическим стрессом, во время её репликации[6].
Примечания
- Shapiro T. A., Englund P. T. The structure and replication of kinetoplast DNA. (англ.) // Annual Review Of Microbiology. — 1995. — Vol. 49. — P. 117—143. — doi:10.1146/annurev.mi.49.100195.001001. — PMID 8561456.
- Shlomai J. The structure and replication of kinetoplast DNA. (англ.) // Current Molecular Medicine. — 2004. — September (vol. 4, no. 6). — P. 623—647. — PMID 15357213.
- Lukes J., Guilbride D. L., Votýpka J., Zíková A., Benne R., Englund P. T. Kinetoplast DNA network: evolution of an improbable structure. (англ.) // Eukaryotic Cell. — 2002. — August (vol. 1, no. 4). — P. 495—502. — PMID 12455998.
- Gluenz E., Povelones M. L., Englund P. T., Gull K. The Kinetoplast Duplication Cycle in Trypanosoma brucei Is Orchestrated by Cytoskeleton-Mediated Cell Morphogenesis (англ.) // Molecular and Cellular Biology. — 2010. — 20 December (vol. 31, no. 5). — P. 1012—1021. — ISSN 0270-7306. — doi:10.1128/MCB.01176-10.
- Torri, A., et al. DNA Replication in Eukaryotic Cells. Cold Spring Harbor Laboratory Press. 1996. pages=1029-42. ISBN 0-87969-459-9
- Schamber-Reis B. L., Nardelli S., Régis-Silva C. G., Campos P. C., Cerqueira P. G., Lima S. A., Franco G. R., Macedo A. M., Pena S. D., Cazaux C., Hoffmann J. S., Motta M. C., Schenkman S., Teixeira S. M., Machado C. R. DNA polymerase beta from Trypanosoma cruzi is involved in kinetoplast DNA replication and repair of oxidative lesions. (англ.) // Molecular And Biochemical Parasitology. — 2012. — June (vol. 183, no. 2). — P. 122—131. — doi:10.1016/j.molbiopara.2012.02.007. — PMID 22369885.