Митохондриальный матрикс
Митохондриа́льный ма́трикс или просто ма́трикс — ограниченное внутренней мембраной пространство, расположенное внутри митохондрий. Слово «матрикс» происходит из того, что эта среда является намного более вязкой по сравнению с более водянистой цитоплазмой. В состав матрикса входит множество веществ, включая ферменты, митохондриальную ДНК (кольцевая), рибосомы, малые органические молекулы, нуклеотидные коферменты и неорганические ионы. Ферменты матрикса содействуют реакциям биохимических процессов, в ходе которых синтезируется АТФ, таких как цикл трикарбоновых кислот, окислительное фосфорилирование, окисление пирувата и бета-окисление жирных кислот[1].

Состав и структура среды матрикса способствуют оптимальному протеканию реакций анаболических и катаболических путей. Цепь переноса электронов и ферменты в матриксе играют большую роль в цикле трикарбоновых кислот и окислительного фосфорилирования. В цикле трикарбоновых электроны передаются молекулам NADH и FADH2, которые в дальнейшем переносятся на дыхательную цепь[2], где в ходе реакций окислительного фосфорилирования образуется АТФ[3][4].
Структура и состав
Митохондриальный матрикс представляет собой тонкозернистое гомогенное содержимое умеренной плотности, заполняющее внутренний компартмент, в нём иногда выявляются тонкие собранные в клубок нити (около 2-3 нм) и гранулы около 15-20 нм. Известно, что нити митохондрий представляют собой молекулы ДНК в составе митохондриального нуклеоида, а мелкие гранулы — митохондриальные рибосомы. Кроме того в матриксе имеются довольно крупные (20-40 нм) гранулы, это места отложений солей магния и кальция[5](что отличает митохондрии от других органелл)[6]. Митохондриальный матрикс имеет рН около 7,8[7].
Метаболиты
Матрикс включает в себя большое количество разнообразных метаболитов, участвующих в различных биохимических процессах. Так например, для ЦТК это все его компоненты от пирувата до цитрата, ацетил-CoA и т.д[3]. Цикл мочевины использует орнитин, карбамоил фосфат и цитруллин. Это и нуклеотидные коферменты, которые окисляются в дыхательной цепи — NADH и FADH2. Синтез белка использует молекулы митохондриальной ДНК, РНК и тРНК. Регулирование процессов выполняются ионами (Са2+/K+/Mg2+). К дополнительным метаболитам, присутствующих в матриксе относят: СО2, Н2О, О2, АТФ, АДФ и неорганический фосфат Pi.
Ферменты
В матриксе локализуются многие ферменты. Все ферменты катализирующие ЦТК: Пируватдегидрогеназа, цитратсинтаза, аконитаза, изоцитратдегидрогеназа, α-кетоглутарат дегидрогеназа, сукцинил-CoA-синтаза, фумараза и малатдегидрогеназа[3]. Цикл мочевины использует карбамоил фосфат синтазу I и орнитин-транскарбамилазу. В процессе бета-окисления участвуют: пируваткарбоксилаза, ацил-СоА-дегидрогеназы, β-кетотиолаза. Генерация аминокислот способствует работе трансаминаз.
Компоненты внутренней мембраны
Внутренняя мембрана представляет собой фосфолипидный бислой, содержащий комплексы окислительного фосфорилирования, входящие в состав дыхательной цепи и локализованных на кристах. Дыхательная цепь включает в себя IV белковых комплексов и АТФ-синтазу. Эти белковые комплексы имеют следующий состав: белковый комплекс I (NADH: Кофермент Q оксидоредуктаза) , белковый комплекс II (сукцинат: кофермент Q оксидоредуктаза), белковый комплекс III (кофермент Q: цитохром С оксидоредуктаза) и белковый комплекс IV (цитохром с-оксидаза).
Контроль внутренней мембраны над составом матрикса
Цепь переноса электронов отвечает за регулирование оптимальных значений рН и поддержания электрохимического градиента, который облегчает генерацию АТФ, посредством прокачки протонов. Градиент также обеспечивает контроль над концентрацией ионов, таких, как, например, ионы кальция — Са2+, управляемых мембранным потенциалом митохондрий. Внутренняя мембрана непроницаема для многих соединений, и позволяет проникать только неполярным веществам с малой молекулярной массой — O2, CO2 или имеющих небольшой заряд на молекулах, таких, как вода. Остальные молекулы входят и выходят из митохондриального матрикса посредством транспортных белков и ионных транспортёров. Чтобы покинуть митохондрии, молекулы проходят через порины[8]. Эти приписанные характеристики позволяют осуществлять контроль над концентрацией ионов и метаболитов, необходимые для регулирования и определяют скорость генерации АТФ[9][10].
Биохимические процессы
В матриксе происходят различные биохимические процессы.
Бета-окисление
Бета-окисление — метаболический процесс деградации жирных кислот, при котором от карбоксильного конца жирной кислоты (-COOH) последовательно отделяется по 2 атома углерода в виде ацетил-CoA. Процесс β-окисления — назван так потому, что реакции окисления жирной кислоты происходят у β-углеродного атома (С3-положение). Реакции β-окисления и последующего окисления ацетил-CoA в ЦТК служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования[11]. β-Окисление жирных кислот происходит только в аэробных условиях.
Этот процесс генерирует большое количество энергии, запасаемых в виде молекул АТФ.
Окислительное фосфорилирование
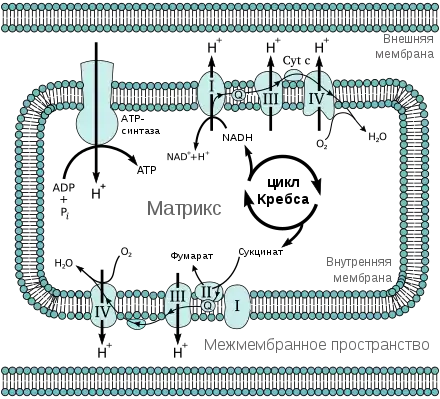
Трансаминирование
В матриксе α-кетоглутарат и оксалоацетат, в результате процесса трансаминирования могут быть превращены в соответствующие аминокислоты. Реакции катализируются ферментами трансаминазами. Трансаминирование α-кетоглутарата приводит к образованию глутамата, пролина и аргинина. Эти аминокислоты затем используются либо внутри матрикса, либо транспортируются в цитозоль, где участвуют в процессе синтеза белков[12][13].
Регуляция
Регуляция в матриксе происходит путём контроля над концентрацией ионов, концентрацией метаболитов и заряда энергии. Наличие ионов, таких как Са2+ управляют различными функциями ЦТК. В матриксе, под действие этих ионов активируются пируватдегидрогеназа, изоцитратдегидрогеназа и альфа-кетоглутарат-дегидрогеназа, которые увеличивают скорость реакций в цикле. Концентрация промежуточных продуктов и коферментов в матриксе также увеличивают или уменьшают скорость генерации АТФ за счёт анаплеротических и катаплеротических эффектов. NADH может выступать в качестве ингибитора для α-кетоглутарата, изоцитратдегидрогеназы, цитрат-синтазы, и пируватдегидрогеназы. Концентрация оксалоацетата в частности поддерживается на низком уровне, так что любые колебания этих концентраций служат для приведения в действие цикла Кребса. Генерация АТФ также служит в качестве средства регулирования, действуя как ингибитор для изоцитратдегидрогеназы, пируватдегидрогеназного комплекса, белковых комплексов электронтранспортной цепи и АТФ-синтазы. В то время как АДФ действует в качестве активатора[1].
Синтез белка
Митохондрии содержит свой собственный набор ДНК, используемой для синтеза белков, которые входят в состав ЭТЦ. Митохондриальная ДНК кодирует только около тринадцати белков, которые используются при обработке митохондриальных транскриптов, рибосомных белков, рибосомальной РНК, переноса РНК и белковых субъединиц, найденных в белковых комплексах электронтранспортной цепи[14][15].
См. также
Примечания
- Voet, Donald; Voet, Judith; Pratt, Charlotte. Fundamentals of Biochemistry Life at the Molecular Level (англ.). — New York City: John Wiley & Sons, Inc., 2013. — P. 582—584. — ISBN 1118129180.
- Кольман, Рём, 2012, с. 138.
- Stryer, L; Berg, J; Tymoczko, J. L. Biochemistry (неопр.). — San Francisco: W.H. Freeman, 2002. — С. 509—527, 569—579, 614—616, 638—641, 732—735, 739—748, 770—773. — ISBN 0-7167-4684-0.
- Mitchell, Peter; Moyle, Jennifer. Chemiosmotic Hypothesis of Oxidative Phosphorylation (англ.) // Nature : journal. — 1967. — 14 January (vol. 213, no. 5072). — P. 137—139. — doi:10.1038/213137a0.
- Ченцов Ю.С. Введение в клеточную биологию. — М.: Академкнига, 2004. — С. 333. — 495 с. — ISBN 5-94628-105-4.
- Быков В.Л. Цитология и общая гистология. — Санкт-Петербург: СОТИС, 2002. — С. 63. — 520 с.
- Porcelli, Anna Maria; Ghelli, Anna; Zanna, Claudia; Pinton, Paolo; Rizzuto, Rosario; Rugolo, Michela. pH difference across the outer mitochondrial membrane measured with a green fluorescent protein mutant (англ.) // Biochemical and Biophysical Research Communications : journal. — 2005. — 28 January (vol. 326, no. 4). — P. 799—804. — doi:10.1016/j.bbrc.2004.11.105.
- Alberts, Bruce; Johnson, Alexander; Lewis, julian; Roberts, Keith; Peters, Walter; Raff, Martin. Molecular Biology of the Cell (неопр.). — New york: Garland Publishing Inc, 1994. — ISBN 0-8153-3218-1.
- Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R.; Drouin, J.; Eperon, I. C.; Nierlich, D. P.; Roe, B. A. Sequence and organization of the human mitochondrial genome (англ.) // Nature : journal. — 1981. — 9 April (vol. 290, no. 5806). — P. 457—465. — doi:10.1038/290457a0.
- Iuchi, S.; Lin, E. C. C. Adaptation of Escherichia coli to redox environments by gene expression (англ.) // Molecular Microbiology : journal. — 1993. — 1 July (vol. 9, no. 1). — P. 9—15. — ISSN 1365-2958. — doi:10.1111/j.1365-2958.1993.tb01664.x.
- Е.С. Северин. Биохимия. — М.: ГЭОТАР-МЕД, 2004. — 779 с. — ISBN 5-9231-0254-4.
- Karmen, A.; Wroblewski, F.; Ladue, J. S. Transaminase activity in human blood (англ.) // The Journal of Clinical Investigation : journal. — 1955. — 1 January (vol. 34, no. 1). — P. 126—131. — ISSN 0021-9738. — doi:10.1172/JCI103055. — PMID 13221663.
- Kirsch, Jack F.; Eichele, Gregor; Ford, Geoffrey C.; Vincent, Michael G.; Jansonius, Johan N.; Gehring, Heinz; Christen, Philipp. Mechanism of action of aspartate aminotransferase proposed on the basis of its spatial structure (англ.) // Journal of Molecular Biology : journal. — 1984. — 15 April (vol. 174, no. 3). — P. 497—525. — doi:10.1016/0022-2836(84)90333-4. — PMID 6143829.
- Fox, Thomas D. Mitochondrial Protein Synthesis, Import, and Assembly (англ.) // Genetics : journal. — 2012. — 1 December (vol. 192, no. 4). — P. 1203—1234. — ISSN 0016-6731. — doi:10.1534/genetics.112.141267. — PMID 23212899.
- Grivell, L.A.; Pel, H.J. Protein synthesis in mitochondria (англ.) // Mol. Biol. Rep. : journal. — Swammerdam Institute for Life Sciences, 1994. — No. 19.
Литература
- Кольман Я., Рём К.-Г. . Наглядная биохимия. 4-е изд. — М.: БИНОМ. Лаборатория знаний, 2012. — 469 с. — ISBN 978-5-9963-0620-6.