Параспеклы
Параспе́клы (англ. Paraspeckles), или паракрапинки, — класс ядерных телец, располагающихся в интерхроматиновом пространстве клеточного ядра в клетках млекопитающих. Они состоят из белков и РНК и формируются при взаимодействии длинной некодирующей РНК, известной как NEAT1/Men ε/β, и белков семейства DBHS (от англ. Drosophila Behavior Human Splicing), а именно P54NRB/NONO, PSPC1 и PSF/SFPQ. Параспеклы играют важную роль в регуляции экспрессии генов, обеспечивая удержание в ядре молекул РНК, содержащих двуцепочечные участки и подвергшихся редактированию аденозин → инозин (A → I). Регулируя экспрессию генов, параспеклы оказываются вовлечёнными в такие процессы, как дифференцировка клеток, ответ на стресс и протекание вирусных инфекций[1]. Имеются данные о связи параспекл с раком и заболеваниями нервной системы[2].
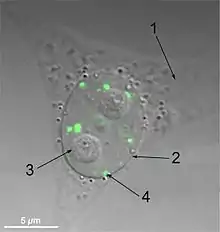
1. цитоплазма;
2. ядро;
3. ядрышко;
4. параспеклы
История изучения
Параспеклы были открыты в 2002 году Андерсеном и коллегами в ходе изучения протеома очищенных ядрышек клеток человека с помощью масс-спектрометрии. В ходе исследования был выделен 271 белок, из которых 30 % оказались ранее неизвестными. Более детальное изучение одного из этих новооткрытых белков показало, что он вовсе не накапливается в ядрышках, а располагается в нуклеоплазме диффузно, но сильно концентрируется в 5—20 ядерных фокусах. Оказалось, что эти фокусы не перекрываются ни с одним из ранее известных ядерных телец, и они получили название «параспеклы» из-за расположения вблизи других ядерных телец — спекл. Сам же белок получил название PSPC1 (от англ. Paraspeckle Protein 1)[1].
Структура
Параспеклы — это мелкие тельца неправильной формы. В зависимости от типа клеток обычно в ядре имеется от 5 до 20 параспекл. Изучение с помощью электронной и флуоресцентной микроскопии показало, что параспеклы человека имеют ширину около 360 нм (у мыши чуть меньше) и длину от 1 до 2 мкм. Достоверно существование параспекл показано только для клеток млекопитающих. У человека параспеклы отсутствуют в эмбриональных стволовых клетках и индуцированных плюрипотентных стволовых клетках. Ортологи ключевых белков параспекл обнаруживаются у других позвоночных и беспозвоночных животных, однако длинная некодирующая РНК NEAT1, необходимая для формирования параспекл, есть только у млекопитающих, с чем, по-видимому, и связано отсутствие параспекл в ядрах других организмов. Количество и длина параспекл пропорциональны уровню экспрессии длинной изоформы NEAT1[3][2].
Последние исследования с использованием электронной микроскопии и микроскопии сверхвысокого разрешения показали, что параспеклы представляют собой цепочки слитых сферических субкомпартментов, каждый из которых имеет коровую часть и оболочку. 5'- и 3'-концы длинной изоформы NEAT1 локализуются в оболочке, а остальная часть молекулы находится в коровой части. Разные белки параспекл тоже локализуются в разных частях параспекл[2].
Параспеклы располагаются в интерхроматиновом пространстве, зажатые между более крупными ядерными спеклами и хроматином. Показано, что внутри параспекл РНК-полимераза II неактивна, и транскрипция, опосредованная этим ферментом, происходит только у края параспекл[4].
Связь параспекл с ядрышком ещё не до конца понятна, однако один из ключевых белков параспекл, PSPC1, может перемещаться между параспеклами и ядрышком. Кроме того, при подавлении работы РНК-полимеразы II белки параспекл локализуются в особых околоядрышковых кэпах[4].
Компоненты
В параспеклах в больших количествах накапливается свыше 40 различных белков[2] и РНК. Большинство белков параспекл связаны с транскрипцией, опосредуемой РНК-полимеразой II, и процессингом РНК. Одна из двух РНК, накапливающихся в параспеклах, называется Ctn и участвует в регуляции экспрессии генов путём удержания РНК в ядре. Вторая РНК называется NEAT1 и играет архитектурную роль, являясь необходимой для формирования и поддержания структуры параспекл. Основные компоненты параспекл перечислены в таблице ниже[5].
| Название | Класс | Синонимы | Комментарии |
|---|---|---|---|
| P54NRB | Белок | NONO, NMT55, NRB54 | Член семейства DBHS. Необходим для целостности параспекл в клетках HeLa |
| PSF | Белок | SFPQ | Член семейства DBHS. Необходим для целостности параспекл в клетках HeLa |
| PSPC1 | Белок | PSP1 | Член семейства DBHS |
| CoAA | Белок | PSP2, RBM14, SIP, SYTIP1 | Корегулятор транскрипции/сплайсинга |
| CFIM68 | Белок | CPSF6, HPBRII-4 | Фактор разрезания, также встречается в ядерных спеклах |
| SOX9 | Белок | SRA1 | Транскрипционный фактор, важный для регуляции развития |
| WTX | Белок | Белок-супрессор опухолей | |
| WT1(+KTS) | Белок | WAGR | Частично колокализуется с параспеклами |
| BCL11A | Белок | CTIP1, ZNF856 | Транскрипционный фактор, содержащий мотив «цинковый палец» |
| РНК-полимераза II | Белок | Также ассоциирована с ядерными спеклами и хроматином | |
| NEAT1 | РНК | Men ε/β, VINC-1 | Длинная некодирующая РНК, необходимая для целостности параспекл |
| Ctn | РНК | Специфична для мышей |
Белки
Важнейшими компонентами параспекл являются три белка семейства DBHS: PSF/SFPQ, NONO/P54NRB и PSPC1. Они локализуются в нуклеоплазме и в параспеклах. Чаще всего в качестве маркера для параспекл используется белок PSPC1, поскольку он в меньшей степени накапливается в нуклеоплазме. Два N-концевых РНК-связывающих мотива и С-концевой биспиральный мотив (англ. coiled coil) у этих белков на 50 % совпадают по последовательности. Эти белки играют важную структурную роль в параспеклах: так, нокдаун белков P54NRB и PSF в клетках HeLa приводит к утрате параспекл. По сравнению с P54NRB и PSF, PSPC1 экспрессируется не так обильно, и его нокдаун не приводит к утрате параспекл. Эти три белка взаимодействуют друг с другом и, вполне вероятно, внутри клеток они находятся в виде гомо- или гетеродимеров. Взаимодействие друг с другом осуществляется через биспиральный мотив. Для локализации этих белков в параспеклах необходимы как домены, содержащие С-концевые биспиральные мотивы, так и РНК-связывающие домены. Члены семейства DBHS связывают одно- и двуцепочечные молекулы ДНК и РНК и участвуют во многих этапах синтеза и процессинга РНК. Кроме того, PSF и P54NRB связывают и удерживают внутри ядра транскрипты, подвергшиеся интенсивному редактированию аденозин → инозин. Они также функционируют в цитоплазме, например, PSF и P54NRB входят в состав переносящих РНК гранул в дендритах, однако только P54NRB может активно транспортироваться из ядра в цитоплазму. Интересно, что P54NRB участвует в регуляции циркадных ритмов у млекопитающих[6].
Белками параспекл считают такие белки, которые колокализуются в определённых ядерных локусах вместе с белками семейства DBHS, однако общая картина локализации этих белков может значительно различаться. Например, белок CFIM68 можно наблюдать в параспеклах, но он также встречается и в ядерных спеклах; в то же время РНК-полимераза II, кроме параспекл, выявляется в хроматине и ядерных спеклах. Наконец, некоторые белки обнаруживаются в параспеклах только в условиях сверхэкспрессии, например, BCL11A, WTX, WT1(+KTS) и CoAA[7].
Белки параспекл, не входящие в семейство DBHS, обычно являются транскрипционными факторами или корегуляторами транскрипции. CoAA функционирует как транскрипционный коактиватор, регулирующий транскрипцию, опосредованную рецепторами стероидных гормонов, и альтернативный сплайсинг. WTX — корегулятор транскрипции и супрессор опухолей, он коактивирует транскрипцию белка WT1, который также может локализоваться в параспеклах. SOX9 — это транскрипционный фактор, играющий важнейшую роль в формировании костей. Он непосредственно взаимодействует с P54NRB, а его сверхэкспрессия приводит к изменению локализации P54NRB и PSPC1. BCL11A является транскрипционным фактором, который вовлечён в развитие В-клеточных лимфом/лейкемий. Фактор разрезания CFIM68 необходим для первого этапа процессинга 3'-конца пре-мРНК[8].
Для формирования параспекл строго необходимы белки NONO и SFPQ. Кроме того, нокдаун таких белков, как HNRNPK, DAZAP1, FUS, RBM14 и HNRNPH3 приводит к отсутствию параспекл[2].
РНК
До описания конкретных РНК, входящих в параспеклы, был известен ряд свидетельств того, что параспеклы действительно содержат РНК помимо белков. Во-первых, параспеклы разрушаются при обработке клеток РНКазой. Во-вторых, во всех важнейших белках параспеклах содержатся мотивы, связывающие РНК, кроме того, все эти белки так или иначе участвуют в процессинге РНК. В-третьих, для локализации PSPC1 в параспеклах необходим РНК-связывающий домен этого белка. Наконец, параспеклы исчезают при подавлении транскрипции, опосредованной РНК-полимеразой II, и снова появляются при возобновлении транскрипции. Известны две РНК, входящие в состав параспекл: Ctn и NEAT1/Men ε/β[9].
Ctn стала первой открытой РНК параспекл, она была описана в 2005 году. Это специфичный для мышей транскрипт с поли(А)-хвостом, который считывается с локуса mCAT2. В состав Ctn входят все экзоны белка-транспортера CAT2, однако, в отличие от мРНК этого белка, Ctn синтезируется с другого промотора и имеет более длинную 3'-нетранслируемую область (3'-НТО). Ctn локализуется не только в параспеклах, но и в нуклеоплазме. 3'-НТО этой РНК подвергается интенсивному редактированию А → I, причём редактируются инвертированные повторы, благодаря которым в структуре РНК образуются двуцепочечные участки. С инозином в РНК связывается белок параспекл P54NRB, который, кроме того, связывается с Ctn in vivo. Вероятно, благодаря связыванию с белками параспекл Ctn остаётся в параспеклах, а не экспортируется в цитоплазму. Под действием ряда стрессовых сигналов 3'-НТО Ctn разрезается, и количество этой РНК в ядре падает[10].
В 2009 году несколько групп исследователей независимо открыли вторую РНК параспекл — NEAT1. Эта длинная некодирующая РНК необходима для формирования и поддержания структурной целостности параспекл. Известно два варианта NEAT1, различающихся своей длиной; структурную роль в параспеклах играет длинная изоформа[2]. Интересно, что длинная изоформа NEAT1 подвергается разрезанию очень близко к 3'-концу, из-за чего образуется очень короткая молекула РНК, похожая на тРНК. Нокдаун NEAT1 приводит к полной утрате параспекл, а сверхэкспрессия этой РНК приводит к увеличению количества параспекл в некоторых клеточных линиях. Кроме того, параспеклы формируются вблизи генов NEAT1. По-видимому, как и в случае Ctn, локализация NEAT1 в параспеклах связана с взаимодействием с белками семейства DBHS, хотя NEAT1 не подвергается редактированию А → I. По изменению количества NEAT1 в клетке можно судить о функционировании параспекл. Человеческие эмбриональные стволовые клетки, а также индуцированные плюрипотентные стволовые клетки[2] не экспрессируют NEAT1 и не имеют параспекл, несмотря на экспрессию белков DBHS, однако при начале дифференцировки параспеклы появляются. Кроме того, с появлением параспекл усиливается накопление в ядре мРНК, подвергшихся редактированию А → I[11].
Формирование
Согласно существующей модели, формирование параспекл начинается с образования транскриптов NEAT1 в ядрах дочерних клеток вскоре после клеточного деления. Вскоре после синтеза молекулы NEAT1 формируют комплексы с белками DBHS, причём транскрипты NEAT1 не успевают удалиться от своего локуса. Сформированные параспеклы, вероятнее всего, состоят из множества комплексов NEAT1 с белками DBHS и довольно динамичны: отдельные молекулы белков DBHS могут уходить в нуклеоплазму и обратно. Вероятно, в формировании параспекл задействована способность белков DBHS к олигомеризации, а также взаимодействия непосредственно между самими молекулами РНК NEAT1. В отсутствие NEAT1 параспеклы неспособны поддерживать свою структурную целостность и не формируются заново[12]. Согласно последним данным, в формировании параспекл задействовано разделение фаз на границе жидкость—жидкость (англ. liquid-liquid phase separation)[2]. Капельки с разделенными фазами образуются благодаря поликомб белку ASXL1, который кроме того, усиливает экспрессию NEAT1 и увеличивает взаимодействия NONO-NEAT1[13]
Функции
Основной функцией параспекл является удержание в ядре мРНК, содержащих двуцепочечные участки, сформированные при помощи инвертированных повторов, и подвергшихся редактированию аденозин → инозин. Удержание РНК в ядре связано с клеточным ответом на стресс, вирусные инфекции, а также поддержанием циркадных ритмов. Судя по всему, параспеклы участвуют в перепрограммировании клетки, которое происходит при дифференцировке; возможно, путём удержания РНК в ядре параспеклы изменяют экспрессию ключевых белков. Отсутствие NEAT1 и параспекл потенциально может служить маркером плюрипотентности. Белок параспекл CFIM68 может регулировать высвобождение РНК из ядра, внося в РНК разрезы[14].
Параспеклы могут избирательно накапливать внутри себя определённые белки, приводя к понижению концентрации этих белков в других местах. Это, в свою очередь, может влиять на экспрессию ряда генов[2].
Согласно последним данным, параспеклы могут локализоваться непосредственно на сайтах начала транскрипции активно транскрибируемых генов. Белки параспекл SFPQ и NONO участвуют в процессинге микроРНК, причём накопление этих белков в параспеклах способствует эффективному процессингу микроРНК[2].
Физиологическое и клиническое значение
Параспеклы и NEAT1 не являются строго необходимыми для развития млекопитающих в нормальных условиях, так как мыши, лишённые NEAT1, жизнеспособны. Тем не менее, у некоторых самок таких мышей наблюдались отклонения в формировании и функционировании яичниковых секреторных желёз и жёлтого тела, что снижает фертильность. Возможно, параспеклы выполняют какую-то эволюционно консервативную функцию в клетках секреторных структур женской репродуктивной системы млекопитающих: так, у опоссума в клетках маточных желёз имеются хорошо оформленные параспеклы. Любопытно, что подобные эффекты наблюдались не у всех нокаутных самок, а лишь у некоторых, что можно связать с необходимостью функционирования параспекл при стрессовых условиях окружающей среды[2].
Уровень экспрессии длинной изоформы NEAT1 повышается при заражении клетки некоторыми РНК-содержащими вирусами, такими как вирус японского энцефалита, бешенства, ВИЧ, вирус гриппа и вирус Хантаан, а также ДНК-содержащим вирусом простого герпеса. В большинстве случаев это повышение есть защитный механизм. Повышение количества параспекл приводит к накоплению в них большого количества белков, которые вирус не сможет использовать для своего размножения, а также изменению экспрессии ряда генов[2].
В случае рака экспрессия NEAT1 может понижаться, повышаться по сравнению с нормальной тканью или оставаться неизменной. Мутации в гене NEAT1 связывают с развитием рака печени и рака молочной железы. Имеются данные, что NEAT1 может даже стимулировать образование метастазов[15]. Повышение экспрессии NEAT1 и увеличение количества параспекл может быть связано со стрессовыми условиями, в которых находятся раковые клетки, однако параспеклы могут иметь и онкогенную роль. В случае рака предстательной железы повышение количества параспекл и экспрессии NEAT1 соответствует более агрессивным формам заболевания. Есть, однако, и свидетельства того, что параспеклы могут подавлять развитие опухолей[2].
Параспеклы могут играть особые роли в функционировании нервной системы. Показано, что после эпилептического припадка в некоторых участках мозга мышей повышалась экспрессия длинной изоформы NEAT1. Параспеклы могут быть задействованы в развитии бокового амиотрофического склероза[2].
Имеются свидетельства, что NEAT1 может регулировать воспалительный процесс, запуская образование параспекл в макрофагах[16].
Примечания
- The Nucleus, 2011, p. 274.
- Fox A. H., Nakagawa S., Hirose T., Bond C. S. Paraspeckles: Where Long Noncoding RNA Meets Phase Separation. (англ.) // Trends in biochemical sciences. — 2017. — doi:10.1016/j.tibs.2017.12.001. — PMID 29289458.
- The Nucleus, 2011, p. 275—276.
- The Nucleus, 2011, p. 276.
- The Nucleus, 2011, p. 277.
- The Nucleus, 2011, p. 277—278.
- The Nucleus, 2011, p. 278—279.
- The Nucleus, 2011, p. 279.
- The Nucleus, 2011, p. 279—280.
- The Nucleus, 2011, p. 280.
- The Nucleus, 2011, p. 281—284.
- The Nucleus, 2011, p. 284.
- Yamamoto, K., Goyama, S., Asada, S., Fujino, T., Yonezawa, T., Sato, N., ... & Kitamura, T. (2021). A histone modifier, ASXL1, interacts with NONO and is involved in paraspeckle formation in hematopoietic cells. Cell Reports, 36(8), 109576. PMID 34433054 doi:10.1016/j.celrep.2021.109576
- The Nucleus, 2011, p. 284—285.
- Fu M. C., Yuan L. Q., Zhang T., Yan X. M., Zhou Y., Xia H. L., Wu Y., Xu L. X., Cao X., Wang J. Nuclear paraspeckle assembly transcript 1 promotes the metastasis and epithelial-mesenchymal transition of hepatoblastoma cells by inhibiting miR-129-5p. (англ.) // Oncology letters. — 2017. — Vol. 14, no. 5. — P. 5773—5778. — doi:10.3892/ol.2017.6995. — PMID 29113206.
- Huang-Fu N., Cheng J. S., Wang Y., Li Z. W., Wang S. H. Neat1 regulates oxidized low-density lipoprotein-induced inflammation and lipid uptake in macrophages via paraspeckle formation. (англ.) // Molecular medicine reports. — 2018. — Vol. 17, no. 2. — P. 3092—3098. — doi:10.3892/mmr.2017.8211. — PMID 29257236.
Литература
- Разин С.В., Гаврилов А.А. Организация функциональных процессов в клеточном ядре: порядок, возникающий из беспорядка // Вестник московского университета. Сер. 16. Биология. — 2015. — № 3. — С. 13—20.
- The Nucleus / Tom Misteli, David L. Spector. — N. Y.: Cold Spring Harbor Perpectives in Biology, 2011. — 463 p. — ISBN 978-0-87969-894-2.

