Аутофагия
Аутофагия (от др.-греч. αὐτός ауто- — сам и φαγεῖν — «есть») — процесс, при котором внутренние компоненты клетки доставляются внутрь её лизосом или вакуолей и подвергаются в них деградации[1]. Является естественным, регулируемым механизмом клетки, который разбирает ненужные или дисфункциональные компоненты[2]. При аутофагическом типе клеточной гибели все органеллы клетки перевариваются, оставляя лишь клеточный дебрис, который поглощается макрофагами.
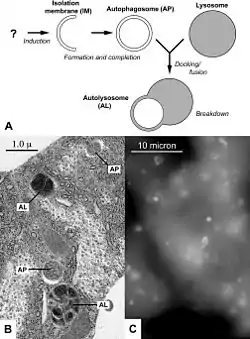
Типы и механизмы аутофагии
Сейчас различают три типа аутофагии — микроаутофагию, макроаутофагию и шапероновую аутофагию.
Микроаутофагия
При микроаутофагии макромолекулы и обломки клеточных мембран просто захватываются лизосомой. Таким путём клетка может переваривать белки при нехватке энергии или строительного материала (например, при голодании). Но процессы микроаутофагии происходят и при нормальных условиях и в целом неизбирательны. Иногда в ходе микроаутофагии перевариваются и органоиды; так, у дрожжей описана микроаутофагия пероксисом и частичная микроаутофагия ядер, при которой клетка сохраняет жизнеспособность[3].
Макроаутофагия
При макроаутофагии участок цитоплазмы (часто содержащий какие-либо органоиды) окружается мембранным компартментом, похожим на цистерну эндоплазматической сети. В результате этот участок отделяется от остальной цитоплазмы двумя мембранами. Такие двухмембранные органеллы, окружающие удаляемые органеллы и цитоплазму, называются аутофагосомы. Аутофагосомы соединяются с лизосомами, образуя аутофаголизосомы, в которых органеллы и остальное содержимое аутофагосом перевариваются. Видимо, макроаутофагия также неизбирательна, хотя часто подчеркивается, что с помощью неё клетка может избавляться от «отслуживших свой срок» органоидов (митохондрий, рибосом и др.).
Шапероновая аутофагия
Третий тип аутофагии — шапероновая. При этом способе происходит направленный транспорт частично денатурировавших белков из цитоплазмы сквозь мембрану лизосомы в её полость, где они перевариваются. Этот тип аутофагии, описанный только для млекопитающих, индуцируется стрессом (например, при голодании или физических нагрузках). Она происходит при участии цитоплазматических белков-шаперонов семейства hsp-70, вспомогательных белков и LAMP-2, который служит мембранным рецептором комплекса шаперона и белка, подлежащего транспорту в лизосому.
Регуляция аутофагии
Аутофагия сопровождает жизнедеятельность любой нормальной клетки в обычных условиях.
Основными стимулами к усилению процессов аутофагии в клетках могут служить:
- нехватка питательных веществ
- наличие в цитоплазме повреждённых органелл
- наличие в цитоплазме частично денатурировавших белков и их агрегатов
Кроме голодания, аутофагия может индуцироваться окислительным или токсическим стрессом. В настоящее время на дрожжах детально изучаются генетические механизмы, регулирующие аутофагию. Так, для образования аутофагосом необходима активность многочисленных белков Atg-семейства (autophagosome-related proteins). Гомологи этих белков найдены у млекопитающих (в том числе и человека) и растений.
Значение аутофагии при нормальных и патологических процессах
Аутофагия — один из способов избавления клеток от ненужных органелл, а также и организма от ненужных клеток. Особенно важна аутофагия в процессе эмбриогенеза, при так называемой самопрограммируемой клеточной гибели. Сейчас этот вариант аутофагии чаще называют каспаза-независимым апоптозом. Если эти процессы нарушаются, а разрушенные клетки не удаляются, то эмбрион чаще всего становится нежизнеспособным.
Иногда благодаря аутофагии клетка может восполнить недостаток питательных веществ и энергии и вернуться к нормальной жизнедеятельности. Напротив, в случае интенсификации процессов аутофагии клетки разрушаются, а их место во многих случаях занимает соединительная ткань. Подобные нарушения являются одной из причин развития сердечной недостаточности. Нарушения в процессе аутофагии могут приводить к воспалительным процессам, если части мёртвых клеток не удаляются.
Особенно большую (хотя и не до конца понятную) роль нарушения аутофагии играют в развитии миопатий и нейродегенеративных болезней. Так, при болезни Альцгеймера в отростках нейронов пораженных участков мозга наблюдается накопление незрелых аутофагосом, которые не транспортируются к телу клетки и не сливаются с лизосомами. Мутантные хантингтин и альфа-синуклеин — белки, накопление которых в нейронах вызывает, соответственно, болезнь Хантингтона и болезнь Паркинсона — поглощаются и перевариваются при шапероновой аутофагии, и активация этого процесса предотвращает образование их агрегатов в нейронах[4].
История исследования
В 2016 году в Стокгольме за открытие и исследование механизмов аутофагии японскому учёному Ёсинори Осуми была вручена Нобелевская премия по физиологии и медицине[5].
Примечания
- Farrugia G, Balzan R. Oxidative stress and programmed cell death in yeast (Front Oncol.). — 2012. — Т. 2, вып. 64. — doi:10.3389/fonc.2012.00064.
- Klionsky DJ. "Autophagy revisited: a conversation with Christian de Duve" (Front Oncol.). — 2008. — Август. — С. 740–3. — doi:10.4161/auto.6398.
- Takahiro Shintani and Daniel J. Klionsky Autophagy in Health and Disease: A Double-Edged Sword/Science, 2004, Vol. 306, no. 5698, pp. 990—995
- Huang J, Klionsky D.J. Autophagy and human disease. Cell Cycle. 2007 Aug 1;6(15):1837-1849
- The Nobel Prize in Physiology or Medicine 2016. Фонд Нобеля (3 октября 2016). Дата обращения: 4 октября 2016.