Нетоз
Нето́з[2] (англ. NETosis от англ. Neutrophil extracellular traps) — вид программируемой клеточной гибели, происходящей у нейтрофилов. Сопровождается выбрасыванием из погибающих нейтрофилов нитей, состоящих в основном из ДНК. Благодаря нетозу нейтрофилы убивают внеклеточных патогенов, минимизируя вред для других клеток[3].
Механизм
В условиях in vitro у нейтрофилов нетоз запускается под действием форболмиристатацетата, интерлейкина 8 (IL-8) и липополисахарида. При этом нейтрофилы высвобождают гранулы белков и хроматина (в основном эти гранулы состоят из ДНК), которые во внеклеточном пространстве формируют фибриллы (нити), опутывающие клетку патогена[3]. Нетоз не всегда сопровождается гибелью нейтрофила: описан так называемый витальный нетоз, при котором ДНК упаковывается в везикулы, отшнуровывающиеся от клеточного ядра[4]. Ниже будет описан механизм суицидального нетоза, при котором нейтрофил гибнет.
Молекулярный механизм запуска нетоза не до конца ясен, однако известны несколько ключевых белков этого процесса. Считается, что нетоз запускается при активации NADPH-оксидазы, которая начинает вырабатывать активные формы кислорода. Под их действием запускается фермент протеин-аргининдеиминаза 4 (PAD4). PAD4 вызывает цитруллинирование гистонов в ядре нейтрофила, в результате чего хроматин декомпактизируется. В ядро входят миелопероксидаза и эластаза нейтрофилов, которые стимулируют дальнейшую декомпактизацию хроматина и в конце концов приводят к разрушению ядерной оболочки. Деконденсированный хроматин выходит в цитоплазму, где к нему присоединяются дополнительные белки, формируя так называемые внеклеточные нити нейтрофилов (англ. Neutrophil extracellular traps, NETs)[4]. Образование NETs регулируется липоксигеназным путём. При некоторых способах запуска нетоза (например, при контакте с бактериальной клеткой) нейтрофил-5-липоксигеназа взаимодействует с фосфолипидами, и продукты реакции ингибируют образование NETs[5]. Из внеклеточной среды NETs убирают макрофаги, которые фагоцитируют и разрушают их[6].
При суицидальном нетозе выбрасывание NETs сопровождается гибелью нейтрофилов посредством механизма, отличного от апоптоза и некроза[7]. В случае суицидального нетоза после формирования внеклеточных нитей разрушается клеточная мембрана нейтрофила, в результате чего нити оказываются во внеклеточном пространстве. Суицидальный нетоз может быть запущен при активации Toll-подобных рецепторов (TLRs), Fc-рецепторов и рецепторов комплемента различными лигандами, такими как антитела или форболмиристатацетат[4][8]. Считается, что при активации этих рецепторов в конечном счёте происходит выход ионов кальция из эндоплазматического ретикулума, который далее активирует NADPH-оксидазу[8]. Процесс суицидального нетоза может занимать несколько часов, даже при воздействии высоких концентрации форболмиритатацетата, в то время как витальный нетоз происходит в течение нескольких минут[4].
Витальный нетоз запускается липополисахаридом и другими антигенами бактериального происхождения, TLR4-активированными тромбоцитами или белками комплемента совместно с лигандами TLR2[4]. При витальном нетозе происходит блеббинг (отшнуровывание пузырьков) ядра, в результате чего в клетке появляются везикулы, заполненные ДНК, которую они выделяют наружу путём экзоцитоза без повреждения клеточной мембраны[4]. Такие везикулы формируются и выбрасывают своё содержимое во внеклеточное пространство очень быстро, причём нейтрофил при этом не гибнет, хотя и остаётся без ДНК. Вопрос о том, можно ли считать живым нейтрофил без ДНК, является спорным. После витального нетоза нейтрофилы могут продолжить фагоцитировать и убивать клетки микроорганизмов[8].
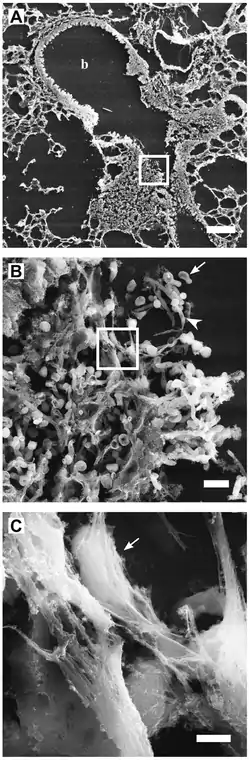
Строение и свойства NETs
Сканирующая электронная микроскопия высокого разрешения показала, что NETs состоят из тяжей ДНК, связанной с глобулярными белковыми доменами, диаметром 15—17 нм и 25 нм соответственно. Тяжи сворачиваются в более толстые волокна диаметром 50 нм[3]. Однако в некоторых условиях NETs могут формировать большие скопления, достигающие сотен нанометров в длину и ширину[9].
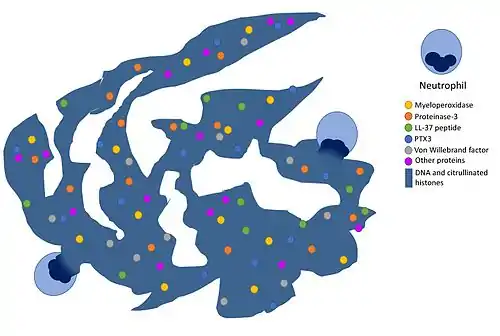
Иммунофлуоресцентный анализ показал, что NETs содержат белки из азурофильных гранул (нейтрофилэластаза, катепсин G и миелопероксидаза), специфичных гранул (лактоферрин), третичных гранул (желатиназа) и цитоплазмы. Однако в состав NETs не входят многие многочисленные цитоплазматические белки, такие как CD63, актин и тубулин[3][1].
Противомикробное действие NETs обусловлено тем, что они содержат белки с соответствующими свойствами — нейтрофилэластазу и катепсин G, кроме того, входящие в NETs гистоны обладают высоким сродством к ДНК[10]. NETs обеспечивают повышенную локальную концентрацию молекул с антимикробными свойствами и обездвиживают клетки патогена. Кроме того, NETs образуют физический барьер, препятствующий распространению клеток патогена. NETs действуют не только на бактериальные клетки, но и на патогенных грибов, таких как дрожжи Candida albicans. Нетоз вызывается как отдельными дрожжевыми клетками, так и гифами Candida albicans[11]. Имеется сообщение, что NETs могут взаимодействовать с малярийным плазмодием Plasmodium falciparum[12].
Хотя изначально предполагалось, что NETs выполняют свои функции непосредственно в очаге бактериальной или грибковой инфекции, было показано, что при сепсисе NETs могут формироваться внутри кровеносных сосудов (а именно капилляров в лёгких и синусоидах печени). Формирование NETs внутри сосудов находится под жёстким контролем тромбоцитов, которые получают сигналы о сильной инфекции через TLR4-рецепторы, связываются с нейтрофилами и активируют нетоз. Образование NETs, запускаемое тромбоцитами, происходит очень быстро (в течение нескольких минут) и может быть результатом как суицидального, так и витального нетоза[13]. В кровеносных сосудах на NETs могут застревать бактерии, циркулирующие по кровотоку[9].
Отрицательные эффекты
Нетоз может оказывать негативное влияние на организм, поскольку выход гистонов во внеклеточную среду может запустить развитие аутоиммунных заболеваний, таких как системная красная волчанка[14]. NETs могут также участвовать в развитии воспалительных заболеваний; так, NETs были выявлены в случае преэклампсии — связанного с беременностью воспалительного расстройства, при котором происходит активация нейтрофилов[15]. NETs были обнаружены в слизистой толстого кишечника у пациентов с язвенным колитом[16]. Была выявлена связь NETs с образованием антител к ядерной двуцепочечной ДНК у детей, заражённых Plasmodium falciparum[12]. NETs также выявляются у пациентов с онкологическими заболеваниями[17]. Доклинические исследования свидетельствуют, что NETs могут играть в роль в развитии таких болезней, как тромбоз, сердечный приступ[18][19][20], отказ органов, а также метастазировании[21].
NETs вовлечены в патогенез вируса иммунодефицита человека и вируса иммунодефицита обезьян. NETs захватывают вирионы ВИЧ и разрушают их[22]. По ходу ВИЧ-инфекции образование NETs увеличивается, однако снижается под действием противовирусных препаратов. Кроме того, NETs могут захватывать и многие иммунные клетки, такие как CD4+ и CD8+ T-клетки, B-клетки и моноциты. Этот эффект удалось пронаблюдать в кишечнике, лёгких, печени и кровеносных сосудах[23]. В 2020 году консорциум медиков NETwork опубликовал исследование[24], согласно которому нетоз может играть важную роль в смертельных случаях заболевания, вызванного COVID-19[25].
Таким образом, имеется ряд свидетельств того, что NETs играют важную роль в патогенезе инфекционных, воспалительных и тромботических заболеваний[26][27][28].
Примечания
- Urban C. F., Ermert D., Schmid M., Abu-Abed U., Goosmann C., Nacken W., Brinkmann V., Jungblut P. R., Zychlinsky A. Neutrophil extracellular traps contain calprotectin, a cytosolic protein complex involved in host defense against Candida albicans. (англ.) // PLoS Pathogens. — 2009. — October (vol. 5, no. 10). — P. e1000639—1000639. — doi:10.1371/journal.ppat.1000639. — PMID 19876394.
- Плескова С. Н., Горшкова Е. Н., Боряков А. В., Крюков Р. Н. Морфологические особенности быстрого и классического нетоза // Цитология. — 2019. — Т. 81, № 9. — С. 704—712. — doi:10.1134/S0041377119090098.
- Brinkmann V., Reichard U., Goosmann C., Fauler B., Uhlemann Y., Weiss D. S., Weinrauch Y., Zychlinsky A. Neutrophil extracellular traps kill bacteria. (англ.) // Science (New York, N.Y.). — 2004. — Vol. 303, no. 5663. — P. 1532—1535. — doi:10.1126/science.1092385. — PMID 15001782.
- Jorch S. K., Kubes P. An emerging role for neutrophil extracellular traps in noninfectious disease. (англ.) // Nature Medicine. — 2017. — 7 March (vol. 23, no. 3). — P. 279—287. — doi:10.1038/nm.4294. — PMID 28267716.
- Clark S. R., Guy C. J., Scurr M. J., Taylor P. R., Kift-Morgan A. P., Hammond V. J., Thomas C. P., Coles B., Roberts G. W., Eberl M., Jones S. A., Topley N., Kotecha S., O'Donnell V. B. Esterified eicosanoids are acutely generated by 5-lipoxygenase in primary human neutrophils and in human and murine infection. (англ.) // Blood. — 2011. — 10 February (vol. 117, no. 6). — P. 2033—2043. — doi:10.1182/blood-2010-04-278887. — PMID 21177434.
- Farrera C., Fadeel B. Macrophage clearance of neutrophil extracellular traps is a silent process. (англ.) // Journal Of Immunology (Baltimore, Md. : 1950). — 2013. — 1 September (vol. 191, no. 5). — P. 2647—2656. — doi:10.4049/jimmunol.1300436. — PMID 23904163.
- Fuchs T. A., Abed U., Goosmann C., Hurwitz R., Schulze I., Wahn V., Weinrauch Y., Brinkmann V., Zychlinsky A. Novel cell death program leads to neutrophil extracellular traps. (англ.) // The Journal Of Cell Biology. — 2007. — 15 January (vol. 176, no. 2). — P. 231—241. — doi:10.1083/jcb.200606027. — PMID 17210947.
- Yang H., Biermann M. H., Brauner J. M., Liu Y., Zhao Y., Herrmann M. New Insights into Neutrophil Extracellular Traps: Mechanisms of Formation and Role in Inflammation. (англ.) // Frontiers In Immunology. — 2016. — Vol. 7. — P. 302—302. — doi:10.3389/fimmu.2016.00302. — PMID 27570525.
- Clark S. R., Ma A. C., Tavener S. A., McDonald B., Goodarzi Z., Kelly M. M., Patel K. D., Chakrabarti S., McAvoy E., Sinclair G. D., Keys E. M., Allen-Vercoe E., Devinney R., Doig C. J., Green F. H., Kubes P. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. (англ.) // Nature Medicine. — 2007. — April (vol. 13, no. 4). — P. 463—469. — doi:10.1038/nm1565. — PMID 17384648.
- Thomas M. P., Whangbo J., McCrossan G., Deutsch A. J., Martinod K., Walch M., Lieberman J. Leukocyte protease binding to nucleic acids promotes nuclear localization and cleavage of nucleic acid binding proteins. (англ.) // Journal Of Immunology (Baltimore, Md. : 1950). — 2014. — 1 June (vol. 192, no. 11). — P. 5390—5397. — doi:10.4049/jimmunol.1303296. — PMID 24771851.
- Urban C. F., Reichard U., Brinkmann V., Zychlinsky A. Neutrophil extracellular traps capture and kill Candida albicans yeast and hyphal forms. (англ.) // Cellular Microbiology. — 2006. — April (vol. 8, no. 4). — P. 668—676. — doi:10.1111/j.1462-5822.2005.00659.x. — PMID 16548892.
- Baker V. S., Imade G. E., Molta N. B., Tawde P., Pam S. D., Obadofin M. O., Sagay S. A., Egah D. Z., Iya D., Afolabi B. B., Baker M., Ford K., Ford R., Roux K. H., Keller TC 3rd. Cytokine-associated neutrophil extracellular traps and antinuclear antibodies in Plasmodium falciparum infected children under six years of age. (англ.) // Malaria Journal. — 2008. — 29 February (vol. 7). — P. 41—41. — doi:10.1186/1475-2875-7-41. — PMID 18312656.
- Caudrillier A., Kessenbrock K., Gilliss B. M., Nguyen J. X., Marques M. B., Monestier M., Toy P., Werb Z., Looney M. R. Platelets induce neutrophil extracellular traps in transfusion-related acute lung injury. (англ.) // The Journal Of Clinical Investigation. — 2012. — July (vol. 122, no. 7). — P. 2661—2671. — doi:10.1172/JCI61303. — PMID 22684106.
- Hakkim A., Fürnrohr B. G., Amann K., Laube B., Abed U. A., Brinkmann V., Herrmann M., Voll R. E., Zychlinsky A. Impairment of neutrophil extracellular trap degradation is associated with lupus nephritis. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2010. — 25 May (vol. 107, no. 21). — P. 9813—9818. — doi:10.1073/pnas.0909927107. — PMID 20439745.
- Gupta A. K., Hasler P., Holzgreve W., Gebhardt S., Hahn S. Induction of neutrophil extracellular DNA lattices by placental microparticles and IL-8 and their presence in preeclampsia. (англ.) // Human Immunology. — 2005. — November (vol. 66, no. 11). — P. 1146—1154. — doi:10.1016/j.humimm.2005.11.003. — PMID 16571415.
- Bennike T. B., Carlsen T. G., Ellingsen T., Bonderup O. K., Glerup H., Bøgsted M., Christiansen G., Birkelund S., Stensballe A., Andersen V. Neutrophil Extracellular Traps in Ulcerative Colitis: A Proteome Analysis of Intestinal Biopsies. (англ.) // Inflammatory Bowel Diseases. — 2015. — September (vol. 21, no. 9). — P. 2052—2067. — doi:10.1097/MIB.0000000000000460. — PMID 25993694.
- Rayes R. F., Mouhanna J. G., Nicolau I., Bourdeau F., Giannias B., Rousseau S., Quail D., Walsh L., Sangwan V., Bertos N., Cools-Lartigue J., Ferri L. E., Spicer J. D. Primary tumors induce neutrophil extracellular traps with targetable metastasis promoting effects. (англ.) // JCI Insight. — 2019. — 25 July (vol. 5). — doi:10.1172/jci.insight.128008. — PMID 31343990.
- Laridan E., Denorme F., Desender L., François O., Andersson T., Deckmyn H., Vanhoorelbeke K., De Meyer S. F. Neutrophil extracellular traps in ischemic stroke thrombi. (англ.) // Annals Of Neurology. — 2017. — August (vol. 82, no. 2). — P. 223—232. — doi:10.1002/ana.24993. — PMID 28696508.
- Ducroux C., Di Meglio L., Loyau S., Delbosc S., Boisseau W., Deschildre C., Ben Maacha M., Blanc R., Redjem H., Ciccio G., Smajda S., Fahed R., Michel J. B., Piotin M., Salomon L., Mazighi M., Ho-Tin-Noe B., Desilles J. P. Thrombus Neutrophil Extracellular Traps Content Impair tPA-Induced Thrombolysis in Acute Ischemic Stroke. (англ.) // Stroke. — 2018. — March (vol. 49, no. 3). — P. 754—757. — doi:10.1161/STROKEAHA.117.019896. — PMID 29438080.
- Vallés J., Lago A., Santos M. T., Latorre A. M., Tembl J. I., Salom J. B., Nieves C., Moscardó A. Neutrophil extracellular traps are increased in patients with acute ischemic stroke: prognostic significance. (англ.) // Thrombosis And Haemostasis. — 2017. — 5 October (vol. 117, no. 10). — P. 1919—1929. — doi:10.1160/TH17-02-0130. — PMID 28837206.
- Cedervall J., Zhang Y., Olsson A. K. Tumor-Induced NETosis as a Risk Factor for Metastasis and Organ Failure. (англ.) // Cancer Research. — 2016. — 1 August (vol. 76, no. 15). — P. 4311—4315. — doi:10.1158/0008-5472.CAN-15-3051. — PMID 27402078.
- Saitoh T., Komano J., Saitoh Y., Misawa T., Takahama M., Kozaki T., Uehata T., Iwasaki H., Omori H., Yamaoka S., Yamamoto N., Akira S. Neutrophil extracellular traps mediate a host defense response to human immunodeficiency virus-1. (англ.) // Cell Host & Microbe. — 2012. — 19 July (vol. 12, no. 1). — P. 109—116. — doi:10.1016/j.chom.2012.05.015. — PMID 22817992.
- Sivanandham R., Brocca-Cofano E., Krampe N., Falwell E., Venkatraman SMK, Ribeiro R. M., Apetrei C., Pandrea I. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. (англ.) // The Journal Of Clinical Investigation. — 2018. — 1 November (vol. 128, no. 11). — P. 5178—5183. — doi:10.1172/JCI99420. — PMID 30204591.
- Barnes Betsy J., Adrover Jose M., Baxter-Stoltzfus Amelia, Borczuk Alain, Cools-Lartigue Jonathan, Crawford James M., Daßler-Plenker Juliane, Guerci Philippe, Huynh Caroline, Knight Jason S., Loda Massimo, Looney Mark R., McAllister Florencia, Rayes Roni, Renaud Stephane, Rousseau Simon, Salvatore Steven, Schwartz Robert E., Spicer Jonathan D., Yost Christian C., Weber Andrew, Zuo Yu, Egeblad Mikala. Targeting potential drivers of COVID-19: Neutrophil extracellular traps (англ.) // Journal of Experimental Medicine. — 2020. — 16 April (vol. 217, no. 6). — ISSN 0022-1007. — doi:10.1084/jem.20200652.
- Причиной смерти от COVID-19 могут быть гиперактивные иммунные клетки. indicator.ru. Дата обращения: 18 апреля 2020.
- Fuchs T. A., Brill A., Duerschmied D., Schatzberg D., Monestier M., Myers Jr. D. D., Wrobleski S. K., Wakefield T. W., Hartwig J. H., Wagner D. D. Extracellular DNA traps promote thrombosis. (англ.) // Proceedings Of The National Academy Of Sciences Of The United States Of America. — 2010. — 7 September (vol. 107, no. 36). — P. 15880—15885. — doi:10.1073/pnas.1005743107. — PMID 20798043.
- Brill A., Fuchs T. A., Savchenko A. S., Thomas G. M., Martinod K., De Meyer S. F., Bhandari A. A., Wagner D. D. Neutrophil extracellular traps promote deep vein thrombosis in mice. (англ.) // Journal Of Thrombosis And Haemostasis : JTH. — 2012. — January (vol. 10, no. 1). — P. 136—144. — doi:10.1111/j.1538-7836.2011.04544.x. — PMID 22044575.
- Borissoff J. I., ten Cate H. From neutrophil extracellular traps release to thrombosis: an overshooting host-defense mechanism? (англ.) // Journal Of Thrombosis And Haemostasis : JTH. — 2011. — September (vol. 9, no. 9). — P. 1791—1794. — doi:10.1111/j.1538-7836.2011.04425.x. — PMID 21718435.
