Неприлизин
Неприлизин (мембранная металлоэндопептидаза (MME); нейтральная эндопептидаза (NEP);;общий острый лимфобластный лейкозный антиген (CALLA); CD10) — фермент эндопептидаза, продукт гена MME. Цинк-зависимая металлопротеаза, расщепляет пептиды по аминогруппе гидрофобных аминокислот и инактивирует несколько пептидных гормонов, включая глюкагон, энкефалины, вещество Р, нейротензин, окситоцин и брадикинин[1]. Кроме этого, неприлизин деградирует также бета-амилоиды, накопление которых в нервной ткани связано с болезнью Альцгеймера. Синтезируется в виде мембранного белка, после переноса из аппарата Гольджи на поверхность клетки эктодомен неприлизина высвобождается во внеклеточную среду.
| Неприлизин | ||||||
|---|---|---|---|---|---|---|
| Идентификаторы | ||||||
| Символы | CALLANeutral endopeptidaseneprilysinskin fibroblast elastasemembrane metallo-endopeptidase variant 2neprilysin-390common acute lymphocytic leukemia antigenneprilysin-411neutral endopeptidase 24.11SFEatriopeptidasemembrane metallo-endopeptidase variant 1membrane metallo-endopeptidase (neutral endopeptidaseenkephalinaseCALLACD10)NEPMMEEnkephalinase | |||||
| Внешние IDs | GeneCards: | |||||
| Профиль экспрессии РНК | ||||||
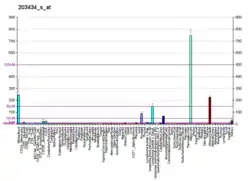 | ||||||
| Больше информации | ||||||
| Ортологи | ||||||
| Виды | Человек | Мышь | ||||
| Entrez |
|
| ||||
| Ensembl |
|
| ||||
| UniProt |
|
| ||||
| RefSeq (мРНК) |
|
| ||||
| RefSeq (белок) |
|
| ||||
| Локус (UCSC) | n/a | n/a | ||||
| Поиск PubMed | n/a | |||||
| Править (человек) | ||||||
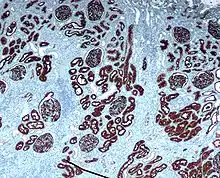
Неприлизин экспрессируется широким спектром тканей, но особенно высокий уровень белка обнаружен в почках. Это частый антиген, обнаруживаемый при остром лимфобластном лейкозе, и является важным маркёром при диагностике заболеваний у человека. Представлен на лейкемических клетках пре-B-лимфоцитарного фенотипа, которые представлены в 85 % всех случаев острого лимфобластного лейкоза[1].
Клетки-предшественники гематопоэтического ряда, экспрессирующие CD10, рассматриваются как общие клетки-предшественники лимфоцитов, то есть лимфобласты, которые способны дифференцироваться в T-лимфоциты, B-лимфоциты или естественные киллеры[2].
CD10 применяется при гематологической диагностике, поскольку белок экспрессирован на ранних B-, про-B- и пре-B-лимфоцитах и в герминативном центре лимфатических узлов[3]. Гематологические заболевания с положительным тестом на CD10/ALL включают ангиоиммунобластную T-клеточную лимфому, лимфому Беркитта, хронический миелоидный лейкоз в бластном кризе (90 %), диффузную B-крупноклеточную лимфому, клетки фолликул лимфоузла (70 %). Острый миелоидный лейкоз, хронический лимфолейкоз, мантийноклеточная лимфома и B-клеточная лимфома маргинальной зоны характеризуются отрицательным тестом на CD10. CD10 отсутсвует на клетках лимфомы, происходящих из зрелых B-клеток[4].
Регуляция бета-амилоида
Исследования на нокаутных мышах показали, что у животных без неприлизина наблюдались как нарушения подобные болезни Альцгеймера у человека, так и отложение бета-амилоида в мозге[5], что подтвердило ассоциацию белка с болезнью Альцгеймера. Поскольку неприлизин рассматривается как лимитирующая стадия в деградации бета-амилоида[6], он считается терапевтической мишенью для лечения заболевания. Известно, что пептидный гормон соматостатин повышает ферментативную активность неприлизина[7]. Снижение активности неприлизина с возрастом может объясняться окислительным повреждением, которое является одним из причинных факторов болезни Альцгеймера, поскольку повышенный уровень окисленного неприлизина был обнаружен в мозге больных относительно мозга когнитивно нормальных людей того же возраста[8].
Регуляция пептидных гормонов
Неприлизин связан с несколькими биохимическими процессами и с высокой степенью экспрессирован в почках и лёгких. Ингибиторы, разработанные как анальгетики и антигипертезивные агенты, действуют, предотвращая активность неприлизина, направленную на расщепление таких сигнальных пептидов, как энкефалины, вещество Р, эндотелин и предсердный натрийуретический пептид[9][10].
Хотя была обнаружена связь между экспрессией неприлизина и злокачественных опухолях, механизм этой ассоциации остаётся неясным. В онкологических исследованиях ген неприлизина, как правило, обозначается как CD10 или CALLA. При некоторых типах рака, таких как метастазирующая карцинома и некоторые развитые меланомы, экспрессия неприлизина повышена[11]. При других типах злокачественных опухолей, в первую очередь при раке лёгкого, неприлизин понижен и, таким образом, не способен модулировать пролиферативный аутокринный перенос сигнала раковых клеток, опосредованный секретируемыми пептидными гормонами такими, как гомологи бомбезина[12].
Было обнаружено, что экстракты из некоторых растений (метанольные экстракты из Ceropegia rupicola, Kniphofia sumarae, Plectranthus cf barbatus и водные экстракты из Pavetta longiflora) способны ингибировать ферментативную активность неприлизина[13].
Ингибиторы
Ингибиторы неприлизина разрабатывались с целью получения анальгетиков и антигипертезивных препаратов, которые предотвращают активность неприлизина, расщепляющий такие сигнальные пептиды, как энкефалины, вещество Р, эндотелин и предсердный натрийуретический пептид[9][10]. Другие разрабатывались для лечения сердечной недостаточности[14].
- Сакубитрил/валсартан, тестирован в сравнении с эналаприлом у больных с сердечной недостаточностью[14].
- Сакубитрил, пролекарство, компонент комплексого препарата сакубитрил/валсартан.
- Сакубитрилат (LBQ657), метаболит и активная форма сакубитрила.
- RB-101, ингибитор энкефалиназы, используется только для исследовательских целей.
- UK-414,495
- Омапатрилат, двойной инибитор неприлизина и ангиотензинпревращающего фермента. Может вызывать ангионевротический отёк. Другие двойные ингибиторы также были разработаны[15].
- Экадотрил.
- Кандокситрил.
Примечания
- Entrez Gene: Membrane metallo-endopeptidase. Дата обращения: 26 января 2022. Архивировано 26 января 2022 года.
- Galy, Anne; Travis, Marilyn; Cen, Dazhi; Chen, Benjamin (Oct 1995). “Human T, B, natural killer, and dendritic cells arise from a common bone marrow progenitor cell subset”. Immunity. 3 (4): 459—73. DOI:10.1016/1074-7613(95)90175-2. PMID 7584137.
- Singh C. CD10. CD Markers. PathologyOutlines.com, Inc. (25 февраля 2011). Дата обращения: 26 января 2022. Архивировано 19 октября 2021 года.
- Papandreou CN, Nanus DM (January 2010). “Is methylation the key to CD10 loss?”. J. Pediatr. Hematol. Oncol. 32 (1): 2—3. DOI:10.1097/MPH.0b013e3181c74aca. PMID 20051779.
- Madani R, Poirier R, Wolfer DP, Welzl H, Groscurth P, Lipp HP, Lu B, El Mouedden M, Mercken M, Nitsch RM, Mohajeri MH (December 2006). “Lack of neprilysin suffices to generate murine amyloid-like deposits in the brain and behavioral deficit in vivo”. J. Neurosci. Res. 84 (8): 1871—8. DOI:10.1002/jnr.21074. PMID 16998901. Неизвестный параметр
|s2cid=(справка) - Iwata N, Tsubuki S, Takaki Y, Watanabe K, Sekiguchi M, Hosoki E, Kawashima-Morishima M, Lee HJ, Hama E, Sekine-Aizawa Y, Saido TC (February 2000). “Identification of the major Abeta1-42-degrading catabolic pathway in brain parenchyma: suppression leads to biochemical and pathological deposition”. Nat. Med. 6 (2): 143—50. DOI:10.1038/72237. PMID 10655101. Неизвестный параметр
|s2cid=(справка) - Iwata N, Higuchi M, Saido TC (November 2005). “Metabolism of amyloid-beta peptide and Alzheimer's disease”. Pharmacol. Ther. 108 (2): 129—48. DOI:10.1016/j.pharmthera.2005.03.010. PMID 16112736.
- Wang DS, Iwata N, Hama E, Saido TC, Dickson DW (October 2003). “Oxidized neprilysin in aging and Alzheimer's disease brains”. Biochem. Biophys. Res. Commun. 310 (1): 236—41. DOI:10.1016/j.bbrc.2003.09.003. PMID 14511676.
- Sahli S, Stump B, Welti T, Schweizer WB, Diederich R, Blum-Kaelin D, Aebi JD, Böhm HJ (April 2005). “A New Class of Inhibitors for the Metalloprotease Neprilysin Based on a Central Imidazole Scaffold”. Helvetica Chimica Acta. 88 (4): 707—730. DOI:10.1002/hlca.200590050.
- Oefner C, Roques BP, Fournie-Zaluski MC, Dale GE (February 2004). “Structural analysis of neprilysin with various specific and potent inhibitors”. Acta Crystallogr. D. 60 (Pt 2): 392—6. DOI:10.1107/S0907444903027410. PMID 14747736.
- Velazquez EF, Yancovitz M, Pavlick A, Berman R, Shapiro R, Bogunovic D, O'Neill D, Yu YL, Spira J, Christos PJ, Zhou XK, Mazumdar M, Nanus DM, Liebes L, Bhardwaj N, Polsky D, Osman I (2007). “Clinical relevance of neutral endopeptidase (NEP/CD10) in melanoma”. J Transl Med. 5 (1): 2. DOI:10.1186/1479-5876-5-2. PMC 1770905. PMID 17207277.
- Cohen AJ, Bunn PA, Franklin W, Magill-Solc C, Hartmann C, Helfrich B, Gilman L, Folkvord J, Helm K, Miller YE (February 1996). “Neutral endopeptidase: variable expression in human lung, inactivation in lung cancer, and modulation of peptide-induced calcium flux”. Cancer Res. 56 (4): 831—9. PMID 8631021. Архивировано из оригинала 2013-02-23. Дата обращения 2022-01-27. Используется устаревший параметр
|deadlink=(справка) - Alasbahi R, Melzig MF (January 2008). “Screening of some Yemeni medicinal plants for inhibitory activity against peptidases”. Pharmazie. 63 (1): 86—8. DOI:10.1055/s-2008-1047849. PMID 18271311.
- McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, Rouleau JL, Shi VC, Solomon SD, Swedberg K, Zile MR (Sep 2014). “Angiotensin-neprilysin inhibition versus enalapril in heart failure”. The New England Journal of Medicine. 371 (11): 993—1004. DOI:10.1056/NEJMoa1409077. HDL:10993/27659. PMID 25176015.
- Venugopal J (2003). “Pharmacological modulation of the natriuretic peptide system”. Expert Opinion on Therapeutic Patents. 13 (9): 1389—1409. DOI:10.1517/13543776.13.9.1389. Неизвестный параметр
|s2cid=(справка)
Ссылки
- Молекулярная биология регуляции артериального давления и фармакологические мишени управления гемодинамикой: 3. Гуморальная регуляция тонуса гладких мышц сосудов и ОЦК: 3.11. Неприлизин. ВолгГМУ. Дата обращения: 26 января 2022. Архивировано 26 января 2022 года.