Фруктоза
Фруктоза (левулоза, фруктовый сахар), C6H12O6 — моносахарид из группы кетогексоз, изомер глюкозы. Один из наиболее распространённых в природе сахаров: встречается как в индивидуальном состоянии, так и в составе дисахаридов (сахарозы) и полисахаридов (инулина). Широко применяется в пищевой промышленности как подсластитель. Выполняет важные биохимические функции в организме человека.
| Фруктоза[1][2] | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
(3S,4R,5R)-1,3,4,5,6-пентагидроксигексан-2-он (D-фруктоза), (3R,4S,5S)-1,3,4,5,6-пентагидроксигексан-2-он (L-фруктоза) |
| Традиционные названия | Фруктоза, фруктовый сахар, плодовый сахар, левулоза, арабино-гексулоза |
| Хим. формула | C6H12O6 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 180,159 г/моль |
| Плотность | 1,598 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | β-D-фруктоза: 102–104 °C |
| • кипения | 440 °C |
| • воспламенения | 219 °C |
| Энтальпия | |
| • плавления | 33,0 кДж/моль |
| • растворения | –37,69 кДж/кг |
| Химические свойства | |
| Константа диссоциации кислоты | 11,90 |
| Растворимость | |
| • в воде | 400 г/100 мл |
| • в этаноле | 6,7118 °C г/100 мл |
| Вращение |
α-D-фруктоза: –133,5° → –92° β-D-фруктоза: –63,6° → –92° |
| Оптические свойства | |
| Показатель преломления | 1,617 |
| Структура | |
| Дипольный момент | 15,0 Д |
| Классификация | |
| Рег. номер CAS | 57-48-7 |
| PubChem | 5984 |
| Рег. номер EINECS | 200-333-3 |
| SMILES | |
| InChI | |
| ChEBI | 48095 |
| ChemSpider | 5764 |
| Безопасность | |
| ЛД50 | 15 г/кг (кролики, внутривенно)[3] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
История
Фруктоза была открыта Августин-Пьер Дюбрунфо в 1847 году в ходе сравнительного исследования молочнокислого и спиртового брожения сахара, полученного из сахарозы сахарного тростника. Дюбрунфо обнаружил, что в ходе молочнокислого брожения в ферментационной жидкости присутствует сахар, угол вращения которого отличается от уже известной в то время глюкозы[4].
В 1861 году Александр Михайлович Бутлеров синтезировал смесь сахаров — «формозу» — конденсацией формальдегида (муравьиного альдегида) в присутствии катализаторов: Ba(OH)2 и Ca(OH)2, одним из компонентов этой смеси является фруктоза[5].
Строение молекулы
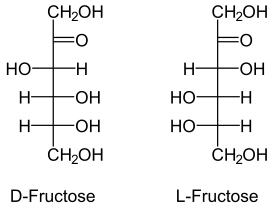
Фруктоза является моносахаридом и принадлежит к классу кетогексоз. Это полигидроксикетон с кетогруппой при атоме C-2 и пятью гидроксильными группами. В структуре фруктозы есть три хиральных атома углерода, поэтому такой структуре соответствует восемь стереоизомеров (четыре пары энантиомеров): сама фруктоза, а также её стереоизомеры сорбоза, тагатоза и псикоза[6].

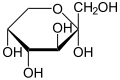
В твёрдом состоянии и в растворах фруктоза существует не в линейной форме, а в виде циклического полуацеталя, образованного в результате присоединения ОН-групп при атоме С-5 или С-6 к кетогруппе. Этот полуацеталь устойчив: в растворе доля открытоцепной формы составляет лишь 0,5 %, тогда как остальные 99,5 % приходятся на циклические формы. Если в циклизации участвует гидроксильная группа при С-5, образуется пятичленный цикл, который называется фуранозным (от названия фурана — пятичленного гетероцикла с одним атомом кислорода), а циклическую D-фруктозу называют D-фруктофуранозой. Если циклизация происходит за счёт гидроксильной группы при C-6, образуется шестичленный, пиранозный цикл (от названия пирана), а такая циклическая D-фруктоза называется D-фруктопиранозой[6].

При описанной циклизации возникает новый стереоцентр при полуацетальном атоме углерода С-2, поэтому фуранозная и пиранозная формы D-фруктозы могут дополнительно существовать в виде двух диастереомеров, называемых аномерами: α-D-фруктофуранозы и β-D-фруктофуранозы; α-D-фруктопиранозы и β-D-фруктопиранозы. Обычно циклические формы D-фруктозы изображают при помощи проекций Хеуорса — идеализированных шестичленных циклов с заместителями над и под плоскостью цикла[6].
| Изомерные формы D-фруктозы | ||
|---|---|---|
| Открытоцепная форма | Циклические формы | |
 |
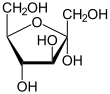 α-D-фруктофураноза |
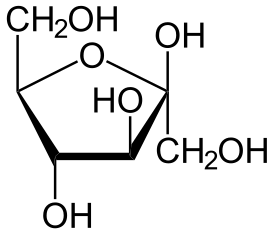 β-D-фруктофураноза |
 α-D-фруктопираноза |
 β-D-фруктопираноза | |
Более точно структуру аномеров D-фруктозы изображают в виде конформации «кресло», которая является наиболее устойчивой для пиранозного цикла, и в виде конформаций «конверт» и «твист» для фуранозного цикла. Точная конформация для фураноз неизвестна[6].
В растворе эти формы D-фруктозы находятся в равновесии. Среди них преобладает пиранозная форма, но при повышении температуры её доля немного уменьшается[7]. Преобладание β-D-фруктопиранозы объясняют наличием водородной связи между гидроксильными группами при С-1 и С-3. В 10%-м растворе при комнатной температуре D-фруктоза имеет следующее распределение циклических форм:
- α-D-фруктофураноза — 5,5 %;
- β-D-фруктофураноза — 22,3 %;
- α-D-фруктопираноза — 0,5 %;
- β-D-фруктопираноза — 71,4 %[6].
Кристаллическая D-фруктоза представляет собой β-D-фруктопиранозу; другие циклические изомеры выделены только в виде производных. В таких соединениях, как сахароза, рафиноза и инулин, D-фруктоза находится в виде β-D-фруктофуранозы[6].
L-фруктоза не встречается в природе, но её можно синтезировать химически либо получить микробиологически из L-маннозы или L-маннита[6].
Физические свойства
D-фруктоза представляет собой бесцветные кристаллы в виде призм или игл с температурой плавления 103—105 °С. Обычно кристаллизуется в безводном виде, но ниже 20 °С устойчивы также полугидрат и дигидрат[8].
D-фруктоза растворима в воде, пиридине, хинолине, ацетоне, метаноле, этаноле, ледяной уксусной кислоте. Её растворимость в воде выше, чем у других сахаров и составляет 4 г на 1 г воды при 25 °С. Доля сухого вещества в насыщенном растворе фруктозы при 20 °С составляет 78,9 %, а при 55 °С — 88,1 %. Из-за такой высокой растворимости при промышленной кристаллизации фруктозы из растворов возникают проблемы с высокой вязкостью этих растворов: при 50 °С динамическая вязкость насыщенного раствора фруктозы составляет 1630 мПа·с, тогда как для сахарозы она равна всего 96,5 мПа·с[2].
Фруктоза — самый сладкий из природных сахаров. Кристаллическая фруктоза в 1,8 раза слаще кристаллической сахарозы. Это позволяет рассматривать фруктозу как перспективный подсластитель, который обеспечивает такую же сладость, как сахароза, но при этом имеет более низкую пищевую ценность. Сладость фруктозы в растворах зависит от температуры, pH и концентрации: она повышается при охлаждении раствора (это объясняют повышением доли более сладких пиранозных форм[9]) и при подкислении раствора[2].
Получение
Сырьё для производства
Фруктоза широко представлена в природе как в индивидуальном виде, так и в составе сахарозы (в которую наряду с D-фруктозой входит остаток D-глюкозы). Во многих растениях встречаются полимеры D-фруктозы — фруктаны. Больше всего фруктозы содержится в мёде (40 г в 100 г), яблоках (6-8 г), грушах (5-9 г), черносливе (15 г)[10].
Наиболее экономически целесообразно в качестве сырья для производства фруктозы использовать крахмал, сахарозу и инулин. Крахмал производят преимущественно из кукурузы. Это полисахарид, который состоит из звеньев D-глюкозы. Поскольку фруктоза в крахмале не содержится, необходимо подобрать такой процесс, в котором глюкоза будет легко превращаться во фруктозу. Сахароза — это крупнотоннажный промышленный продукт, являющийся практически идеальным сырьём для производства фруктозы за счёт очень хорошей доступности, высокой чистоты и высокого изначального содержания фруктозы. Инулин — это фруктан, который получают из корней цикория (15—20 % от общей массы) и клубней артишока[10].
Производство из крахмала

Фруктозу получают из крахмала в несколько стадий: крахмал разжижают (при этом происходит его частичный гидролиз), затем разлагают его до глюкозы, полученную глюкозу изомеризуют во фруктозу, фруктозу выделяют из раствора. Разработаны ферментативные способы этих преобразований. Например, крахмал превращают в глюкозу под действием α-амилазы и глюкоамилазы, а глюкозу во фруктозу — под действием глюкозоизомеразы. Глюкозоизомераза на самом деле называется ксилозоизомеразой, поскольку она также превращает D-ксилозу в D-ксилулозу, а D-рибозу — в D-рибулозу. Способ получения фруктозы из крахмала был разработан в 1966 году. С 1968 года так получают 42%-ый фруктозный сироп. Хроматографическая очистка позволяет повысить чистоту фруктозы до 90 %[10].
Производство из сахарозы
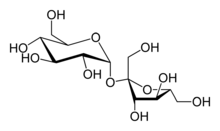
На основе сахарозы был создан первый коммерческий способ получения фруктозы: сахарозу гидролизовали, после чего полученные фруктозу и глюкозу разделяли хроматографически. Современные методы позволяют проводить гидролиз сахарозы высокоселективным ферментативным способом (под действием β-фруктофуранозидазы из Saccharomyces cerevisiae) либо минеральными кислотами (соляной или серной). Недостатком первого способа является высокая цена фермента и невозможность проводить непрерывный процесс. С другой стороны, при гидролизе минеральными кислотами образуются нежелательные побочные продукты. Наиболее продвинутым способом является гидролиз иммобилизованными сильнокислыми катионитами: он позволяет гидролизовать 50—60%-ые растворы сахарозы при температуре 30—45 °С практически без образования побочных продуктов. Полученные сахара разделяют хроматографией, получая две фракции с чистотой выше 95 %[11].
Производство из инулина
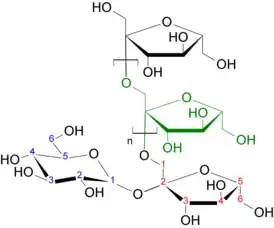
Производство фруктозы из инулина, который в свою очередь получается из цикория, было организовано в середине 1990-х годов. В основе этого метода также лежит гидролиз, который можно реализовать ферментативно или под действием кислот. Кислотный гидролиз представляет лишь научный интерес, поскольку различные испытанные кислоты (серная, соляная, фосфорная, лимонная, щавелевая, винная) приводили к разложению фруктозы и образованию побочных продуктов. Ведётся поиск других кислотных катализаторов, среди которых более мягкими показали себя цеолиты[12].
Среди ферментов выгодно отличаются экзоинулиназа и эндоинулиназа из Aspergillus niger, смесь которых позволяет превратить инулин во фруктозу в одну стадию. Производство фруктозы из крахмала требует гораздо больше ферментативных стадий и даёт выход фруктозы лишь в 45 %. Гидролиз проводится в нейтральной или слабокислой среде при 60 °С и занимает 12—24 ч. Содержание фруктозы в сиропе составляет 85—95 %; остальное приходится на глюкозу (3—13 %) и олигосахариды (1—2 %). Полученный сироп очищают от неорганических примесей, обесцвечивают и концентрируют[12].
Получение кристаллической фруктозы

Кристаллизация фруктозы после синтеза является сложной стадией, поэтому необходимо, чтобы раствор содержал минимум 90 % фруктозы от общей массы растворённых веществ. Применяют различные комбинации условий, включая кристаллизацию при атмосферном либо пониженном давлении, различные режимы охлаждения, непрерывные или периодические процессы, однако в качестве растворителя всегда используется вода, поскольку отделение и регенерация растворителя требует слишком много усилий. Кристаллический продукт отделяют от маточного раствора в центрифугах, а затем сушат. Кристаллизации мешает примесь глюкозы: она повышает растворимость фруктозы в воде и снижает пересыщенность раствора. Также в процессе кристаллизации образуются димеры фруктозы, которые сокристаллизуются с фруктозой и мешают росту кристаллов[13].
Химические свойства
Фруктоза вступает в химические реакции, типичные для моносахаридов, образуя простые и сложные эфиры, а также ацетали и гликозиды. За счёт наличия карбонильной группы она даёт продукты присоединения нуклеофильных реагентов: аминов, аминокислот, пептидов и др. С фенилгидразином она даёт озазон, идентичный озазону глюкозы или маннозы[14][8].
Фруктозу можно восстановить, в том числе ферментативно, до маннита или сорбита. На каталитическом гидрировании карбонильной группы фруктозы в присутствии никелевого или медного катализатора основан промышленный способ получения маннита. В промышленности также проводят каталитическое окисление фруктозы воздухом или кислородом в присутствии катализаторов на основе благородных металлов. При этом образуются два основных продукта: 2-кето-D-глюконовая кислота и 5-кетофруктоза[14].
В отличие от глюкозы и других альдоз, фруктоза неустойчива как в щелочных, так и кислых растворах. В щелочной среде фруктоза через ендиольную форму изомеризуется в глюкозу и маннозу с небольшой примесью псикозы (перегруппировка Лобри де Брюина — Ван Экенштейна). При нагревании в щелочных условиях фруктоза фрагментируется, давая глицеральдегиды, молочную кислоту, метилглиоксаль и другие продукты разложения[14][8]}.
При нагревании твёрдой фруктозы или её насыщенного раствора приводит к дегидратации и образованию продуктов конденсации. Нагревание в присутствии аминокислот приводит к окрашенным и пахучим продуктам реакции Майяра. При нагревании в присутствии кислоты также происходит дегидратация и образуется 5-гидроксиметилфурфурол. Это свойство является основой для качественной реакции на фруктозу — пробы Селиванова[14].

Доступность D-фруктозы и её низкая стоимость обуславливают её использование в стереоселективном синтезе в качестве хирального исходного соединения. В частности, из неё получают такие редкие сахара, как D-псикозу[14].
Применение
Благодаря некоторым особенным свойствам фруктоза широко используется как подсластитель. Её повышенная сладость и синергетическое действие с другими подсластителями позволяет добавлять в продукты меньше сахара, поэтому её часто используют в низкокалорийной пище. Также она способна усиливать фруктовые вкусы. Фруктоза обладает высокой растворимостью при низких температурах и сильно понижает температуру плавления своих растворов, поэтому её использование представляет интерес в производстве мороженого, где эти свойства важны для текстуры продукта[15].
Фруктоза широко применяется в напитках (газированных, спортивных, низкокалорийных и т. д.), замороженных десертах, выпечке, консервированных фруктах, шоколаде, конфетах и молочных продуктах. Благодаря хорошей растворимости в этаноле она применяется в сладких ликёрах[15].
Биологическая роль
Всасывание фруктозы происходит в тонкой кишке за счёт облегчённой диффузии под действием белка-переносчика GLUT5. В кровь фруктоза попадает через воротную вену, а затем переносится в печень, где преимущественно и накапливается. При повышенном потреблении она частично метаболизируется до лактата уже в слизистой кишечника, который затем в печени превращается в глюкозу. Фруктоза метаболизируется в организме путём фосфорилирования под действием фруктокиназы до фруктозо-1-фосфата. Он затем разлагается на дигидроксиацетонфосфат и D-глицериновый альдегид. Триозокиназа затем превращает последний в глицеральдегид-3-фосфат. Таким образом, при метаболизме фруктоза даёт преимущественно глюкозу, гликоген и лактат[16].
Влияние фруктозы на уровень глюкозы в крови очень маленькое. Её гликемический индекс равен 32, что объясняется её частичным превращением в глюкозу в печени. Фруктоза слабо стимулирует секрецию инсулина и может проникать в клетки без его участия, поэтому она рекомендована как подсластитель для диабетиков[16].
С потреблением фруктозы связано такое редкое генетическое заболевание, как наследственная непереносимость фруктозы. Оно связано с отсутствием фермента, разлагающего фруктозо-1-фосфат, из-за чего происходит накопление последнего в печени. Это ведёт к блокировке гликолиза и глюконеогенеза, а затем к гипогликемии[16].
Биохимические механизмы токсичности фруктозы
Эволюционные предпосылки
Считается, что чрезмерное потребление продуктов, богатых фруктозой, приводит к негативным последствиям для здоровья.[17][18][19] В отличие от глюкозы, метаболизм которой более жестко управляется ферментом фосфофруктокиназой-1, метаболизм и регулирование обмена фруктозы происходит менее сложным способом. Фермент фруктокиназа, активирующий фруктозу внутриклеточно с помощью фосфорилирования для включения ее в метаболические пути, не подвергается отрицательному обратному контролю со стороны последующих промежуточных звеньев гликолиза, цикла Кребса или энергоносителей, как имеет место в случае глюкозы.[20][21][22] Это может приводить к эшелонированию большого количества ацетил-КоА, образующегося в результате метаболизма фруктозы, в реакции биосинтеза жирных кислот.[23][24] Активация путей биосинтеза жирных кислот приводит к значительному увеличению скорости генерации и накопления различных жиров. Предполагается, что у некоторых впадающих в спячку млекопитающих такое слабо регулируемое использование фруктозы может иметь положительную адаптивную роль.[25] Быстрое накопление жира за счет употребления поспевших плодов с высоким содержанием фруктозы, поспевших осенью, позволяет им за короткое время сформировать значительный запас энергии. У некоторых животных, обитающих в местах с ярко выраженной сезонностью, этот механизм также может способствовать накоплению жира для повышения выносливости и выживания зимой, когда количество добываемой пищи резко снижается.[26] Считается, что этот механизм присутствует также у приматов, в том числе и у человека. Более того, его остаточные эффекты могут принести больше вреда, чем пользы, поскольку в современном обществе спячка не является движущей силой отбора, а человеческий метаболизм не приспособился справляться с чрезмерным потреблением калорий/углеводов.[21][26]
Биохимические механизмы
Умеренное потребление фруктов обычно не увеличивает содержания фруктозы в крови, поскольку тонкая кишка преобразует ее в глюкозу[уточнить].[27] Однако при искусственном добавлении фруктозы в пищевые продукты или употреблении большого количества фруктозы или плодов, богатых сахарозой (состоящей из глюкозы и фруктозы) она может заметно достигать системного кровообращения.[28] Системная биодоступность фруктозы положительно коррелирует с повышенным de novo липогенезом, торможением окисления жирных кислот, повышенным содержанием жиров в печени, постпрандиальных триглицеридов, холестерина, липопротеинов низкой плотности (ЛПНП), липопротеинов высокой плотности (ЛПВП) и С-реактивного белка. Эти эффекты значительно более выражены в отношении потребления фруктозы по сравнению с избыточным потреблением глюкозы.[29] Более того, липогенный эффект фруктозы усиливается на фоне потребления насыщенных жирных кислот.[30] Такое синергетическое действие, скорее всего, возникает в случае рационов, на основе фастфудов, в которые, как правило, добавляются большие количества сахара и переработанных масел с высоким содержанием жиров.[31]

Промежуточные продукты метаболизма фруктозы также могут активировать гликолитический путь, входя в него через глицеральдегид-3-фосфат и дигидроксиацетонфосфат, что может быть особенно пагубным при онкологических заболеваниях из-за эффекта Варбурга.[32] Транзиторное внутриклеточное истощение фосфатов из-за чрезмерного фосфорилирования фруктозы фруктокиназой также может влиять на пуриновый метаболизм, приводя к повышенной выработке мочевой кислоты. Мочевая кислота, в свою очередь, может способствовать липогенезу, а также выступать посредником в других патологических процессах, которые играют важную роль в развитии метаболического синдрома, высокого артериального давления и подагры.[33] Отрицательные метаболические эффекты фруктозы усугубляются ее неспособностью, в отличие от глюкозы, вызывать чувство насыщения. Это может быть причиной менее контролируемого или чрезмерного потребления пищи, богатой фруктозой.[34]
Ингибирование метаболизма фруктозы
Наследственный дефицит фруктокиназы, по-видимому, не имеет каких-либо явных негативных последствий для здоровья человека[35] и даже, напротив, может приводить к улучшенному прогнозу в популяциях, рационы которых включают большое количество фруктозы.[36] Скорее всего, в отсутствие нормальной активности фруктокиназы метаболизм экзогенной фруктозы будет снижаться, поскольку метаболиты фруктозы не смогут ни включаться в биосинтез ацетил-КоА, ни стимулировать синтез и накопление липидов. Чрезмерное количество фруктозы будет просто выделяться с мочой, приводя к фруктозурии — практически безвредному медицинскому состоянию, которое может быть случайно обнаружено во время медицинского осмотра по несвязанным причинам.[37] Показано, что ингибирование фруктокиназы может быть полезным и при остром ишемическом поражении почек, так как при этом нарушении фруктоза опосредует окислительный стресс и повреждение клеток.[38][39] Предполагается, что предотвращение или снижение метаболизма экзогенной фруктозы будет благоприятным с точки зрения углеводного и липидного обмена, а также снизит выработку мочевой кислоты, что также является положительным моментом, поскольку увеличение накопления мочевой кислоты вызывает окислительный стресс и воспаление.[40] Лютеолин, ингредиент некоторых БАДов, использовался в исследованиях на животных для ингибирования метаболизма фруктозы и показал благоприятные эффекты при нарушении патологических процессов, опосредованного фруктозой. Однако клиническая значимость этих результатов для человека неизвестна.[37]
Примечания
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — 2-е издание. — Химия, 1978.
- Ullmann, 2004, p. 104–106.
- D-(–)-Fructose. Sigma-Aldrich. Дата обращения: 16 апреля 2019.
- «Sur une propriété analytique des fermentations alcoolique et lactique, et sur leur application à l’étude des sucres» Архивировано 27 июня 2014 года. Annales de Chimie et de Physique, 21: 169—178.]
- Орлов Н.А. А. М. Бутлеров и его значение в современной химии. // Природа. — 1928. — № 12.
- Ullmann, 2004, p. 103–104.
- Cockman M., Kubler D. G., Oswald A. S., Wilson L. The Mutarotation of Fructose and the Invertase Hydrolysis of Sucrose : [англ.] // Journal of Carbohydrate Chemistry. — 1987. — Vol. 6, no. 2. — P. 181–201. — doi:10.1080/07328308708058870.
- Химическая энциклопедия, 1998.
- Fontvieille A. M., Faurion A., Helal I., Rizkalla S. W., Falgon S., Letanoux M., Tchobroutsky G., Slama G. Relative Sweetness of Fructose Compared With Sucrose in Healthy and Diabetic Subjects : [англ.] // Diabetes Care. — 1989. — Vol. 12, no. 7. — P. 481–486. — doi:10.2337/diacare.12.7.481.
- Ullmann, 2004, p. 107.
- Ullmann, 2004, p. 108–109.
- Ullmann, 2004, p. 109–110.
- Ullmann, 2004, p. 110.
- Ullmann, 2004, p. 106–107.
- Ullmann, 2004, p. 111.
- Ullmann, 2004, p. 114–115.
- Bray GA, Nielsen SJ, Popkin BM (Apr 2004). “Consumption of high-fructose corn syrup in beverages may play a role in the epidemic of obesity”. Cell. 79 (4): 537–43. DOI:10.1093/ajcn/79.4.537. PMID 15051594.
- Dornas WC, de Lima WG, Pedrosa ML, Silva ME (Nov 13, 2015). “Health implications of high-fructose intake and current research”. Adv Nutr. 6 (6): 729—37. DOI:10.3945/an.114.008144. PMID 26567197.
- Kroemer G, López-Otín C, Madeo F, de Cabo R (Oct 18, 2018). “Carbotoxicity-Noxious Effects of Carbohydrates”. Cell. 175 (3): 601—614. DOI:10.1016/j.cell.2018.07.044. PMID 30340032.
- Kratzer JT, Lanaspa MA, Murphy MN, Cicerchi C, Graves CL, Tipton PA, Ortlund EA, Johnson RJ, Gaucher EA (Mar 11, 2014). “Evolutionary history and metabolic insights of ancient mammalian uricases”. Proc Natl Acad Sci U S A. 111 (10): 3763—8. DOI:10.1073/pnas.1320393111. PMID 24550457.
- Tesz GJ, Bence KK (Jul 7, 2020). “Finding the Sweet Spot: Parsing Tissue-Specific Contributions of Fructose Metabolism”. Cell Metab. 32 (1): 6—8. DOI:10.1016/j.cmet.2020.06.009. PMID 32640246.
- Lim JS, Mietus-Snyder M, Valente A, Schwarz JM, Lustig RH (May 2010). “The role of fructose in the pathogenesis of NAFLD and the metabolic syndrome”. Nat Rev Gastroenterol Hepatol. 7 (5): 251—64. DOI:10.1038/nrgastro.2010.41. PMID 20368739.
- Douard V, Ferraris RP (Jan 15, 2013). “The role of fructose transporters in diseases linked to excessive fructose intake”. J Physiol. 591 (2): 401—14. DOI:10.1113/jphysiol.2011.215731. PMID 23129794.
- Shapiro A, Mu W, Roncal C, Cheng KY, Johnson RJ, Scarpace PJ (Nov 2008). “Fructose-induced leptin resistance exacerbates weight gain in response to subsequent high-fat feeding”. Am J Physiol Regul Integr Comp Physiol. 295 (5): R1370–5. DOI:10.1152/ajpregu.00195.2008. PMID 18703413.
- Stenvinkel P, Fröbert O, Anderstam B, Palm F, Eriksson M, Bragfors-Helin AC, Qureshi AR, Larsson T, Friebe A, Zedrosser A, Josefsson J, Svensson M, Sahdo B, Bankir L, Johnson RJ (Sep 9, 2013). “Metabolic changes in summer active and anuric hibernating free-ranging brown bears (Ursus arctos)”. PLoS One. 8 (9): e72934. DOI:10.1371/journal.pone.0072934. PMID 24039826.
- Johnson RJ, Stenvinkel P, Andrews P, Sánchez-Lozada LG, Nakagawa T, Gaucher E, Andres-Hernando A, Rodriguez-Iturbe B, Jimenez CR, Garcia G, Kang DH, Tolan DR, Lanaspa MA (Mar 2020). “Fructose metabolism as a common evolutionary pathway of survival associated with climate change, food shortage and droughts”. J Intern Med. 287 (3): 252–262. DOI:10.1111/joim.12993. PMID 31621967.
- Jang S, Dilger RN, Johnson RW (Oct 2010). “Luteolin inhibits microglia and alters hippocampal-dependent spatial working memory in aged mice”. J Nutr. 140 (10): 1892–8. DOI:10.3945/jn.110.123273. PMID 20685893.
- Rendeiro, C; Masnik, AM; Mun, JG; Du, K; Clark, D; Dilger, RN; Dilger, AC; Rhodes, JS (20 April 2015). “Fructose decreases physical activity and increases body fat without affecting hippocampal neurogenesis and learning relative to an isocaloric glucose diet”. Scientific reports. 5: 9589. DOI:10.1038/srep09589. PMID 25892667.
- Jameel, F; Phang, M; Wood, LG; Garg, ML (16 December 2014). “Acute effects of feeding fructose, glucose and sucrose on blood lipid levels and systemic inflammation”. Lipids in health and disease. 13: 195. DOI:10.1186/1476-511X-13-195. PMID 25515398.
- Chiu, S; Mulligan, K; Schwarz, JM (July 2018). “Dietary carbohydrates and fatty liver disease: de novo lipogenesis”. Current opinion in clinical nutrition and metabolic care. 21 (4): 277–282. DOI:10.1097/MCO.0000000000000469. PMID 29697539.
- DiNicolantonio, JJ; Lucan, SC; O'Keefe, JH (March 2016). “The Evidence for Saturated Fat and for Sugar Related to Coronary Heart Disease”. Progress in cardiovascular diseases. 58 (5): 464–72. DOI:10.1016/j.pcad.2015.11.006. PMID 26586275.
- Nakagawa, T; Lanaspa, MA; Millan, IS; Fini, M; Rivard, CJ; Sanchez-Lozada, LG; Andres-Hernando, A; Tolan, DR; Johnson, RJ (2020). “Fructose contributes to the Warburg effect for cancer growth”. Cancer & metabolism. 8: 16. DOI:10.1186/s40170-020-00222-9. PMID 32670573.
- Kroemer, G; López-Otín, C; Madeo, F; de Cabo, R (18 October 2018). “Carbotoxicity-Noxious Effects of Carbohydrates”. Cell. 175 (3): 605–614. DOI:10.1016/j.cell.2018.07.044. PMID 30340032.
- Page, KA; Chan, O; Arora, J; Belfort-Deaguiar, R; Dzuira, J; Roehmholdt, B; Cline, GW; Naik, S; Sinha, R; Constable, RT; Sherwin, RS (2 January 2013). “Effects of fructose vs glucose on regional cerebral blood flow in brain regions involved with appetite and reward pathways”. JAMA. 309 (1): 63–70. DOI:10.1001/jama.2012.116975. PMID 23280226.
- Tran, C (3 April 2017). “Inborn Errors of Fructose Metabolism. What Can We Learn from Them?”. Nutrients. 9 (4). DOI:10.3390/nu9040356. PMID 28368361.
- Andres-Hernando, A; Orlicky, DJ; Kuwabara, M; Ishimoto, T; Nakagawa, T; Johnson, RJ; Lanaspa, MA (7 July 2020). “Deletion of Fructokinase in the Liver or in the Intestine Reveals Differential Effects on Sugar-Induced Metabolic Dysfunction”. Cell metabolism. 32 (1): 117–127.e3. DOI:10.1016/j.cmet.2020.05.012. PMID 32502381.
- Froesch, ER (November 1976). “Disorders of fructose metabolism”. Clinics in endocrinology and metabolism. 5 (3): 599–611. DOI:10.1016/s0300-595x(76)80042-4. PMID 189957.
- Andres-Hernando, A; Li, N; Cicerchi, C; Inaba, S; Chen, W; Roncal-Jimenez, C; Le, MT; Wempe, MF; Milagres, T; Ishimoto, T; Fini, M; Nakagawa, T; Johnson, RJ; Lanaspa, MA (13 February 2017). “Protective role of fructokinase blockade in the pathogenesis of acute kidney injury in mice”. Nature communications. 8: 14181. DOI:10.1038/ncomms14181. PMID 28194018.
- Cirillo, P; Gersch, MS; Mu, W; Scherer, PM; Kim, KM; Gesualdo, L; Henderson, GN; Johnson, RJ; Sautin, YY (March 2009). “Ketohexokinase-dependent metabolism of fructose induces proinflammatory mediators in proximal tubular cells”. Journal of the American Society of Nephrology : JASN. 20 (3): 545–53. DOI:10.1681/ASN.2008060576. PMID 19158351.
- Ishimoto, T; Lanaspa, MA; Rivard, CJ; Roncal-Jimenez, CA; Orlicky, DJ; Cicerchi, C; McMahan, RH; Abdelmalek, MF; Rosen, HR; Jackman, MR; MacLean, PS; Diggle, CP; Asipu, A; Inaba, S; Kosugi, T; Sato, W; Maruyama, S; Sánchez-Lozada, LG; Sautin, YY; Hill, JO; Bonthron, DT; Johnson, RJ (November 2013). “High-fat and high-sucrose (western) diet induces steatohepatitis that is dependent on fructokinase”. Hepatology (Baltimore, Md.). 58 (5): 1632–43. DOI:10.1002/hep.26594. PMID 23813872.
Литература
Усов А. И. Фруктоза // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 192. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Wach W. Fructose (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2004. — doi:10.1002/14356007.a12_047.pub2.
Ссылки
- 1Н и 13С ЯМР-спектры D-фруктозы. Sigma-Aldrich. Дата обращения: 16 апреля 2019.
- КР-спектр D-фруктозы. Sigma-Aldrich. Дата обращения: 16 апреля 2019.
- Фруктоза Архивная копия от 16 марта 2012 на Wayback Machine (англ.)
