Амилаза
Амила́за (др.-греч. ἄμυλον — крахмал) — фермент, гликозил-гидролаза, расщепляющий крахмал до олигосахаридов, относится к ферментам пищеварения. Расщепляет α-1,4-гликозидную связь. Амилаза присутствует в слюне человека и некоторых млекопитающих, где фермент начинает химический процесс переваривания пищи. Продукты с высоким содержанием крахмала и низким содержанием сахара, такие как рис и картофель, могут приобретать сладковатый вкус при длительном пережёвывании за счёт превращения амилазой крахмала в сахар. Поджелудочная железа и слюнные железы выделяют амилазу, расщепляющую крахмал до ди- и трисахаридов, которые, в свою очередь, превращаются другими ферментами в глюкозу, источник энергии для организма.
История
В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайен описал в 1833 году диастазу — фермент (на самом деле, смесь ферментов), расщепляющий крахмал до мальтозы. Согласно другим данным, амилазу в 1814 году открыл академик петербургской Академии наук К. С. Кирхгоф.
Классификация
По субстратной специфичности амилазы классифицируют на альфа-, бета- и гамма-амилазу.
α-Амилаза
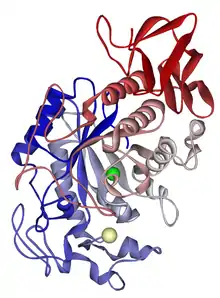
α-Амилаза (1,4-α-d-глюкан-глюканогидролаза, гликогеназа; шифр КФ — 3.2.1.1) является кальций-зависимым ферментом. К этому типу относятся амилаза слюнных желез и амилаза поджелудочной железы[1]. Она способна гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов в любом месте. Таким образом, процесс гидролиза ускоряется и приводит к образованию олигосахаридов различной длины. У животных α-амилаза является основным пищеварительным ферментом. Активность α-амилазы оптимальна в нейтральной среде (pH = 6,7—7,0). Фермент обнаружен также у растений (например, в овсе), в грибах (в аскомицетах и базидиомицетах) и бактериях (Bacillus).
β-Амилаза
β-Амилаза (1,4-α-d-глюкан-мальтогидролаза; шифр КФ — 3.2.1.2) присутствует у бактерий, грибов и растений, но отсутствует у животных. Она отщепляет вторую с конца α-1,4-гликозидную связь, образуя, таким образом, дисахарид мальтозу. При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара́, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственно прорастании семени.
β-Амилаза пшеницы является ключевым компонентом при образовании солода. Бактериальная β-амилаза участвует в разложении внеклеточного крахмала.
γ-Амилаза
γ-Амилаза (1,4-α-d-гликан-глюкогидролаза, глюкан-1,4-α-глюкозидаза, амилоглюкозидаза, экзо-1,4-α-глюкозадаза, глюкоамилаза, лизосомальная α-глюкозидаза; шифр КФ — 3.2.1.3) отщепляет последнюю α-1,4-гликозидную связь, приводя к образованию глюкозы. Кроме этого, γ-амилаза способна гидролизовать α-1,6-гликозидную связь. В отличие от других амилаз, γ-амилаза наиболее активна в кислых условиях (при pH = 3).
Применение
Некоторые виды дрожжей способны разлагать крахмал с помощью амилазы до ди- и трисахаридов, которые потом используются в жизнедеятельности, образуя в результате этанол, углекислый газ (CO2) и другие метаболиты, которые придают хлебу специфический вкус и «поднимают» тесто. Но пекарские дрожжи (Saccharomyces cerevisiae) этого не могут, поэтому в современных хлебопекарных технологиях амилаза используется как одно из важных составляющих специальной добавки. Добавление амилазы в тесто позволяет использовать для жизнедеятельности дрожжей часть крахмала муки, ускоряя тем самым процесс брожения, и одновременно позволяет изготовителю хлеба сэкономить, уменьшив количество используемого сахара.
Бактериальная амилаза используется в стиральных порошках для разложения крахмала, присутствующего в белье.
В пищевой промышленности амилаза зарегистрирована в качестве пищевой добавки E1100 как улучшитель муки и хлеба.
Примечания
- Альфа-амилаза (диастаза), кровь. АнализМаркет.
Ссылки
- Амилаза (Amylase) // Медицинские термины. — 2000.