Гликозил-гидролазы
Гликозил-гидролазы (или гликозидазы) катализируют гидролиз гликозидных связей в молекулах углеводов, приводя к появлению двух более мелких молекул углеводов. Эти ферменты встречаются в клетках почти всех живых организмов. Гликозидазы выполняют множество разнообразных функций: деградация биомассы (например, целлюлозы и гемицеллюлозы), участие в антибактериальной защите организма (например, лизоцим), развитие патогенеза (например, вирусные нейраминидазы), клеточный биосинтез (например, маннозидазы, вовлечённые в созревание N-гликозилированных гликопротеинов). Гликозидазы вместе с гликозилтрансферазами образуют основу биологического аппарата синтеза и разрушения гликозидных связей.
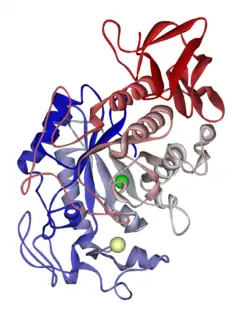

Классификация
Гликозил-гидролазы объединены в КФ 3.2.1 как ферменты, катализирующие гидролиз O- или S-гликозидов. Все гликозидазы имеют номера КФ 3.2.1.x, при этом x может быть от 1 до 165 в зависимости от субстратной специфичности фермента. На основе молекулярного механизма катализируемой ими реакции гликозидазы могут быть разбиты на две группы. Представители одной из них обращают (inverting), а другой — сохраняют (retaining) путём двойного обращения аномерную конфигурацию субстрата у продукта реакции гидролиза[1]. Гликозил-гидролазы также могут быть классифицированы как экзо- или эндо-действующие, в зависимости от того, действуют ли они соответственно на концевой или внутренний моносахаридный остаток в углеводной цепи. Более современные классификации гликозил-гидролаз основаны на сравнении их аминокислотных последовательностей. Такие классификации обладают большой предсказательной силой в отношении возможных биохимических активностей неисследованных ферментов с недавно определёнными последовательностями. Впервые классификация всех известных на тот момент последовательностей гликозидаз была предложена в 1991 году[2]. Близкородственные белки было предложено группировать в семейства. Впоследствии эволюционно родственные семейства стали объединять на более высоком иерархическом уровне в кланы[3]. Такая двухуровневая классификация в настоящее время доступна на сайте CAZy:
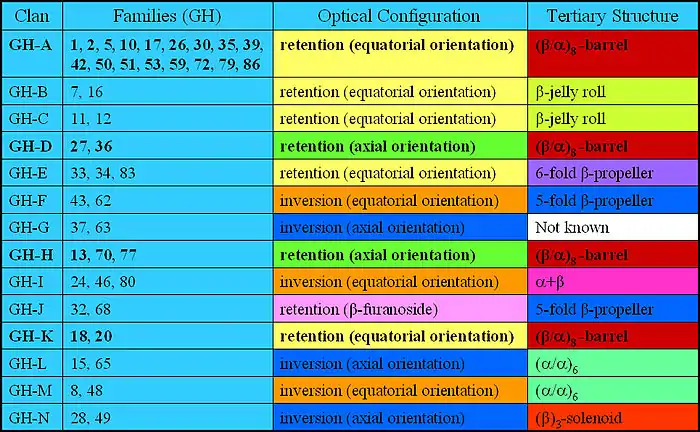
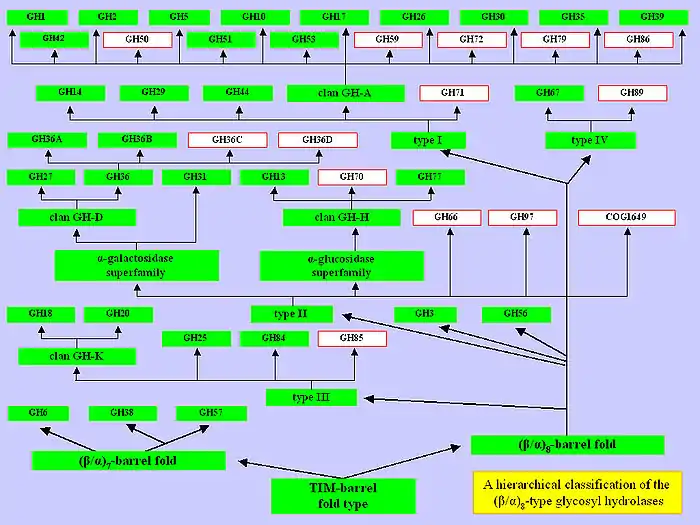
Недавние исследования позволили на основе двухуровневой классификации создать многоуровневую (иерархическую) классификацию гликозил-гидролаз и их гомологов[4][5]:
Номенклатура
Большинство гликозил-гидролаз получили свои названия по основному субстрату. Наряду с этими названиями часто также используются и названия, данные по отщепляемому углеводному остатку. Для ряда гликозил-гидролаз применяются тривиальные названия. Ниже для примера приведены названия некоторых гликозидаз и соответствующие К. Ф. номера:
- 4-α-глюканотрансфераза (К. Ф.2.4.1.25)
- α-амилаза (К. Ф.3.2.1.1)
- β-амилаза (К. Ф.3.2.1.2)
- глюкоамилаза (К. Ф.3.2.1.3)
- целлюлаза (К. Ф.3.2.1.4)
- β-ксиланаза (К. Ф.3.2.1.8)
- изомальтаза (К. Ф.3.2.1.10)
- хитиназа (К. Ф.3.2.1.14)
- лизоцим или мурамидаза (К. Ф.3.2.1.17)
- нейраминидаза (К. Ф.3.2.1.18)
- кислая α-глюкозидаза или мальтаза (К. Ф.3.2.1.20)
- β-глюкозидаза (К. Ф.3.2.1.21)
- α-галактозидаза или мелибиаза (К. Ф.3.2.1.22)
- β-галактозидаза или лактаза (К. Ф.3.2.1.23)
- α-маннозидаза (К. Ф.3.2.1.24)
- β-фруктозидаза или сахараза или инвертаза (К. Ф.3.2.1.26)
- трегалаза (К. Ф.3.2.1.28)
- β-глюкуронидаза (К. Ф.3.2.1.31)
- амило-α-1,6-глюкозидаза (К. Ф.3.2.1.33)
- гиалуронидаза (К. Ф.3.2.1.35)
- гиалуронидаза (К. Ф.3.2.1.36)
- пуллуназа (К. Ф.3.2.1.41)
- глюкоцереброзидаза (К. Ф.3.2.1.45)
- галактозилцерамидаза (К. Ф.3.2.1.46)
- сахараза (К. Ф.3.2.1.48)
- α-N-ацетилгалактозаминидаза (К. Ф.3.2.1.49)
- α-N-ацетилглюкозаминидаза (К. Ф.3.2.1.50)
- α-L-фукозидаза (К. Ф.3.2.1.51)
- гексоаминидаза (К. Ф.3.2.1.52)
- 1,2-α-L-фукозидаза (К. Ф.3.2.1.63)
- α-L-идуронидаза (К. Ф.3.2.1.76)
- 6-фосфо-β-галактозидаза (К. Ф.3.2.1.85)
- 6-фосфо-β-глюкозидаза (К. Ф.3.2.1.86)
- эндо-альфа-N-ацетилгалактозаминидаза (К. Ф.3.2.1.97)
- стриктозидин-β-глюкозидаза (К. Ф.3.2.1.105)
- лактаза (К. Ф.3.2.1.108)
- 1,3-α-L-фукозидаза (К. Ф.3.2.1.111)
- 2-дезоксиглюкозидаза (К. Ф.3.2.1.112)
- 1,6-α-L-фукозидаза (К. Ф.3.2.1.127)
- α-глюкуронидаза (К. Ф.3.2.1.139)
- тиоглюкозидаза или мирозиназа (К. Ф.3.2.1.147)
- β-примеверозидаза (К. Ф.3.2.1.149)
- 1,6-α-D-маннозидаза (К. Ф.3.2.1.163)
Примечания
- Sinnott, M. L. Chem. Rev. 1990, 90, 1171—1202.
- Henrissat, B. Biochem. J. 1991, 280, 309—316.
- Henrissat, B., Bairoch, A. Biochem. J. 1996, 316, 695—696.
- Naumoff, D.G. Proceedings of the Fifth International Conference on Bioinformatics of Genome Regulation and Structure. 2006, 1, 294—298.
- Наумов Д.Г. Биохимия. 2011, 76, 764–780.