Диоксид углерода
Диокси́д углеро́да или двуо́кись углеро́да (также оксид углерода (IV), углеки́слый газ, у́гольный ангидри́д, углекислота́[4], химическая формула — CO2) — химическое соединение, представляющее собой кислотный оксид углерода, состоящий из одной молекулы углерода и двух молекул кислорода.
| Диоксид углерода | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Оксид углерода(IV) | ||
| Традиционные названия |
Углекислый газ диоксид углерода углекислота двуокись углерода сухой лёд (в твёрдом состоянии) |
||
| Хим. формула | CO2 | ||
| Рац. формула | CO2 | ||
| Физические свойства | |||
| Состояние | Газообразное | ||
| Молярная масса | 44,01 г/моль | ||
| Плотность |
газ (0 °C): 1,9768 кг/м3 жидкость (0 °С, 35,5 ат): 925 кг/м3 тв. (−78,5 °C): 1560 кг/м3 г/см³ |
||
| Динамическая вязкость | 8,5⋅10−5 Па·с (10°C, 5,7 МПа) | ||
| Энергия ионизации | 13,77 ± 0,01 эВ | ||
| Скорость звука в веществе | 269 м/с | ||
| Термические свойства | |||
| Температура | |||
| • сублимации | −78,5 °C | ||
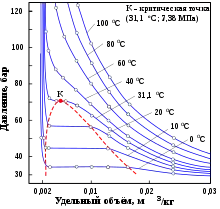
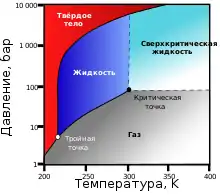
| Тройная точка | −56,6 °C, 0,52 МПа [1] | ||
| Критическая точка | 31 °C, 7,38 МПа | ||
| Критическая плотность | 467 кг/м3 см³/моль | ||
| Уд. теплоёмк. | 849 Дж/(кг·К) | ||
| Теплопроводность | 0,0166 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -394 кДж/моль | ||
| • плавления | 9,02 кДж/моль | ||
| • кипения | 16,7 кДж/моль | ||
| • сублимации | 26 кДж/моль | ||
| Удельная теплота испарения | 379,5 кДж/кг | ||
| Удельная теплота плавления | 205 кДж/кг | ||
| Давление пара | 56,5 ± 0,1 атм | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 1,48 кг/м3 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 124-38-9 | ||
| PubChem | 280 | ||
| Рег. номер EINECS | 204-696-9 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E290 | ||
| RTECS | FF6400000 | ||
| ChEBI | 16526 | ||
| Номер ООН | 1013 | ||
| ChemSpider | 274 | ||
| Безопасность | |||
| Предельная концентрация |
9 г/м3 (5000 ppm) долговременное воздействие, 54 г/м3 (30 000 ppm) кратковременное воздействие (<15 мин.) [2] |
||
| ЛД50 | LC50: 90 000мг/м3*5 мин. (человек, ингаляция)[3] | ||
| Токсичность | Нетоксичен. Опасен лишь в очень больших количествах (обладает удушающим действием). Негорюч. | ||
| Фразы безопасности (S) | S9, S23, S36 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
При нормальных условиях, диоксид углерода — это бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Плотность при нормальных условиях — 1,98 кг/м3 (в 1,5 раза тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное (возгонка). Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %[5]. Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего должен участвовать в процессе глобального потепления[6]. Изначально, до появления жизни, углекислый газ составлял основу атмосферы Земли и его уровень снижался от десятков процентов до долей одного в результате процесса фотосинтеза. Постоянный рост содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи. Деятельность человека, прежде всего сжигание ископаемого топлива, увеличила его долю в атмосфере Земли примерно с 280 ppm (частей на миллион) в начале индустриализации до 407,8 ppm в 2018 году[7][8]. Рост содержания углекислого газа выше, до определённой концентрации, приводит к появлению облаков из углекислоты, что ведёт к похолоданию[9]. Оба эти явления объясняют, почему температурные условия существования жизни на Земле относительно стабильны в течение миллиардов лет.
История
Двуокись углерода была одним из первых газов, получивших название. В XVII веке фламандский химик Йохан Баптиста ван Гельмонт заметил, что масса древесного угля уменьшалась, когда он сжигался, потому что масса оставшейся золы была меньше массы используемого древесного угля. Его интерпретация заключалась в том, что остальная часть древесного угля превратилась в невидимое вещество, которое он назвал газом или spiritus sylvestre («лесной дух»)[10].
Свойства углекислого газа более тщательно изучил шотландский врач Джозеф Блэк. В 1754 году он обнаружил, что при смешивании растворов карбоната кальция с кислотами выделяется газ, который он назвал неподвижным воздухом[11]. Он понял, что он тяжелее воздуха и не поддерживает процессы горения. Когда этот газ вводили в раствор гидроксида кальция, он мог образовывать осадок. С помощью этого явления он показал, что углекислый газ содержится в дыхании млекопитающих и выделяется в результате микробиологической ферментации. Его работа доказала, что газы могут участвовать в химических реакциях, и внесла свой вклад в дело теории флогистона[12].
Джозефу Пристли удалось создать первую газированную воду в 1772 году, переведя серную кислоту в известковый раствор и растворив полученный диоксид углерода в стакане с водой[13]. Однако Уильям Браунригг обнаружил связь между углекислым газом и угольной кислотой гораздо раньше. В 1823 году Гэмфри Дэви и Майкл Фарадей сжижили углекислый газ, увеличив давление[14]. Первое описание твердого углекислого газа принадлежит Адриену Тилорье, который открыл в 1834 году герметичный контейнер с жидким углекислым газом и обнаружил, что самопроизвольное испарение происходит при охлаждении, что приводит к твердому СО2[15].
Нахождение в природе
Углекислый газ содержится в атмосфере, гидросфере, литосфере и биосфере. Обмен углерода между ними происходит в основном за счёт двуокиси углерода. В 2015 году в атмосфере содержалось примерно около 830 гигатонн (830 миллиардов тонн) углерода в форме двуокиси углерода[16]. Гидросфера содержит около 38 000 гигатонн углерода в виде физически растворенного диоксида углерода, а также растворенных гидрокарбонатов и карбонатов. Литосфера содержит самую большую долю химически связанного диоксида углерода. Карбонатные породы, такие как кальцит и доломит, содержат около 60 000 000 гигатонн углерода[17]. Кроме того, большие количества углерода хранятся в районах вечной мерзлоты, таких как тундры арктических и полярных антарктических регионов, в бореальных хвойных лесах или высоких горах и на болотах[18][19][20].
Свойства
Физические
Диоксид углерода (IV) (углекислый газ) — бесцветный газ, при малых концентрациях в воздухе не имеет запаха, при больших концентрациях имеет характерный кисловатый запах газированной воды. Тяжелее воздуха приблизительно в 1,5 раза.
Молекула углекислого газа линейна, расстояние от центра центрального атома углерода до центров двух атомов кислорода 116,3 пм.
При температуре −78,3 °С кристаллизуется в виде белой снегообразной массы — «сухого льда». Сухой лёд при атмосферном давлении не плавится, а испаряется, не переходя в жидкое состояние, температура сублимации −78 °С. Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм) газ сгущается в бесцветную жидкость. В тлеющем электрическом разряде светится характерным бело-зелёным светом.
Негорюч, но в его атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щёлочноземельных — магния, кальция, бария.
Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (0,738 объёмов углекислого газа в одном объёме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует нестойкую угольную кислоту. Реагирует со щёлочами с образованием её солей — карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Оксид углерода(IV) останавливает горение, вытесняя кислород из зоны реакции. В нём горят только некоторые активные металлы[21]:
- .
Взаимодействие с оксидом активного металла:
- .
При растворении в воде образует равновесную смесь раствора диоксида углерода и угольной кислоты, причём равновесие сильно сдвинуто в сторону разложения кислоты:
- .
Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
- (качественная реакция на углекислый газ),
- .
Биологические
Организм человека выделяет приблизительно 1 кг углекислого газа в сутки[22].
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он[23].
Содержание углекислого газа в крови человека приблизительно таково:
Референтные значения или средние значения парциального давления углекислого газа в крови (pCO2) Единицы измерения Газ венозной крови Альвеолярный лёгочный газ Газ артериальной крови кПа 5,5[24]—6,8[24] 4,8 4,7[24]—6,0[24] мм рт. ст. 41—51 36 35[25]—45[25]
Углекислый газ транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Бо́льшая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната при помощи реакции .
- Около 5—10 % углекислого газа растворено в плазме крови.
- Около 5—10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин).
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза.
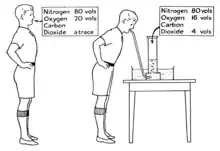
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя организм человека требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде.
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 50 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10—20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановятся, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению). Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение
- В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов[27] (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать , содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
- Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа[27]:
- .
Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который замедляет реакцию, и который удаляется значительным избытком кислоты с образованием кислого сульфата кальция.
Для приготовления сухих напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Также для получения углекислого газа применяется экзотермическая реакция горения углерода в кислороде[27]:
- .
Применение
 Автоцистерна для перевозки сжиженной двуокиси углерода
Автоцистерна для перевозки сжиженной двуокиси углерода

 Бытовой баллончик со сжиженным углекислым газом
Бытовой баллончик со сжиженным углекислым газом Пневматический пистолет, использующий баллончик со сжиженным углекислым газом
Пневматический пистолет, использующий баллончик со сжиженным углекислым газом
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
В криохирургии используется как одно из основных веществ для криоабляции новообразований.
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими.
При сооружении московского метро в XX веке жидкая углекислота использовалась для заморозки грунта.
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространённый метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений[28].
Углекислый газ используется для газирования лимонада, газированной воды и других напитков. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31 °С. В стандартный 40-литровый баллон заливают около 20 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см2). Если температура будет выше +31 °С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см2), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа, — таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при их посадке внатяжку) и так далее. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации СО2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций СО2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе[29].
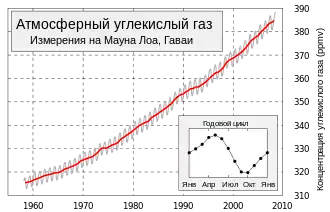
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) даёт малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон[30].
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Физиологическое действие
Углекислый газ [31] нетоксичен, однако при вдыхании его повышенных концентраций в воздухе по воздействию на воздуходышащие живые организмы его относят к удушающим газам.
В соответствии с ГОСТом 12.1.007-76 диоксид углерода относится к вредным веществам IV класса опасности[32][33].
Растворенный в крови углекислый газ активирует дыхательный центр мозга в физиологических и несколько повышенных концентрациях. Незначительные повышения концентрации, вплоть до 0,2−0,4 % (2000−4000 ppm), в помещениях приводят к развитию у людей сонливости и слабости. В значительно более высоких концентрациях он приводит к снижению или устранению рефлекторного респираторного раздражителя, сначала к угнетению дыхания и, наконец, к остановке дыхания[34]. От 5 % углекислого газа во вдыхаемом воздухе возникают головные боли и головокружение, при более высоких концентрациях учащенное сердцебиение (тахикардия), повышение артериального давления, одышка и потеря сознания, так называемая углекислотная анестезия. Концентрация углекислого газа свыше 8 % приводит к отравлению с последующим смертельным исходом в течение 30-60 минут[35][36]. Накопление углекислого газа в крови называется гиперкапнией.
Для помещений нормальным является уровень CO2 около 600 ppm (частей на миллион). Повышенные концентрации углекислого газа снижают когнитивные способности людей. Уже при 1200 ppm расширяются кровеносные сосуды в мозге, снижается активность нейронов и уменьшается объём коммуникации между регионами мозга[37]. В школьных классах типичной является концентрация 2000−2500, а общий разброс значений — от 1000 до 6000, это вызывает обеспокоенность у исследователей[38], поскольку выявлено снижение результатов учеников, выполняющих тестовые задания в душных помещениях[39].
| Влияние на взрослых здоровых людей | Концентрация углекислого газа, ppm |
|---|---|
| Нормальный уровень на открытом воздухе | 350—450 |
| Приемлемые уровни | <600 |
| Жалобы на несвежий воздух | >1200 |
| Общая вялость | 1000—2500 |
| Максимально допустимая концентрация в течение 8 часового рабочего дня | 5000 |
| Лёгкое отравление, учащается пульс и частота дыхания, тошнота и рвота | 30 000 |
| Добавляется головная боль и лёгкое нарушение сознания | 50 000 |
| Потеря сознания, в дальнейшем — отравление с последующим смертельным исходом | 100 000 |
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья. После удаления пострадавшего из атмосферы с высокой концентрацией углекислого газа быстро наступает полное восстановление здоровья и самочувствия[40].
Рекомендуемая ПДК в воздухе рабочей зоны для диоксида углерода составляет 9000 мг/м3 [41].
См. также
Примечания
- Carbon Dioxide - Thermophysical Properties
- Carbon dioxide: Immediately Dangerous to Life or Health Concentrations (IDLH)
- name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 12.1.007-76. Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования
- Раков Э. Г., Углерода диоксид, 2016.
- Trends in Atmospheric Carbon Dioxide (англ.). National Oceanic and Atmospheric Administration. Дата обращения: 24 сентября 2013.
- Jochem Marotzke; Martin Stratmann. Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft (нем.). — München: C. H. Beck, 2015. — S. 9—22. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- Eggleton, R. A. A short introduction to climate change (англ.). — Cambridge: CUP, 2012. — 240 p. — ISBN 978-1-139-52435-3, 1-139-52435-6, 978-1-139-62739-9, 1-139-62739-2, 978-1-283-94302-4, 1-283-94302-6, 978-1-139-62794-8, 1-139-62794-5, 1-139-62705-8, 978-1-139-62705-4.
- Treibhausgas-Konzentration erreicht neuen Rekordwert (нем.). klimareporter°. Дата обращения: 22 сентября 2020.
- Chen Zhou, Mark D. Zelinka & Stephen A. Klein. Impact of decadal cloud variations on the Earth’s energy budget (англ.). Nature Geoscience. Дата обращения: 4 декабря 2019.
- Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 35. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 50. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- Brock, William H. 1936-. Viewegs Geschichte der Chemie. — Braunschweig. — С. 72. — XII, 472 S с. — ISBN 978-3-528-06645-1, 3-528-06645-8, 3-540-67033-5, 978-3-540-67033-9.
- Joseph Priestley. XIX. Observations on different kinds of air. // Philosophical Transactions of the Royal Society of London. — 1772-01-01. — Т. 62. — С. 147–264. — doi:10.1098/rstl.1772.0021.
- XVIII. On the application of liquids formed by the condensation of gases as mechanical agents (EN) // Philosophical Transactions of the Royal Society of London. — 1823-12-31. — Т. 113. — С. 199–205. — ISSN 2053-9223 0261-0523, 2053-9223. — doi:10.1098/rstl.1823.0020.
- Joost Mertens. Du côté d'un chimiste nommé Thilorier // L'Année balzacienne. — 2003. — Т. 4, вып. 1. — С. 251. — ISSN 0084-6473. — doi:10.3917/balz.004.0251.
- Die Zukunft des Klimas : neue Erkenntnisse, neue Herausforderungen : ein Report der Max-Planck-Gesellschaft. — München: C.H. Beck, 2015. — С. 125. — 123-136 с. — ISBN 978-3-406-66968-2, 3-406-66968-9.
- Kappas, M. (Martin). Klimatologie : Klimaforschung im 21. Jahrhundert - Herausforderung für Natur- und Sozialwissenschaften. — Heidelberg: Spektrum Akademischer Verlag, 2009. — С. 159. — 1 online resource с. — ISBN 978-3-8274-2242-2, 3-8274-2242-6.
- Permafrost - Auf dünnem Eis (нем.). Deutschlandfunk. Дата обращения: 22 сентября 2020.
- International Permafrost Association Country Reports (англ.). International Permafrost Association. Дата обращения: 22 сентября 2020.
- NABU - Moore und Klimawandel (нем.). NABU - Naturschutzbund Deutschland e.V.. Дата обращения: 22 сентября 2020.
- Егоров А. С. Репетитор по химии — Ростов-на-Дону: «Феникс», 2009.
- 7. How much carbon dioxide do humans contribute through breathing?. Frequent Questions - Emissions (англ.). US EPA. Дата обращения: 4 декабря 2019. Архивировано 2 февраля 2011 года.
- Charles Henrickson. Chemistry (англ.). — Cliffs Notes, 2005. — ISBN 0-7645-7419-1.
- Пересчитано из значений в мм. рт. ст. с использованием коэффициента пересчёта 0,133322 кПа/мм. рт. ст.
- Таблица референсных значений. Юго-Западный медицинский центр при Университете Далласа.
- Glinka, Nikolaj Leonidovič (1882-1965). Obŝaâ himiâ. — Izd. 27-e ster. — Leningrad: "Himiâ", 1988. — 702, [2] s. с. — ISBN 5724500035, 9785724500036.
- Большая Энциклопедия Нефти и Газа.
- ГОСТ 31371.6-2008 (ИСО 6974-6:2002). Газ природный. Определение состава методом газовой хроматографии с оценкой неопределённости. Часть 6. Определение водорода, гелия, кислорода, азота, диоксида углерода и углеводородов C1 — C8 с использованием трёх капиллярных колонок. Docs.cntd.ru. — М.: Стандартинформ, 2009.. Дата обращения: 4 декабря 2019.
- Бялко А. В. Растения убыстряют рост // Природа. — 1996. — № 10. (по Keeling C.D., Whorf Т.P., Wahlen M., van der Plicht J. // Nature. 1995. V. 375, № 6533. P.666-670)
- Carbon dioxide poisoning: a literature review of an often forgotten cause of intoxication in the emergency department
- name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
- name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 8050-85 Двуокись углерода
- Rauchvergiftungen/Vergiftungen durch Gase (TK). web.archive.org (4 июня 2010). Дата обращения: 22 сентября 2020.
- Deutsches Rotes Kreuz. Vergiftungen und Hilfe bei Erbrechen - Erste Hilfe (нем.). DRK e.V. (17 июня 2020). Дата обращения: 22 сентября 2020.
- Carbon Dioxide - Life and Death. web.archive.org (22 мая 2013). Дата обращения: 22 сентября 2020.
- Greenwood, Veronique. Is Conference Room Air Making You Dumber? : [англ.] // The New York Times : газ. — 2019. — 6 May.
- Ventilation rates and carbon dioxide concentrations in schools. — In: Ventilation with Outdoor Air : [англ.] // Berkeley Lab : [сайт]. — 2019.
- Сорокин, Андрей. «Глобальное потепление отупляет. От этого уже страдают школьники и офисные работники» // Republic : [сайт]. — 2020. — 7 января.
- (англ.) Glatte Jr H. A., Motsay G. J., Welch B. E. Carbon Dioxide Tolerance Studies (англ.) // Brooks AFB, TX School of Aerospace Medicine Technical Report. — 1967. — Vol. SAM—TR—67—77. Архивировано 9 мая 2008 года.
- name=https://docs.cntd.ru_ПДК вредных веществ в воздухе рабочих помещений
Литература
- Вукалович М. П., Алтунин В. В. Теплофизические свойства двуокиси углерода. — М.: Атомиздат, 1965. — 456 с.
- Гродник М. Г., Величанский А. Я. Проектирование и эксплуатация углекислотных установок. — М.: Пищевая промышленность, 1966. — 275 с.
- Раков Э. Г. Углерода диоксид // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2016. — Т. 32. — С. 662—663.
- Тезиков А. Д. Производство и применение сухого льда. — М.: Госторгиздат, 1960. — 128 с.
- Талянкер Ю. Е. Особенности хранения баллонов со сжиженным газом // Сварочное производство. — 1972. — № 11.
Ссылки
- International Chemical Safety Card 0021 (англ.)
- CID 280 — PubChem (англ.)
- CO2 Диоксид углерода, свойства, применение (англ.)
- Фазовая диаграмма (давление-температура) для диоксида углерода
- Диоксид углерода в 3D
- Dry Ice information (англ.)
- Phase Diagram of Carbon Dioxide (англ.)
- Experiment 071 — Triple Point Phase Transition for Carbon Dioxide
- CO2 как природный рефрежерант — FAQs (англ.)
- Великобритания разрабатывает метод сохранения двуокиси углерода
- Онлайн калькулятор свойств CO2 (англ.)