Соляная кислота
Соля́ная кислота́ (также хлороводоро́дная или хлористоводоро́дная кислота, хим. формула — HCl) — сильная химическая неорганическая кислота. Раствор хлороводорода в воде.
| Соляная кислота | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Хлороводородная кислота |
| Хим. формула | H2O:HCl |
| Рац. формула | HCl |
| Физические свойства | |
| Состояние | Жидкость |
| Молярная масса | 36.46 г/моль |
| Плотность | 1.19 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -30 °C |
| • кипения | 48 °C |
| Энтальпия | |
| • образования | -605.22 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты | -10 |
| Растворимость | |
| • в воде | Растворима |
| Классификация | |
| Рег. номер CAS | 7647-01-0 |
| PubChem | 21885828 |
| Рег. номер EINECS | 933-977-5 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E507 |
| RTECS | MW4025000 |
| Безопасность | |
| Предельная концентрация | 5 мг/м3[1] |
| Токсичность | 3 класс опасности[2] |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
При стандартных условиях — это сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящаяся» на воздухе (техническая соляная кислота — желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Соли соляной кислоты называются хлоридами.
История
Впервые хлороводород получил алхимик Василий Валентин, нагрев гептагидрат сульфата железа с поваренной солью и назвав полученное вещество «духом соли» (лат. spiritus salis). Иоганн Глаубер в XVII в. получил соляную кислоту из поваренной соли и серной кислоты. В 1790 году британский химик Гемфри Дэви получил хлороводород из водорода и хлора, таким образом установив его состав. Возникновение промышленного производства соляной кислоты связано с технологией получения карбоната натрия: на первой стадии этого процесса поваренную соль вводили в реакцию с серной кислотой, в результате чего выделялся хлороводород. В 1863 году в Англии был принят закон «Alkali Act», согласно которому запрещалось выбрасывать этот хлороводород в воздух, а необходимо было пропускать его в воду. Это привело к развитию промышленного производства соляной кислоты. Дальнейшее развитие произошло благодаря промышленным методам получения гидроксида натрия и хлора путём электролиза растворов хлорида натрия[3].
Физические свойства
Физические свойства соляной кислоты сильно зависят от концентрации растворённого хлороводорода:
| Конц. (вес), мас. % | Конц. (г/л), кг HCl/м3 |
Плотность, кг/л |
Молярность, M или моль/л |
Водородный показатель (pH) |
Вязкость, мПа·с |
Удельная теплоемкость, кДж/(кг·К) |
Давление пара, кПа |
Т. кип., °C |
Т. пл., °C |
| 10 % | 104,80 | 1,048 | 2,87 | −0,4578 | 1,16 | 3,47 | 1,95 | 103 | −18 |
| 20 % | 219,60 | 1,098 | 6,02 | −0,7796 | 1,37 | 2,99 | 1,40 | 108 | −59 |
| 30 % | 344,70 | 1,149 | 9,45 | −0,9754 | 1,70 | 2,60 | 2,13 | 90 | −52 |
| 32 % | 370,88 | 1,159 | 10,17 | −1,0073 | 1,80 | 2,55 | 3,73 | 84 | −43 |
| 34 % | 397,46 | 1,169 | 10,90 | −1,0374 | 1,90 | 2,50 | 7,24 | 71 | −36 |
| 36 % | 424,44 | 1,179 | 11,64 | −1,06595 | 1,99 | 2,46 | 14,50 | 61 | −30 |
| 38 % | 451,82 | 1,189 | 12,39 | −1,0931 | 2,10 | 2,43 | 28,30 | 48 | −26 |
При 20 °C, 1 атм (101,325 кПа)
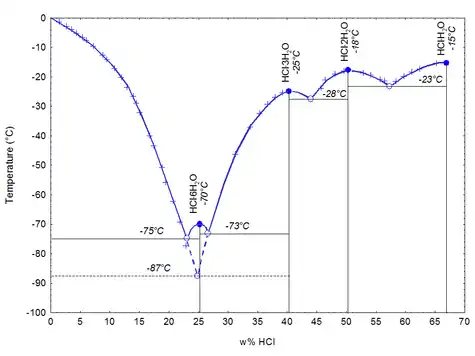
При низкой температуре хлороводород с водой даёт кристаллогидраты составов (т. пл. −15,4 °С), (т. пл. −18 °С), (т. пл. –25 °С), (т. пл. −70 °С). При атмосферном давлении (101,325 кПа) хлороводород с водой образуют азеотропную смесь с т. кип. 108,6 °С и содержанием 20,4 мас. %[4].
Химические свойства
- Взаимодействие с металлами, стоящими в ряду электрохимических потенциалов до водорода, с образованием соли и выделением газообразного водорода:
- ,
- ,
- .
- ,
- ,
- .
- Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации):
- ,
- ,
- .
- Взаимодействие с солями металлов, образованных более слабыми кислотами, например, с угольной кислотой:
- .
- Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора:
- .

- Взаимодействие с аммиаком с образованием густого белого дыма, состоящего из мельчайших кристаллов хлорида аммония[5]:
- .
- Качественная реакция на соляную кислоту и её соли — взаимодействие кислоты с нитратом серебра, при котором образуется белый творожистый осадок хлорида серебра, нерастворимый в азотной кислоте[6]:
- .
Получение
Соляную кислоту получают растворением газообразного хлороводорода (HCl) в воде. Хлороводород получают сжиганием водорода в хлоре, полученная таким способом кислота называется синтетической. Также соляную кислоту получают из абгазов — побочных газов, образующихся при различных процессах, например, при хлорировании углеводородов. Хлороводород, содержащийся в этих газах, называется абгазным, а полученная таким образом кислота — абгазной. В последние десятилетия доля абгазной соляной кислоты в объёме производства постепенно увеличивается, вытесняя кислоту, полученную сжиганием водорода в хлоре. Но полученная методом сжигания водорода в хлоре соляная кислота содержит меньше примесей и применяется при необходимости высокой чистоты.
В лабораторных условиях используется разработанный алхимиками способ, заключающийся в действии концентрированной серной кислоты на поваренную соль:
- .
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
- .
Получение путём гидролиза хлоридов магния, алюминия (производится нагревание гидратированной соли):
- ,
- .
Эти реакции могут идти не до конца с образованием основных хлоридов (оксихлоридов) переменного состава, например:
В промышленности хлороводород получают реакцией горения водорода в хлоре:
Хлороводород хорошо растворим в воде. Так, при 0 °C 1 объём воды может поглотить 507 объёмов , что соответствует концентрации кислоты 45 %. Однако при комнатной температуре растворимость ниже, поэтому на практике обычно используют 36-процентную соляную кислоту.
Применение

Промышленность
- Применяется в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при пайке и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с поверхностно-активными веществами используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
- В пищевой промышленности зарегистрирована как регулятор кислотности (пищевая добавка E507). Применяется для изготовления зельтерской (содовой) воды.
Медицина
- Естественная составная часть желудочного сока человека. В концентрации 0,3—0,5 %, обычно в смеси с ферментом пепсином, назначается внутрь при недостаточной кислотности.
Особенности обращения

Соляная кислота относится к веществам III класса опасности[2] (ГОСТ 12.1.007-76)[8]. Рекомендуемая ПДК в рабочей зоне - 5 мг/м3[1].
Высококонцентрированная соляная кислота представляет собой едкое вещество. При попадании на кожу вызывает сильные химические ожоги. Особенно опасным считается попадание в глаза (в значительном количестве). Для нейтрализации ожогов применяют раствор слабого основания, или соли слабой кислоты, обычно пищевой соды.
При открывании сосудов с концентрированной соляной кислотой пары хлороводорода, притягивая влагу воздуха, образуют туман, раздражающий глаза и дыхательные пути человека.
Реагируя с сильными окислителями (хлорной известью, диоксидом марганца, перманганатом калия), образует токсичный газообразный хлор.
В РФ оборот соляной кислоты концентрации 15 % и более — ограничен[9].
Литература
- Austin S., Glowacki A. Hydrochloric Acid (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a13_283.
Примечания
- name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 12.1.005-76. Воздух рабочей зоны. Санитарно-гигиенические требования
- name=docs.cntd.ru_ГОСТ 12.1.007-76. Система стандартов безопасности труда (ССБТ). Вредные вещества. Классификация и общие требования безопасности (с Изменениями N 1, 2)
- Ullmann, 2000, p. 191.
- Ullmann, 2000, p. 194.
- Дым без огня: взаимодействие аммиака с хлороводородом — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 82. Соляная кислота // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 195—196. — 240 с. — 1 630 000 экз.
- page-book.ru — Реми Г. Курс неорганической химии (Том 1): Стр.301 (недоступная ссылка). Дата обращения: 23 августа 2012. Архивировано 11 мая 2013 года.
- name=https://www.safework.ru_Хлористый водород
- Постановление Правительства Российской Федерации от 3 июня 2010 года № 398 Архивировано 30 июня 2016 года.
