Хлорид серебра(I)
Хлори́д серебра́(I) (хло́ристое серебро́, химическая формула — AgCl) — неорганическая бинарная серебряная соль соляной кислоты.
| Хлорид серебра(I) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Хлорид серебра(I) | ||
| Традиционные названия | Хлорид серебра | ||
| Хим. формула | AgCl | ||
| Рац. формула | AgCl | ||
| Физические свойства | |||
| Состояние | Твёрдое | ||
| Молярная масса | 143,32 г/моль | ||
| Плотность | 5,56[1] | ||
| Твёрдость | 2,5[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 455[1] | ||
| • кипения | 1554[3] °C | ||
| Мол. теплоёмк. | 50,79[4] Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −127[3] кДж/моль | ||
| Удельная теплота испарения | 1,28⋅106[4] | ||
| Удельная теплота плавления | 9,2⋅104[4] | ||
| Давление пара | 1 Па[5], 10 Па[5], 100 Па[5], 1 кПа[5], 10 кПа[5] и 100 кПа[5] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 1,91⋅10−5 г/100 мл | ||
| • в этаноле | 1,5·10−5 г/л | ||
| • в метаноле | 6·10−5 г/л | ||
| • в ацетоне | 1,3·10−5 г/л | ||
| • в пиридине[6] | 19,5 г/л | ||
| Оптические свойства | |||
| Показатель преломления | 2,071[2] | ||
| Структура | |||
| Дипольный момент | 6,08 ± 0,06 Д[7] | ||
| Классификация | |||
| Рег. номер CAS | 7783-90-6 | ||
| PubChem | 24561 | ||
| Рег. номер EINECS | 232-033-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | VW3563000 | ||
| ChEBI | 30341 | ||
| ChemSpider | 22967 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
В нормальных условиях, хлорид серебра — это белый порошок или бесцветные кристаллы.
Встречается в природе в виде минерала хлораргирита.
Молекулярная и кристаллическая структура
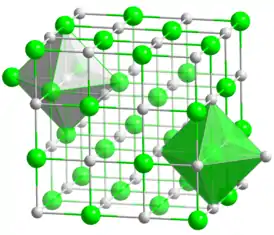
Хлорид серебра имеет следующий элементный состав: Серебро (Ag) — 75,26 %, хлор (Cl) — 24,74 %. Атом серебра в молекуле находится в состоянии sp3d2-гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм[8].
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6[9].
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера[9].
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро»[10].
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10−10. С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10−8[11]. Нерастворим в минеральных кислотах, этиловом и метиловом спиртах, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке[4][12]. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
Термодинамические константы:
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль[13];
- Стандартная энтропия, S°298: 96 Дж/(моль·K)[13];
- Стандартная энергия Гиббса, ΔG°298: −110 кДж/моль[13].
- Стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K)[4];
- Энтальпия плавления, ΔHпл: 13,2 кДж/моль [4];
- Энтальпия кипения, ΔHкип: 184 кДж/моль [4].
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением[14]:
Химические свойства
- Разлагается при комнатной температуре под действием света:
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра[15]:
- Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов[16]:[стр. 233]: :
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении[17]:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах[18]:
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl−;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии[19];
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды[16]:[с. 167]:
- Реагент для получения сереброорганических соединений:
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
См. также
Примечания
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 73. — ISBN 5-7107-8085-5.
- Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 8—9. — ISBN 0-07-049439-8.
- Турова Н. Я. Неорганическая химия в таблицах. — М.: Высший химический колледж РАН, 1997. — С. 88.
- [www.xumuk.ru/spravochnik/863.html Серебра хлорид]. Справочник по веществам. XuMuK.ru. Дата обращения: 1 марта 2010.
- CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 6—122. — ISBN 978-1-4987-5428-6
- Ю. Ю. Лурье. Справочник по аналитической химии. — М.: Химия, 1979. — С. 88. — 480 с. — 80 000 экз.
- CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 97 — Boca Raton: 2016. — P. 9—65. — ISBN 978-1-4987-5428-6
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть III. Глава 5. Энергия и длина связи для двухатомных частиц // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 378. — ISBN 5-7107-8085-5.
- Серебра галогениды // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М.: «Советская энциклопедия», 1995. — Т. 4. — С. 635—636. — ISBN 5-85270-092-4.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Учебное пособие для вузов. — М.: «Химия», 1981. — С. 591.
- Произведения растворимости. Новый справочник химика. Химическое равновесие. Свойства растворов. ChemAnalytica.Com (1 апреля 2009). Дата обращения: 4 марта 2010.
- Таблица неорганических и координационных соединений. Новый справочник химика. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalytica.Com (31 марта 2009). Дата обращения: 4 марта 2010.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть IV. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М.: «Дрофа», 2006. — С. 440. — ISBN 5-7107-8085-5.
- Silver Chloride. Phase change data (англ.). NIST Chemistry WebBook. National Institute of Standads and Technology. Дата обращения: 17 марта 2010. Архивировано 20 апреля 2012 года.
- Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ / 3-е изд., под редакцией Р.А. Лидина. — М.: «Химия», 2000. — С. 296. — ISBN 5-7245-1163-0.
- Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3: Химия переходных элементов. Кн. 2. — 368 с. — ISBN 5-7695-2533-9.
- Пятницкий И.В., Сухан В.В. Аналитическая химия серебра. — М.: «Наука», 1975. — С. 23.
- Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. Т.2: Химия непереходных элементов / Под ред. акад. Ю.Н.Третьякова. — М.: Издательский центр «Академия», 2004. — Т. 2. — С. 178. — ISBN 5-7695-1436-1.
- Silver Chloride (AgCl) (англ.). Products. Crystran Ltd. Дата обращения: 18 марта 2010. Архивировано 20 апреля 2012 года.



