Оксид мышьяка(III)
Оксид мышьяка(III) — неорганическое соединение с химической формулой As2O3, являющееся ценным химическим сырьём для получения других производных мышьяка, в том числе мышьяксодержащих органических соединений. Валовой объём производства в мире — 50 000 тонн в год[1]. Однако безопасность его применения во многих областях подвергается сомнению из-за высокой токсичности.
| Оксид мышьяка(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Arsenic trioxide |
| Традиционные названия | белый мышьяк |
| Хим. формула | As2O3 |
| Рац. формула | As2O3 |
| Физические свойства | |
| Молярная масса | 197.841 г/моль |
| Плотность | 3.74 г/см³ |
| Классификация | |
| Рег. номер CAS | 1327-53-3 |
| PubChem | 261004 |
| Рег. номер EINECS | 215-481-4 |
| SMILES | |
| InChI | |
| RTECS | CG3325000 |
| ChEBI | 30621 |
| ChemSpider | 229103 |
| Безопасность | |
| Предельная концентрация | 0.01 мг/м³ |
| ЛД50 | 14,6 мг/кг (крысы, орально) |
| Токсичность | чрезвычайно токсичен |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение и свойства
Оксид мышьяка(III) может быть получен многими способами, включая окисление (горение) мышьяка и его производных на воздухе. Показательна реакция разложения аурипигмента, сульфида мышьяка:
Большая часть, однако, является побочным продуктом других производств — золотодобычи и получения меди, где он выделяется при прокаливании на воздухе, что приводило к многочисленным массовым отравлениям[2]. В настоящее время интенсивная добыча мышьяковых руд ведётся только в Китае[1].
Оксид мышьяка(III) является амфотерным оксидом, его раствор обладает слабокислой реакцией. В щелочных растворах образует арсениты, в концентрированной соляной кислоте даёт хлорид мышьяка(III).
Только некоторые окислители — озон, пероксид водорода, азотная кислота — способны превратить его в оксид мышьяка(V) As2O5 или — при понижении концентрации — арсин (AsH3) в зависимости от условий реакции.
Структура
В жидком и газообразном (до 800 °C) состояниях имеет формулу As4O6 (в форме димера) и изоструктурен P4O6). При нагреве свыше 800 °C As4O6 распадается на молекулы As2O3, схожий по строению с N2O3. В твёрдом состоянии сосуществуют три полиморфных формы: кубический молекулярный As4O6 и две полимерные формы. Полимеры, образующие при остывании монокристаллы, напоминают пирамидальную структуру AsO3 с общими атомами кислорода.[3]
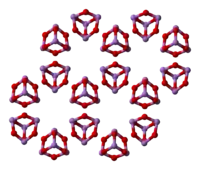 |  | 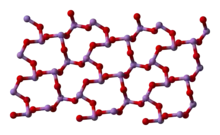 |
(cubic) | (monoclinic) | (monoclinic) |
Использование
Оксид мышьяка(III) используется для изготовления цветного стекла, также применяется в лесохимии и электротехнике полупроводников[1], получения чистого мышьяка и его соединений, таких как какодилат натрия и арсенид натрия.
В соединении с ацетатом меди(II)[1] триоксид образует красящее вещество — парижскую зелень, ныне из-за чрезвычайной токсичности неиспользуемую.
Применение в медицине
Используется с древнейших времён в китайской медицине[4], а также (с XIX века) в гомеопатии. В конвенциональной медицине триоксид мышьяка используется для лечения злокачественных опухолей, таких как лейкемия, однако ввиду высоких рисков его применения предпочтение отдаётся другим препаратам[5][6][7].
Также триоксид мышьяка успешно лечит аутоиммунные заболевания[8], взаимодействует с ферментом тиоредоксиновая редуктаза[9].
Обнаружение в природе
As2O3 содержится в арсенолите и клаудетите.
Токсикология
Оксид мышьяка (III) ядовит. Токсичность триоксида стала легендарной и широко описана в литературе[10][11][11][12].
В Австрии жили «мышьякоеды», получавшие дозы во много раз больше смертельной без особого вреда для здоровья. Считается, что мышьяк повышает работоспособность, особенно при работе на больших высотах[13][14][15].
ПДК для неорганических соединений мышьяка, включая As2O3, составляет 0.01 мг/м³.
Полулетальная доза — 19,1 мг/кг.
Примечания
- Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf «Arsenic and Arsenic Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim. (англ.)
- Giant Mine - Northwest Territories Region - Indian and Northern Affairs Canada (недоступная ссылка). Дата обращения: 28 августа 2007. Архивировано 2 апреля 2012 года. (англ.)
- Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Marcel Gielen, Edward R. T. Tiekink. Metallotherapeutic Drugs and Metal-Based Diagnostic Agents (англ.). — Wiley, 2005. — P. 298.
- Steven L. Soignet et al. United States Multicenter Study of Arsenic Trioxide in Relapsed Acute Promyelocytic Leukemia (англ.) // Journal of Clinical Oncology : journal. — 2001. — Vol. 19, no. 18. — P. 3852—3860.
- Antman, K. H. Introduction: The history of arsenic trioxide in cancer therapy (англ.) // Oncologist : journal. — 2001. — Vol. 6(Suppl. 2), no. 1—2. — P. 2006.
- Jun Zhu, Zhu Chen,Valérie Lallemand-Breitenbach, Hugues de Thé "How Acute Promyelocytic Leukaemia Revived Arsenic, " Nature Reviews Cancer 2002, volume 2, 1-9.
- Bobé Pierre, Bonardelle Danielle, Benihoud Karim, Opolon Paule, Chelbi-Alix Mounira. Arsenic trioxide: A promising novel therapeutic agent for lymphoproliferative and autoimmune syndromes in MRL/lpr mice (англ.) // Blood : journal. — American Society of Hematology, 2006. — Vol. 108, no. 13. — P. 3967—3975..
- Lu J., Chew E. H., Holmgren A. Targeting thioredoxin reductase is a basis for cancer therapy by arsenic trioxide (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — Vol. 104, no. 30. — P. 12288—12293. — doi:10.1073/pnas.0701549104. — PMID 17640917.
- Stanton v Benzler 9716830. U.S. 9th Circuit Court of Appeals (17 июня 1998). — «(...) convicted by a jury of first degree murder for poisoning her ex-husband. Her ex-husband's body was found with traces of arsenic trioxide in it.». Дата обращения: 9 июня 2008. Архивировано 2 апреля 2012 года.
- Emsley, John. Arsenic // The Elements of Murder: A History of Poison (англ.). — Oxford University Press, 2006. — P. 93—197. — ISBN 9780192806000.
- Madame Bovary by Flaubert
- Arsenic Eaters — New York Times July 26, 1885
- Richard M. Allesch. Arsenik. Seine Geschichte in Österreich. 54. Band. Klagenfurt: Kleinmayr 1959.
- G. Przygoda, J. Feldmann, W. R. Cullen. The arsenic eaters of Styria: a different picture of people who were chronically exposed to arsenic (англ.) // Applied Organometallic Chemistry : journal. — 2001. — Vol. 15, no. 6. — P. 457—462. — doi:10.1002/aoc.126.
Ссылки
- На английском языке
- Solubility of As2O3 in water as function of temperature
- Case Studies in Environmental Medicine: Arsenic Toxicity
- IARC Monograph — Arsenic and Arsenic Compounds
- International Chemical Safety Card 0378
- NIOSH Pocket Guide to Chemical Hazards
- NTP Report on Carcinogens — Inorganic Arsenic Compounds
- Use of Arsenic Trioxide in Multiple Myeloma Treatment
- The use of Arsenic trioxide in medicine.
- Institute of Chemistry Austria, speciallised on arsenic and various arsenic compounds
