Оксид кюрия(IV)
Окси́д кю́рия(IV) (диокси́д кю́рия, двуо́кись кю́рия) — бинарное неорганическое соединение кюрия и кислорода с формулой CmO2, чёрные кристаллы, нерастворимые в воде[3]. Молекулярная масса 279,069 а. е. м. (для 247Cm, самого долгоживущего изотопа кюрия; для других изотопов молекулярная масса может отличаться).
| Оксид кюрия(IV) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Оксид кюрия(IV) |
| Традиционные названия | Двуокись кюрия |
| Хим. формула | CmO2 |
| Физические свойства | |
| Состояние | чёрные кристаллы |
| Молярная масса | 279,069 г/моль |
| Плотность | 12 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 380 °C[1] |
| Энтальпия | |
| • образования | −912(7)[2] кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворим |
| Классификация | |
| Рег. номер CAS | 12016-67-0 |
| Рег. номер EINECS | 234-612-6 |
| Безопасность | |
| Токсичность | радиотоксичен |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
- Разложение при прокаливании гидроксида или оксалата кюрия(IV) с медленным охлаждением на воздухе при температуре ниже 350 °C[3]:
- Может быть получен непосредственно окислением кюрия кислородом при нагревании металла на воздухе:
При повышенной температуре поверхность металлического кюрия на воздухе покрыта окисной плёнкой, состоящей главным образом из оксида кюрия(IV)[3].
- Окисление оксида кюрия(III) при нагреве и медленном (несколько дней) охлаждении в кислороде[3]:
Физические свойства
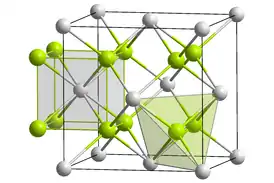
Оксид кюрия(IV) образует чёрные кристаллы кубической сингонии, пространственная группа F m3m, параметры ячейки a = 0,5357(1) нм, Z = 4, структура типа флюорита. Кристаллографическая плотность около 12,0 г/см3. Вследствие радиоактивного распада кюрия происходит постепенное «распухание» решётки[3].
Не растворяется в воде и органических растворителях.
Химические свойства
Реагирует с минеральными кислотами с образованием растворов солей кюрия(III). Разлагается при температурах выше 380 °C до CmO1,95; выше 450 °C происходит быстрая декомпозиция до Cm2O3 через ряд промежуточных оксидов (CmO1,81 со структурой типа флюорита и Cm7O12 с ромбоэдрической решёткой)[3].
Применение
- Изготовление изотопных источников тока.
- Мишени для получения транскюриевых элементов.
Токсичность
Как и все соединения кюрия, проявляет сильную радиотоксичность.
Примечания
- Mosley W. C. Phases and Transformations in the Curium-Oxygen System. J. Inorg. Nucl. Chem., 1972, 34 (2), P. 539–555 (doi:10.1016/0022-1902(72)80434-2).
- Konings R. J. M. Thermochemical and Thermophysical Properties of Curium and its Oxides. J. Nucl. Mater., 2001, 298 (3), P. 255–268 (doi:10.1016/S0022-3115(01)00652-3).
- Lumetta G. J., Thompson M. C., Penneman R. A., Eller P. G. Curium Архивная копия от 17 июля 2010 на Wayback Machine, in: Lester R. Morss, Norman M. Edelstein, Jean Fuger (Eds.): The Chemistry of the Actinide and Transactinide Elements, Springer, Dordrecht 2006; ISBN 1-4020-3555-1, P. 1397—1443 (doi:10.1007/1-4020-3598-5_9).
Литература
- Мясоедов Б. Ф. Кюрий // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 560. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — С. 294. — 792 с.

