Хлорид кюрия(III)
Хлорид кюрия(III) (трихлорид кюрия, кюрий хлористый(III)) — бинарное неорганическое соединение кюрия и соляной кислоты. Представляет собой бесцветные/белые кристаллы, малорастворимые в воде.
| Хлорид кюрия(III) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Хлорид кюрия(III) |
| Традиционные названия | Хлористый кюрий(III) |
| Хим. формула | CmCl3 |
| Физические свойства | |
| Состояние | бесцветные/белые кристаллы |
| Молярная масса | 353,43 г/моль |
| Плотность | 5,81 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 695 °C |
| Энтальпия | |
| • образования | -974±4 кДж/моль |
| Структура | |
| Кристаллическая структура | гексагональная |
| Классификация | |
| Рег. номер CAS | 13537-20-7 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
- Взаимодействие газообразного хлороводорода с диоксидом кюрия, оксидом кюрия(III) или оксихлоридом кюрия(III) при температуре 400—600 °C[1]:
- Растворение металлического кюрия в разбавленной соляной кислоте[2]:
- Данный способ имеет ряд недостатков, связанных с протекающими процессами гидролиза и гидратации полученного соединения в водном растворе. Таким образом, получить чистый продукт с помощью этой реакцией проблематично.
Физические свойства
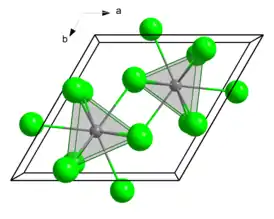
Хлорид кюрия(III) образует бесцветные/белые кристаллы гексагональной сингонии. Параметры ячейки a = 0,7374 нм, c = 0,4185 нм[3]. Пространственная группа [4]. Изоструктурен хлориду урана(III)[1]. Кюрий в трихлориде окружён девятью хлорид-ионами, которые образуют трёхвершинную тригональную призму[1].
Водой гидролизуется и гидратируется. Гидратированный хлорид кюрия(III) имеет светло-зелёный цвет[1].
Химические свойства
- При нагревании с бромидом аммония или иодидом аммония при температуре 400—450 °C в атмосфере водорода образуются соответственно бромид кюрия(III) и иодид кюрия(III)[1]:
- Парами воды при температуре 500—600 °C гидролизуется с образованием оксихлорида кюрия(III)[1]:
- Реакцией с бис(циклопентадиенил)бериллием может быть синтезирован трис(циклопентадиенил)кюрий состава Cm(C5H5)3[5]:
Таким образом, хлорид кюрия(III) используется в качестве исходного соединения для получения металлоорганических соединений кюрия.
Примечания
- Вейгель и др., 1997, с. 500.
- Лидин, 2000, с. 349.
- Кнунянц и др., 1990, с. 560.
- Вейгель и др., 1997, с. 499.
- Вейгель и др., 1997, с. 504.
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 560. — 673 с. — ISBN 5-85270-035-5.
- Вейгель Ф., Кац Д., Сиборг Г. и др. Химия актиноидов. — М.: Мир, 1997. — Т. 2. — 654 с. — ISBN 5-03-001885-9.
- Химические свойства неорганических веществ / под ред. Р.А. Лидина. — 3-е изд., испр. — М.: Химия, 2000. — С. 349. — 480 с. — ISBN 5-7245-1163-0.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.