Пуриновый обмен
Пури́новый обме́н (пури́новый метаболи́зм) — совокупность протекающих в живых организмах процессов синтеза и распада пуринов и пуриновых нуклеотидов.
Биосинтез
Из трёх составных частей нуклеотида — ортофосфорной кислоты, пентозы и азотистого основания — первая всегда присутствует в клетках, вторая непременно возникает в процессе углеводного обмена и только азотистое основание синтезируется специфическим путём.[1] Клетки большинства организмов (за исключением определённых паразитических форм и некоторых видов бактерий) способны к новообразованию пуринов.
Новообразование
Биосинтез пуринового ядра de novo осуществляется эволюционно консервативным метаболическим путём (с небольшими различиями у эволюционно отдалённых групп). Построение пуринового ядра начинается и полностью протекает на рибозо-5-фосфате (промежуточные соединения — риботиды), в результате чего сразу образуются нуклеотиды (нуклеозид-5′-фосфаты), а не свободные азотистые основания. Материалом служат очень простые, хорошо доступные соединения; построение пуринового ядра носит характер последовательной сборки; все реакции носят ферментативный характер. На определённом этапе возникает общий предшественник (нуклеотид IMP), из которого образуются другие пуриновые нуклеотиды. Процесс синтеза энергозатратен, так как необходимый для его эффективности сдвиг равновесия отдельных реакций происходит за счёт сопряжённого гидролиза ATP.
Синтез IMP у Escherichia coli, Microcystis aeruginosa, Streptomyces avermitilis, Bacillus subtilis:
PRPP → 5-PRA → GAR → FGAR → FGAM → AIR → NCAIR ⇌ CAIR ⇌ SAICAR ⇌ AICAR → FAICAR ⇌ IMP
Синтез IMP у Arabidopsis thaliana, Saccharomyces cerevisiae, Neurospora crassa, Drosophila melanogaster, Danio rerio, Homo sapiens:
PRPP → 5-PRA → GAR → FGAR → FGAM → AIR ⇌ CAIR ⇌ SAICAR ⇌ AICAR → FAICAR ⇌ IMP
У птиц открыта альтернативная реакция для первого шага:
R5P → 5-PRA
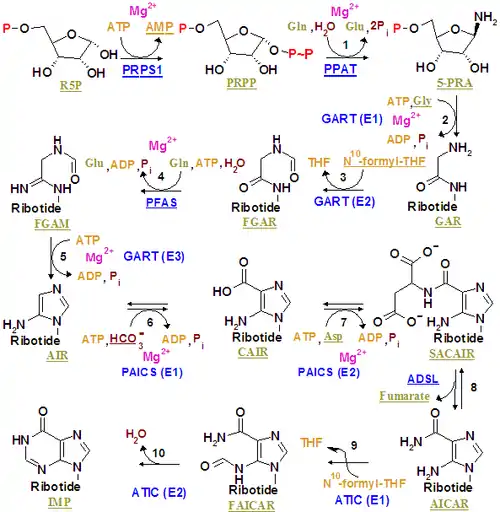
Новообразование пуринов у животных и человека
Новообразование пуриновых нуклеотидов протекает в цитозоле большинства клеток организма. Однако не все клетки и ткани организма одинаково способны к биосинтезу de novo пуринов — эритроциты, полиморфноядерные лейкоциты и частично мозг неспособны к новообразованию пуринов, и их потребности в пуринах обеспечиваются, в основном, за счёт синтеза в клетках печени[2].
Биосинтез адениловых нуклеотидов
AMP образуется из IMP в две реакции. Сначала IMP при взаимодействии с аспартатом даёт аденилосукцинат. Реакция сопряжена с гидролизом GTP до GDP и ортофосфата. Затем аденилосукцинат расщепляется до AMP и фумарата, причём за реакцию ответственен тот же фермент, который катализирует превращение SAICAR ⇌ AICAR.
Биосинтез гуаниловых нуклеотидов
GMP образуется из IMP в две реакции. Сначала IMP окисляется NAD-зависимой дегидрогеназой в XMP. Во второй реакции XMP аминируется в GMP. Донором аминогруппы может быть амидный азот глутамина или же аммоний. Реакция сопряжена с гидролизом ATP до AMP и неорганического пирофосфата.
Биосинтез дифосфатов и трифосфатов рибо- и дезоксирибонуклеозидов
Образовавшиеся AMP и GMP фосфорилируются киназами до дифосфатов, которые далее фосфорилируюся до трифосфатов в реакциях субстратного (ADP, GDP) или сопряжённого (ADP) фосфорилирования, либо же киназами. Восстановление рибозы до 2-дезоксирибозы в процессе биосинтеза дезоксирибонуклеотидов у большинства организмов происходит на уровне дифосфатов (у многих прокариот вместе с этим или вместо этого происходит восстановление на уровне трифосфатов).
Пуриногенные аминокислоты
Аминокислоты, выступающие донорами атомов в биосинтезе пуринов, называют пуриногенными аминокислотами. Пуриногенные аминокислоты — это глицин, глутамин и аспартат.
Реутилизация пуриновых оснований
Биосинтез пуринов de novo — относительно сложный, многоэтапный процесс, требующий значительных затрат энергии. Этим отчасти оправдывается функционирование в клетке так называемого пути реутилизации пуринов («путь сбережения», «путь спасения»). При этом большая часть свободных пуриновых оснований, которые образуются в результате ферментативного или спонтанного расщепления нуклеотидов, не выводится из клетки или организма и не подвергается дальнейшему распаду, а вновь включается в состав нуклеотидов. Химизм реутилизации заключается в том, что свободные пуриновые основания в присутствии специфических фосфорибозилтрансфераз взаимодействуют с 5-фосфорибозил-1-пирофосфатом (PRPP) с образованием рибонуклеотидов и неорганического пирофосфата (последний in vivo быстро гидролизуется пирофосфатазой, что делает реакцию практически необратимой). В пиримидиновом обмене путь реутилизации не имеет большого значения.[3]
История изучения биосинтеза пуринов
Пионерами в изучении биосинтеза пуринов были американские биохимики Джон Мехлин Бьюкенен (1917—2007), Дж. Роберт Гринберг (1918—2005), Артур Корнберг (1918—2007). Бьюкенен скармливал птицам (голубям) различные меченые соединения, затем выделял из их экскрементов мочевую кислоту и изучал включение и распределение радиоактивной метки. Работы Бьюкенена являются классическим примером расшифровки метаболических путей при помощи изотопных меток и энзимологической дифференциации на отдельные этапы.
Биодеградация
Известно несколько путей распада пуриновых оснований.
Уриколитический путь
Аденин дезаминируется в гипоксантин, гуанин — в ксантин. Гипоксантин окисляется в ксантин. Ксантин окисляется в мочевую кислоту (урат). Мочевая кислота в результате окислительного расщепления пиримидинового цикла превращается в аллантоин. В результате дальнейшего гидролитического расщепления имидазольного цикла из (S)-аллантоина образуется аллантоиновая кислота (аллантоевая кислота, аллантоат). В результате дальнейшего последовательного гидролитического отщепления двух молекул мочевины в качестве конечного продукта уриколиза образуется глиоксиловая кислота (глиоксилат).[4]
Большинство микроорганизмов, растения, многие рыбы, а также амфибии содержат полный набор уриколитических ферментов — конечными продуктами пуринового обмена у этих организмов является мочевина и глиоксилат, который вовлекается в метаболизм. Костистые рыбы в качестве конечного продукта пуринового обмена выделяют аллантоат. У большинства млекопитающих и некоторых насекомых уриколиз завершается образованием аллантоина. У большинства наземных насекомых и наземных моллюсков, у рептилий, птиц, человека и приматов ферменты расщепления урата отсутствуют и основным конечным продуктом распада пуриновых оснований является мочевая кислота. У урикотелических животных (птицы, большинство рептилий, большинство наземных насекомых и наземных брюхоногих моллюсков) мочевая кислота является основным конечным продуктом не только пуринового, но и азотистого обмена.[4]
Первичные метаболиты
Разумеется, нуклеотиды являются первичными метаболитами, но они также служат и предшественниками в синтезе других очень важных соединений.
GTP — исходный субстрат в биосинтезе рибофлавина, тетрагидробиоптерина, фолата, молибдоптерина, тетрагидрометаноптерина.
Биосинтез гистидина
Донором одного атома углерода и одного атома азота в биосинтезе гистидина выступает ATP, который в результате превращается в AICAR.
Биосинтез тиамина
Пиримидиновый фрагмент молекулы тиамина de novo образуется из AIR при участии S-аденозилметионина или из пиридоксальфосфата, в зависимости от вида организма.
Вторичные метаболиты
Метаболизм пуринов у различных организмов порождает некоторый набор вторичных метаболитов. Некоторые из этих метаболических производных обладают выраженной физиологической активностью, хорошо известны и имеют практическое применение (кофеин, теофиллин, теобромин). Некоторые структурные производные с выраженным пуриновым скелетом (сакситоксин) не являются метаболическими производными пуриновых азотистых оснований и синтезируются совершенно иначе.
Нарушения обмена
- Гиперурикемия
- Подагра
- Синдром Лёша — Найхана
- Гипоурикемия
- Ксантинурия
Фармакотерапия
См. также
- Нуклеотидный обмен
- Пиримидиновый обмен
- Азотистый обмен
- Пуриносома
Примечания
- Филиппович, 1999, с. 235.
- Коллектив авторов. Тема 10.1. Биосинтез и катаболизм пуриновых рибонуклеотидов. Заболевания, связанные с нарушением их метаболизма // Биологическая химия с упражнениями и задачами / Под ред. чл.-корр. РАМН С. Е. Северина. — М.: ГЭОТАР-Медиа, 2011. — С. 477—481. — 624 с. — 2000 экз. — ISBN 978-5-9704-1755-3.
- Филиппович, 1999, с. 245.
- Филиппович, 1999, с. 233—234.
Литература
Филиппович Ю. Б. Основы биохимии. — 4-е изд., перераб. и доп.. — М.: «Агар», 1999. — 512 с. — ISBN 5-89218-046-8.
Ссылки
- Purine metabolism — Reference pathway (англ.). KEGG. Дата обращения: 21 июля 2014.
- Энергетическая ценность продуктов (содержание пуринов).