Моллюски
Моллю́ски, или мягкоте́лые (лат. Mollusca), — тип первичноротых целомических животных со спиральным дроблением. Оценка общего количества видов моллюсков колеблется в разных публикациях в диапазоне от 100[1] до 200 тысяч[2]. В России насчитывают около 2900 видов[3]. Этот тип обычно делят на 7 или 8 современных классов, к которым добавляют минимум 3 полностью вымерших. Моллюски освоили практически все среды обитания: морские и пресноводные водоёмы, почву, наземно-воздушную среду. Некоторые моллюски стали временными или постоянными паразитами других животных.
Самых мелких представителей моллюсков относят к классу двустворчатых. Взрослые особи самого мелкого вида, Condylonucula maya достигают в длину 0,5 мм[4]. К моллюскам относят и крупнейших ныне живущих представителей беспозвоночных — колоссальных кальмаров (Mesonychoteuthis) из класса головоногих: их масса достигает 495 кг.
Моллюски очень разнообразны не только по размеру, но и по анатомическому строению и поведению. Головоногие моллюски, такие как кальмары, каракатицы и осьминоги, занимают одно из первых мест среди беспозвоночных по степени развития нервной системы.
Около 80 % видов моллюсков относят к классу брюхоногих, ещё около 19 % — к классу двустворчатые, и лишь около 1 % современных видов — к остальным классам.
Большинство моллюсков могут передвигаться с помощью ноги. У головоногих моллюсков нога трансформирована в щупальца и сифон. Одна из характерных особенностей моллюсков — минерализированная раковина, форма и строение которой меняется от класса к классу. У большинства головоногих раковины нет. Для моллюсков характерен особый ротовой орган — радула. У двустворчатых радула (как и вся голова) полностью редуцирована.
Жизненные циклы моллюсков также весьма разнообразны. Для сухопутных моллюсков и представителей класса головоногие характерно прямое развитие, а у многих представителей других классов есть личинки, такие как трохофоры, глохидии и велигеры.
Появление типа моллюсков датируют началом кембрийского периода.
Классификация, филогения и даже монофилия моллюсков как типа являются предметом дебатов.
Многие виды моллюсков (в основном сухопутные и пресноводные) оказались перед угрозой вымирания в результате человеческой деятельности и находятся под охраной.
Моллюски являются важным источником питания для человека, а также источником материалов, служащих сырьём для предметов роскоши, таких как перламутр, жемчуг, пурпур и виссон. Вместе с тем некоторые моллюски являются сельскохозяйственными вредителями, а некоторые могут представлять прямую угрозу для человека.
В популярной культуре моллюскам класса головоногих отведена роль морских чудовищ.
Этимология
Название «моллюск» происходит от лат. molluscus — «мягкий»[5][6][7]. Наука, изучающая моллюсков, называется малакология[7], а наука, изучающая их раковины, — конхиология[8].
Ареал
Моллюски распространены по всему земному шару и встречаются как на суше, так и в морях и океанах[9] (особенно в прибрежной зоне[10]). Сравнительно небольшое число видов освоило пресные и солоноватые водоёмы. Наибольшего разнообразия моллюски достигают в тропических морях. Самые глубоководные моллюски обнаружены в Марианской впадине на глубине около 11 000 м[11], а сухопутные улитки встречаются от тундры до тропиков и от низин до верхних поясов в горах[10].
На территории бывшего СССР морские моллюски наиболее разнообразны в дальневосточных водах, а из наземных много эндемичных видов, обитающих в Крыму, на Кавказе, в Карпатах и Средней Азии. Для зоогеографии представляют интерес моллюски-эндемики Байкала и Каспийского моря[10].
Строение и физиология
Наиболее общими характеристиками моллюсков можно считать отсутствие сегментации и билатеральную симметрию[12]. Однако у разных их групп тело становится асимметричным в результате смещения или неравномерного роста различных органов. Особенно ярко асимметрия выражена у брюхоногих моллюсков вследствие торсии и возникновения турбоспиральной раковины. Более конкретными объединяющими признаками служат наличие мантии и мантийной полости, выполняющей дыхательную и выделительную функции, а также строение нервной системы[13][14]. Большое разнообразие строения тела, наблюдаемое у моллюсков, затрудняет поиск синапоморфий (признаков, общих для них, но отсутствовавших у их предков), которые объединяли бы все их современные классы[15].
Общий план строения

Тело моллюсков не несёт следов истинной сегментации[16], несмотря на то, что некоторые органы (например, жабры хитонов и моноплакофор) могут иметь метамерное расположение.
Тело моллюсков, как правило, состоит из трёх отделов: головы, ноги и туловища[17], которое подразделяется на висцеральную массу (внутренностный мешок) и мантию с мантийным комплексом органов[18][19]. У представителей класса ямкохвостых ноги нет. Двустворчатые же моллюски вторично утрачивают голову.
Нога является мускулистым непарным выростом брюшной стенки тела и, как правило, служит для движения[20], однако может нести и другие функции[21]. Нога также несёт пару статоцистов — органов равновесия. У брюхоногих она выделяет слизь как смазку для облегчения передвижения. У видов с раковиной, покрывающей тело только сверху (например, морского блюдечка), нога прикрепляет моллюска к твёрдой поверхности с помощью вертикальных мышц. У других же моллюсков вертикальные мышцы втягивают ногу и другие мягкие части тела внутрь раковины[22]. У двустворчатых моллюсков нога приспособлена для зарывания в грунт[21] (впрочем, некоторые двустворчатые, например мидии, её утратили). У головоногих моллюсков нога преобразована в щупальца[23] и участвует в реактивном движении[21].
Туловище содержит все основные внутренние органы. В группе Conchifera оно сильно разрастается на дорсальную сторону в процессе эмбрионального развития, в результате чего формируется так называемый внутренностный мешок (висцеральная масса), рот и анальное отверстие сближаются, а кишка образует анопедиальный изгиб.
От боковых сторон туловища отходит мантия — складка стенки тела, покрытая, как и всё тело, эпидермисом и образующая мантийную полость, которая сообщается с внешней средой. У хитонов и моноплакофор мантия и раковина образуются не только за счёт туловища, но и за счёт головы[24]. В мантийной полости располагается так называемый мантийный комплекс органов: выводные пути половой, пищеварительной и выделительной систем, ктенидии, осфрадии и гипобранхиальная железа. Кроме того, к мантийному комплексу органов относят почки и перикард, расположенные рядом с мантийной полостью. У ранних моллюсков мантийная полость располагалась ближе к задней части тела, однако в современных группах её расположение широко варьирует. У двустворчатых моллюсков все мягкие части тела лежат в пределах мантийной полости[12].
Покровы

Считают, что у гипотетического предка моллюсков покровы были представлены кутикулой с арагонитовыми спикулами (иглами)[25]. Подобное строение покровов характерно для представителей классов Caudofoveata и Solenogastres. Однако у всех классов моллюсков, кроме Caudofoveata, появляется ресничная ползательная поверхность — нога (по этому признаку их объединяют в группу Adenopoda). У Solenogastres нога представлена педальной бороздой.
Хитоны (Polyplacophora) также обладают кутикулярными покровами, но только на латеральных поверхностях, называемых перинотальными складками. Дорсальная же поверхность прикрыта восемью раковинными пластинками.
В группе Conchifera (включающей классы Gastropoda, Cephalopoda, Bivalvia, Scaphopoda и Monoplacophora) кутикулярные покровы отсутствуют, а раковина состоит из одной пластинки или из двух (у двустворчатых, а также гастропод из семейства Juliidae).
Раковина секретируется мантией (некоторые группы, например голожаберные (Nudibranchia), её вторично лишены[12]) и состоит в основном из хитина и конхиолина (белок, укреплённый карбонатом кальция)[22][26]. Самый верхний слой раковины (периостракум) в практически всех случаях состоит только из конхиолина[22]. Моллюски никогда не используют фосфаты для укрепления своих покровов[27] (возможным исключением является ископаемый хитон Cobcrephora[28]). Хотя большая часть моллюсков инкрустирует свою раковину арагонитом, те брюхоногие, которые откладывают яйца с твёрдой раковинкой, используют кальцит (иногда со следами арагонита) для укрепления дочерних раковинок[29].
В раковине можно выделить 3 слоя: наружный (периостракум), состоящий из органического вещества, средний, сложенный столбчатым кальцитом, и внутренний, состоящий из пластинчатого кальцита, часто перламутровый[12]. Единственный в мире моллюск, наружный слой раковины которого образован сульфидами железа, — глубоководный брюхоногий моллюск Chrysomallon squamiferum, обитающий у «чёрных курильщиков»[30].
Интересный механизм имеет место при наследовании направления закручивания раковины у прудовика (у прудовика известны право- и левозакрученные раковины). Оно определяется не генотипом самого моллюска, а свойствами цитоплазмы яйцеклетки, а следовательно, генотипом материнского организма. Таким образом, в данном случае имеет место собственно цитоплазматическое наследование[31].
Целом
Несмотря на то, что моллюсков относят к целомическим животным, собственно цело́му у них отведено довольно скромное место. Целомические мешки у моллюсков представлены перикардом (полость сердечной сумки) и полостью гонад. Вместе они образуют гоноперикардиальную систему. Основной полостью организма моллюсков является гемоцель, через который циркулируют кровь и целомическая жидкость, промежутки между органами частично заполнены паренхимой. Почки фактически являются целомодуктами[32], связанными с перикардом. Предсердия выполняют часть функций выделительной системы, фильтруя отходы метаболизма из крови и сбрасывая их в целом уже в виде мочи[22]. Целомодукты, открывающиеся в полость гонад, — половые протоки (гонодукты)[33].
Нервная система
Для низших групп моллюсков — Caudofoveata, Solenogastres и Polyplacophora — характерна нервная система лестничного типа, схожая с таковой у некоторых кольчатых червей[33]. Она состоит из окологлоточного кольца и четырёх стволов: двух педальных (иннервируют ногу) и двух висцеральных[34] (иннервируют внутренностный мешок).
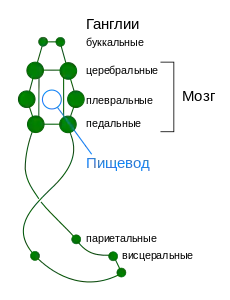
У большинства других представителей моллюсков наблюдаются образование ганглиев и их смещение к переднему концу тела, причём наибольшее развитие получает надглоточный нервный узел («головной мозг»)[19]. В результате формируется нервная система разбросанно-узлового типа.
В нервной системе разбросанно-узлового типа имеется две (у двустворчатых — три) пары нервных цепей: две брюшные цепи иннервируют внутренние органы, а две педальные — ногу. Обе пары цепей содержат ганглии как локальные центры контроля важных частей тела. Большинство пар соответствующих ганглиев, располагающихся по обе стороны тела, соединены между собой комиссурами. Обычно имеется 5 пар ганглиев: церебральные (иннервируют глаза и щупальца), педальные (нога), плевральные (мантия), париетальные (органы дыхания и осфрадии) и висцеральные (внутренние органы). Иногда выделяют также буккальные ганглии, иннервирующие глотку. Они вынесены из окологлоточного кольца и располагаются на дорзальной стороне глотки в месте перехода её в пищевод[35]. Церебральные, педальные и висцеральные ганглии связаны поперечными нервными тяжами — комиссурами[36]. Почти все ганглии располагаются ниже кишки, исключением являются лишь церебральные ганглии, располагающиеся над пищеводом. Педальные ганглии локализованы сразу под пищеводом, и их комиссуры и коннективы, связывающие их с церебральными ганглиями, образуют нервное кольцо вокруг пищевода. У видов, имеющих мозг, он окружает пищевод кольцом[22].
У многих брюхоногих в связи с закручиванием туловища образуется перекрёст между плевральными и париетальными ганглиями. Этот перекрёст получил название хиастоневрии. Нервную систему без перекрёста называют эпиневральной, а с перекрёстом — хиастоневральной[37].
Помимо рефлекторной деятельности, нервная система также регулирует рост и размножение через различные нейрогормоны[38].
Органы чувств
К органам чувств моллюсков относят глаза и щупальца, расположенные на голове, органы химического чувства — осфрадии, расположенные рядом с основанием жабр, и статоцисты на ноге[32]. Аккомодация глаза (у видов, которые к ней способны) происходит за счёт изменения его формы — отдаления или сближения сетчатки и хрусталика. Строение глаза у головоногих очень схоже с таковым у позвоночных животных, однако его аккомодация происходит иначе, и они по-разному развиваются в ходе онтогенеза. Главным образом на голове, ноге и крае мантии сосредоточены осязательные сенсорные клетки[33].
Кровеносная система
У моллюсков незамкнутая кровеносная система. В неё входят сердце (орган, обеспечивающий движение крови по сосудам и полостям тела) и сосуды. Сердце состоит из желудочка и одного или чаще двух предсердий (у наутилуса их 4). Кровеносные сосуды изливают кровь в промежутки между органами — в синусы и лакуны[33]. Затем кровь вновь собирается в сосуды и поступает в жабры или лёгкое. Кровь головоногих и некоторых брюхоногих моллюсков на воздухе имеет необычный голубоватый цвет. Этот цвет ей придаёт гемоцианин — медьсодержащий дыхательный пигмент, выполняющий функции, схожие с функциями гемоглобина в крови хордовых и кольчатых червей, поэтому при окислении кровь голубеет[39].
У головоногих кровеносная система почти замкнутая: вне сосудов кровь находится, только когда частично из капилляров вен и артерий вытекает в мелкие лакуны[39].
Пищеварительная система

У моллюсков пищеварительная система начинается ротовым отверстием, ведущим в ротовую полость, в которую обычно открываются слюнные железы. Пищеварительная система состоит из глотки, пищевода, желудка, средней и задней кишок (ректум). Есть также пищеварительная железа (печень), которая участвует в переваривании, всасывании и накоплении питательных веществ (клетки печени моллюсков отличаются способностью к фагоцитозу). Головоногие располагают также поджелудочной железой (у остальных моллюсков её функции выполняет пищеварительная железа).
У большинства видов в глотке есть радула («тёрка»)[40] — специальный аппарат для измельчения пищи. Радула покрыта хитиновыми зубцами, сменяющимися по мере их износа. Главной функцией радулы является соскабливание бактерий и водорослей с камней и других поверхностей. Радула связана с одонтофором — хрящевым поддерживающим органом[12]. Радула является уникальной для моллюсков и не находит эквивалентов в других группах животных. Помимо радулы нередко также бывают развиты хитиновые челюсти[33].
Попавшая в рот пища приклеивается к вязкой слюне, которая благодаря биению ресничек направляется к желудку[22]. На заострённом конце желудка рядом с границей с кишкой располагается простиль — конусообразное, заострённое кзади образование, состоящее из различных осадочных частиц. Слюна биением дополнительных ресничек направляется на простиль, так что он выступает в роли своеобразной бобины. Ещё пока слюна не достигла простиля, кислотность желудка делает слюну менее клейкой, и пищевые частицы отделяются от неё[22].
Далее пищевые частицы сортируются другой группой ресничек. Меньшие частицы, в основном минеральные, направляются ресничками к простилю, так что в конце концов они выделяются наружу, а большие частицы, в основном собственно пища, отправляются на переваривание в слепой отросток кишки. Процесс сортировки никак нельзя назвать хорошо слаженным[22].
Периодически моллюск выделяет фрагменты простиля, чтобы предотвратить его чрезмерное разрастание. Задняя кишка открывается анусом в мантийную полость. Анус омывается потоками воды, уходящей от жабр.
У плотоядных моллюсков пищеварительная система устроена проще[22]. У большинства водных моллюсков есть специальный орган — сифон, являющийся частью мантии (у головоногих — ноги). Через сифон моллюск осуществляет ток воды (реже воздуха), который используется для одной или нескольких целей: движения, питания, дыхания, размножения.
У некоторых солемий пищеварительная система атрофирована вплоть до полной редукции; предполагается, что они усваивают питательные вещества за счёт хемосинтезирующих бактерий.
Дыхательная система
Дыхательная система представлена перистыми кожистыми адаптивными жабрами — ктенидиями. Также важное значение имеет кожное дыхание, для некоторых оно даже является единственным. У сухопутных моллюсков вместо ктенидиев имеется особый орган воздушного дыхания — лёгкое, представляющее собой видоизменённую мантийную полость, стенки которой пронизаны кровеносными сосудами[33][41].
Выделительная система
Выделительная система моллюсков состоит из почек (метанефридиев)[32], в которых накапливаются продукты выделения в виде комочков мочевой кислоты. Они выводятся раз в 14—20 дней. У многих брюхоногих имеется лишь одна, левая почка, а наибольшее количество почек (5—6 пар) имеют представители моноплакофор[10]. Почечные воронки обращены в перикард, а выделительные отверстия открываются в мантийную полость[33]. Как уже было сказано выше, предсердия моллюсков, фильтруя кровь, фактически являются частью выделительной системы.
Осморегуляция
Морские моллюски являются пойкилоосмотическими животными, то есть они неспособны сохранять постоянное осмотическое давление (ОД) в тканях при изменении солёности воды[42], и ОД крови у них меняется вслед за его изменением в окружающей среде (иными словами, ОД морских моллюсков равно ОД морской воды, то есть они изотоничны той среде, в которой живут). Постоянное содержание воды и солей в клетке у них обеспечивает клеточная осморегуляция: при увеличении или уменьшении ОД среды на такую же величину изменяется концентрация осмотически активных органических веществ (в основном аминокислот). Таким образом, ОД в клетке и во внешней среде выравнивается[43].
Пресноводные моллюски гипертоничны своей среде обитания, так как их ОД больше ОД пресной воды. В связи с этим проблема осморегуляции встаёт более остро, чем у морских моллюсков. Общей чертой пресноводных моллюсков является то, что уровень солёности их тканей гораздо ниже, чем у морских, а также остальных пресноводных животных; кроме того, у пресноводных двустворчатых моллюсков этот показатель является самым низким среди всех животных[44]. Так что разность ОД моллюска и среды не очень велика, однако необходимость осморегуляции сохраняется. Эту функцию выполняют метанефридии, выделяя вместе с мочевой кислотой излишки воды и солей[45].
Половая система

Моллюски могут быть как гермафродитами (улитки), так и раздельнополыми (большинство двустворчатых). Однако у двустворчатого моллюска Arca noae был установлен протандрический гермафродитизм (сначала особи функционируют как самцы, потом как самки)[46]. В случае гермафродитизма каждая особь при оплодотворении выступает и как самец, и как самка. Протоки гонад — гонодукты — как указывалось выше, являются целомодуктами[33]. По ним половые клетки направляются в целом, откуда они отфильтровываются почками и отправляются в мантийную полость. Описанный механизм имеет место у раздельнополых моллюсков с наружным оплодотворением (оно осуществляется в воде). У более развитых, головоногих и большинства брюхоногих моллюсков, происходит внутреннее оплодотворение. У осьминогов для переноса половых продуктов в мантийную полость самки служит специализированное видоизменённое щупальце — гектокотиль[47].
Жизненный цикл
Личинки моллюсков

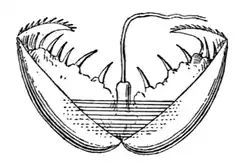
Оплодотворённая яйцеклетка претерпевает спиральное дробление, что является одним из признаков типа. У головоногих яйца проходят неполное дробление[10]. Развитие может быть прямым и непрямым. Существуют живородящие моллюски, например, брюхоногие из семейства Лужанки, или Живородки (Viviparidae). У них яйца оплодотворяются в теле самки и далее развиваются в яйцеводе, и новорождённые лужанки начинают вести такой же образ жизни, что и взрослые особи[48].
У низших моллюсков из яйца выходит трохофорная личинка, у большинства же эта стадия проходит в яйце[33]. Трохофора ведёт планктонный образ жизни, питается плавающими в воде пищевыми частицами, направляя их в рот при помощи двух рядов ресничек, расположенных по «экватору». Помимо этого, биением ресничек создаётся поток воды для удаления из анального отверстия непереваренных остатков пищи. Новые ткани образуются из залегающих внутри полос мезодермы, так что апикальный пучок ресничек и анус удаляются друг от друга по мере роста личинки.
Личинка, характерная для брюхоногих, двустворчатых и лопатоногих, называется парусник, или велигер[34], так как имеет широкие лопасти, несущие реснички и напоминающие парус. Эти лопасти развились из экваториальной полосы ресничек, ближних к апикальному пучку ресничек. В дальнейшем личинка оседает на дно и претерпевает метаморфоз, превращаясь во взрослое животное.
У некоторых пресноводных двустворчатых существует другая форма личинки — глохидий[49]. Глохидий имеет двустворчатую раковинку с крючками по краям, мощный аддуктор и липкую нить. С помощью нити и крючьев глохидии прикрепляются к жабрам и коже проплывающих рыб и внедряются в их ткани. Вокруг глохидия образуется небольшая опухоль, где личинка питается тканями хозяина и превращается в миниатюрного моллюска. Когда метаморфоз завершается, маленькие моллюски выпадают на дно через разрыв опухоли. Временный эктопаразитизм личинок двустворок обеспечивает их расселение[50][51].
Некоторые морские, большая часть пресноводных моллюсков, а также все сухопутные виды развиваются без метаморфоза, то есть у них наблюдается прямое развитие[33]. Без метаморфоза развиваются все головоногие[10].
У некоторых головоногих была отмечена забота о потомстве[52].

Продолжительность жизни у моллюсков сильно варьирует. В то время как многие виды моллюсков живут по нескольку месяцев или даже недель[54], среди двустворчатых встречаются представители с наибольшей продолжительностью жизни среди Metazoa — свыше 400 лет. К этому классу также относится большая часть видов животных, чья продолжительность жизни обычно составляет до 150 лет. Так, у морской двустворки Panopea abrupta, пресноводной двустворки Margaritifera margaritifera и океанского венуса Arctica islandica максимальная зарегистрированная продолжительность жизни составляет 163, 190 и 507 лет соответственно[53][55].
Для двустворчатых моллюсков была установлена связь между максимальным размером раковины, скоростью роста, возрастом полового созревания и продолжительностью жизни, а именно:
- максимальный размер раковины положительно связан с наибольшей продолжительностью жизни;
- срок жизни после полового созревания прямо пропорционален возрасту полового созревания;
- чем раньше двустворка достигает своих максимальных размеров, тем меньше её продолжительность жизни[55].
Так, у уже упоминавшегося долгоживущего моллюска Arctica islandica средний возраст полового созревания составляет 9,87 года, при этом массы в 20 г он достигает за 25—30 лет. В то же время двустворка Spisula solidissima достигает той же массы за 2—3 года и иногда начинает размножаться в первый год жизни[56].

Образ жизни и поведение
Моллюски — многочисленная и разнообразная группа животных, и их образы жизни также сильно различаются.
Хитоны — подвижные, медленно ползающие животные; питаются водорослями, которые соскребают радулой с твёрдых поверхностей. Есть хищные виды[57]. Класс Бороздчатобрюхие — высокоспециализированная группа, представители которой имеют червеобразное тело и обитают на гидроидных и коралловых полипах[58] (подробнее см. раздел Классификация). Ямкохвостые — морские червеобразные моллюски, обитают в грунте и питаются детритом или фораминиферами[59]. Лопатоногие — узкоспециализированные роющие организмы[60]. Первые современные моноплакофоры (Neopilina galatheae) были обнаружены в Тихом океане на глубине 3590 м[61], то есть они являются морскими глубоководными организмами.
Образы жизни представителей брюхоногих, двустворчатых и головоногих также весьма разнообразны, поэтому они рассматриваются в отдельных подразделах ниже.
Брюхоногие
Брюхоногие — самый многочисленный и разнообразный класс моллюсков. К нему относится 90 тысяч видов. Заселяют не только водную среду, но и сушу[62]
Большинство брюхоногих — обитатели морей, где встречаются как в прибрежной зоне, так и на больших глубинах, в самых разных климатических поясах (выносливы к различным температурам)[63]. Большинство из них ползают по поверхности дна, некоторые ведут роющий образ жизни. Существуют брюхоногие, утратившие раковину и перешедшие к плавающему образу жизни: крылоногие (Pteropoda), например, морской ангел, и киленогие (Heteropoda)[64]. Их тело стекловидно и прозрачно, нога преобразована в два больших крыловидных плавника (у крылоногих) или образует единственный килевидный плавник (киленогие)[63].
Среди брюхоногих моллюсков есть наземные виды, дышащие при помощи лёгких (подробнее см. Дыхательная система). Многие брюхоногие моллюски из подкласса Лёгочные переносят резкие колебания температуры, впадая в спячку — зимнюю на севере, летнюю и зимнюю на юге (примечание: летняя спячка животных называется эстивация, а зимняя — гибернация). Улитка переносит неблагоприятные условия в почве, втягиваясь в раковину и заклеивая устье застывшей слизистой плёнкой с большим содержанием извести — эпифрагмой[63]. У некоторых лёгочных (слизней) раковина редуцирована. Слизни могут зарываться в почву или прогрызать полости в тканях растений, грибов и лишайников[65]. Существуют также хищные слизни, питающиеся другими моллюсками или олигохетами[66].
Среди пресноводных моллюсков имеются также вторичноводные, дышащие кислородом воздуха, а живущие в воде (прудовики, катушки)[64].
Кроме того, существует очень немного паразитических брюхоногих, например Eulima bilineata и Odostomia turrita[67], Entocolax, Thyonicola. Настоящие паразиты есть только среди переднежаберных, большая часть паразитирует на коже или в полости тела иглокожих. Паразитические брюхоногие в связи со своим образом жизни характеризуются упрощением организации: утрата раковины, мантии, ноги и других органов вплоть до полной редукции пищеварительной, кровеносной и нервной систем[63].
Особую группу брюхоногих представляют кораллобионты (Coralliophilidae); у них раковина в форме извитой трубки прирастает к скелетам коралловых полипов. Верметиды (Vermetidae) со сходными трубковидными раковинами формируют плотные поселения на твёрдом субстрате[68].
У морского блюдечка (Patella), живущего в полосе прибоя, выражен инстинкт «дома» (хоминг): во время прилива блюдечко ползает по камням, соскребая водоросли, а во время отлива возвращается каждый раз на одно и то же место[69].
Двустворчатые

Двустворчатые в большинстве своём — биофильтраторы[68] и ведут малоподвижный или неподвижный образ жизни. Некоторые при этом прикрепляются к скалам или водорослям биссусом (Mytilus, Pinna и др.), другие прочно прирастают к субстрату створкой раковины (например, устрицы, а также Pinctada)[70]. Однако морские гребешки способны к реактивному движению, хлопая створками раковины за счёт мощного мускула-замыкателя; таким образом гребешки могут переплывать на небольшие расстояния[71][72].
Камнеточцы из семейства морских фиников (Lithophagidae) при помощи специального кислого секрета мантийной железы протачивают ходы в известняке и закрепляются в них при помощи биссуса, выставляя наружу сифоны[71]. Камнеточцы, способные повреждать известняки, песчаники и даже бетон, также образуют семейство камнеточцев фолад (Pholadidae). Весьма специфический образ жизни ведут представители семейства древоточцев, или корабельных червей (Teredinidae) (подробнее см. Питание)[73].
Преимущественно хищный образ жизни ведут представители надотряда перегородчатожаберные (Septibranchia)[73].
Двустворка Entovalva ведёт эндосимбиотический образ жизни и встречается только в пищеводе голотурий[74].
Головоногие
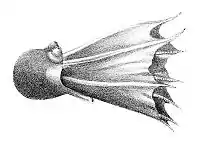
Головоногие — в большинстве своём хищные морские животные, свободно плавающие в толще воды[75]. Многие головоногие способны к реактивному движению. Некоторые головоногие ведут придонный образ жизни, часто укрываясь в расщелинах между камнями. Среди глубоководных форм иногда встречаются представители с торчащими, похожими на телескопы глазами[76].
Наутилус является бенто-пелагическим моллюском[77]. Каракатицы ведут некто-бентосный образ жизни[77]. Кальмары — главным образом нектонные животные, активно плавающие в толще воды, обладающие торпедовидной формой тела[78]. Большая часть осьминогов ведёт придонный образ жизни, но среди них имеются нектонные и даже планктонные формы[78]. У некоторых донных осьминогов между щупальцами находится тонкая перепонка, придающая животному вид диска, лежащего на дне[76].
Питание
По типу питания моллюски делятся на фильтраторов, растительноядных, хищных, паразитов и падальщиков, и их рационы чрезвычайно разнообразны.
Растительноядные моллюски питаются водорослями. Одни из них питаются микроскопическими нитчатыми водорослями, которые они соскребают при помощи радулы с различных поверхностей. Другие питаются макроскопическими растениями, к примеру, бурыми водорослями, соскребая радулой их поверхность. Во втором случае более крупные растения поедаются чаще, чем более мелкие, так как растение должно быть велико настолько, чтобы на нём уместился моллюск[79].
Головоногие моллюски по большей части (а возможно, и целиком) являются хищниками, поэтому у них радула имеет меньшее значение по сравнению с щупальцами и челюстями. Моноплакофора Neopilina использует радулу обычным образом, но в её рацион входят протисты, например ксенофиофора Stannophyllum[80]. Голожаберные из группы Doridacea, а также некоторые брюхоногие из группы Vetigastropoda питаются губками[81][82]. Существуют моллюски, питающиеся гидроидными полипами[83]. Брюхоногий хищный моллюск Charonia tritonis живёт в коралловых рифах и является одним из естественных врагов морской звезды «терновый венец», разрушающей кораллы[84].

Некоторые моллюски вступают в симбиоз с бактериями, участвующими в их процессе пищеварения, или же питаются за их счёт. Например, у некоторых солемий (Solemya) (класс двустворчатые), обитающих в условиях, где в грунте много сероводорода (побережья, занятые свалками, промышленными предприятиями), пищеварительная система атрофируется в разной степени, вплоть до полной редукции. Питаются же такие солемии предположительно за счёт окисляющих сероводород бактерий, поселяющихся в жабрах моллюска либо свободно живущих в грунте, но которых моллюск отфильтровывает и переваривает в клетках жабр[85]. Представители семейства Корабельные черви (Teredinidae) из класса Двустворчатых моллюсков имеют червеобразную форму тела и питаются древесиной деревянных подводных предметов, в которую вгрызаются сверлильным аппаратом раковинки (раковина редуцируется до двух маленьких пластинок на переднем конце тела). В результате древесина, пронизанная многочисленными ходами от корабельного червя, становится похожей на губку и легко разрушается. Переваривание древесины у корабельных червей осуществляют симбиотические бактерии[86].
Существуют также «фотосинтезирующие» моллюски — заднежаберные брюхоногие отряда Мешкоязычные (Sacoglossa)[87]. В их тканях накапливаются хлоропласты съеденных водорослей, отчего моллюск приобретает зелёный цвет и способность к фотосинтезу. Это явление получило название клептопластии.
У некоторых голожаберных брюхоногих моллюсков, питающихся гидроидными полипами, в полость спинных жабр вдаются изнутри отростки печени, содержащие непереваренные стрекательные клетки полипов (клептокниды). При раздражении эти клетки выстреливают и служат для защиты моллюсков[65].
Экология
Роль в экосистемах
В связи с тем, что моллюски — чрезвычайно многочисленная и разнообразная группа, представители которой приспособились к самым разным средам обитания и ведут самый различный образ жизни (от фильтраторов до хищников и паразитов), их роли в экосистемах также широко варьируют.
Морские моллюски составляют значительную часть бентоса. Плотность моллюсков на морском дне может достигать нескольких тысяч особей на 1 м²[1]. В толще морской воды многочисленны активно плавающие головоногие, ведущие хищный образ жизни[1].
Моллюски составляют важное звено в цепях питания в водных и наземных экосистемах; спектр их питания чрезвычайно широк (подробнее см. раздел Питание)[1]. Очень небольшое число видов приспособилось к паразитическому образу жизни.
Особо велика роль двустворчатых моллюсков как биофильтраторов, очищающих водоёмы от органического загрязнения. Кроме того, они поглощают и накапливают в своём теле тяжёлые металлы. Велика роль двустворчатых и в образовании осадочных пород[88].
Взаимоотношения с другими организмами
Выше были рассмотрены взаимоотношения с другими организмами хищных и растительноядных моллюсков, моллюсков-паразитов; рассматривались также некоторые случаи симбиотических взаимоотношений между моллюсками и другими организмами. В данном разделе мы подробно остановимся на естественных врагах моллюсков и некоторых других случаях симбиотических взаимоотношений между моллюсками и другими организмами, кроме рассмотренных выше симбиотических отношений между моллюсками и бактериями.
Естественные враги
Естественные враги наземных моллюсков (то есть лёгочных улиток) чрезвычайно разнообразны. Ими питаются птицы, рептилии, млекопитающие, а также несколько семейств жуков: Carabidae, Staphylinidae, Lampyridae, Drilidae и Silphidae. Некоторые двукрылые тоже являются хищниками и паразитоидами наземных моллюсков. Другие хищники наземных улиток — некоторые планарии, хищные наземные улитки, двупарноногие и губоногие многоножки, клопы и пауки. На наземных моллюсках паразитируют некоторые клещи, нематоды, инфузории, микроспоридии[89].

Для защиты от хищников морские моллюски нередко секретируют особые химические вещества, действующие на органы химического чувства хищника. Например, у каракатиц и других головоногих имеются специальные чернильные мешки, правда, чернила они пускают в ход тогда, когда другие способы — отбрасывание щупальца и секреция яда — не срабатывают. С помощью таких веществ, например, защищается от своих потенциальных врагов брюхоногий моллюск морской заяц (Aplysia): птиц, рыб, ракообразных, актиний. Основными врагами головоногих моллюсков также являются рыбы и ракообразные[90].
Прочная раковина и её округлая форма делают двустворчатых моллюсков малодоступными для хищников. Тем не менее многие животные питаются ими. Среди них есть и рыбы, например обыкновенный карп (Cyprinus carpio)[91]; среди птиц двустворчатыми питаются, например, кулик-сорока (Haematopus ostralegus), раскусывающий раковину специально адаптированным клювом[92], серебристая чайка (Larus argentatus), разбивающая раковины, сбрасывая на них камни[93], и коршун-слизнеед (Rostrhamus sociabilis), извлекающий улиток из раковин острым, идеально приспособленным для этого клювом[94]. Морские выдры (Enhydra lutris) питаются многими двустворчатыми моллюсками, разбивая их раковины камнями[95]. Морж (Odobenus rosmarus) является одним из главных хищников арктических вод, питающихся двустворками[96]. Из беспозвоночных естественными врагами двустворок являются крабы[97], морские звёзды и осьминоги[98]. Некоторые брюхоногие моллюски — устричное сверло (Urosalpinx), Eupleura caudata, Lunatia heros, Neverita duplicata — также уничтожают двустворок, в том числе ценных промысловых животных — устриц и мидий[99].
Механизмы защиты от врагов у двустворок разнообразны. Некоторые закапываются в грунт, как, например, Siliqua patula, способная закопаться за 7 секунд[100]; как упоминалось выше, морские гребешки и некоторые другие моллюски способны плавать, хлопая створками раковины. Другие двустворки способны ускакать от угрозы на ноге, используя её как пружину[101]. Двустворки, имеющие сифоны, могут скрыться внутри раковины, выставив их наружу; если хищник обломает их, они регенерируются[102]. Лимы, как, например, Limaria fragilis, в случае раздражения выделяют токсичные вещества[103].
Симбионты

Известны случаи симбиоза между моллюсками и другими беспозвоночными. Так, например, брюхоногий моллюск Colus gracilis вступает в симбиоз с актинией Hormathia digitata, актиния при этом поселяется на раковине моллюска[104].
Встречаются также симбиотические взаимоотношения между моллюсками и протистами (одноклеточными водорослями). В частности, двустворчатый моллюск Corculum cardissa вступает в симбиоз с протистом Symbiodinium corculorum из группы динофлагеллят. Клетки протистов при световой или трансмиссионной электроскопии обнаруживаются преимущественно в тканях мантии и жабр моллюска. Протисты (зооксантеллы) поселяются также в утолщённом крае мантии гигантской тридакны (Tridacna gigas), но, в отличие от C. cardissa, в клетках жабр они не обнаружены[105][106].
На раковинах моллюсков развивается одна из стадий жизненного цикла красной водоросли порфиры (Porphyra)[107].
Биолюминесценция
.JPG.webp)
Некоторые морские моллюски способны к биолюминесценции. К их числу относятся несколько необычных брюхоногих, например, представители рода Planaxis и эффектные голожаберные моллюски рода Phylliroe. Улитка Hinea brasiliana использует диффузную биолюминесценцию, чтобы в глазах хищника казаться больше в размерах и таким образом отпугнуть его[108]. К биолюминесценции способен пресноводный новозеландский брюхоногий моллюск Latia neritoides: будучи потревоженным, он испускает зелёное свечение[109].
Одним из наиболее давно известных и хорошо изученных люминесцирующих моллюсков является двустворчатый моллюск Pholas[110].
Однако наибольшее количество биолюминесцирующих моллюсков относится к классу головоногие. Только среди кальмаров их насчитывается по меньшей мере 70 видов[111]. Несколько родов семейств Sepiolidae и Loliginidae люминесцируют за счёт бактерий-симбионтов[112][113][114][115]. Остальные кальмары способны сами люминесцировать, используя люциферин как вещество, испускающее свет, и собственный фермент люциферазу, катализирующую окисление люциферина[110].
Кальмары демонстрируют большое разнообразие структур, участвующих в биолюминесценции. Большинство имеет 2 вентральных фотофора — органа, испускающих свечение[116]. Глубоководный адский кальмар-вампир Vampyroteuthis обладает настолько своеобразными органами свечения, что его даже выделили в отдельный отряд. Вдобавок к двум крупным мантийным фотофорам и маленьким светящимся органам, разбросанным по всему телу, он способен испускать свечение специальными органами на концах щупалец; вероятно, так он сбивает с толку хищника[117]. Для кальмара Octopoteuthis характерно большое цветовое разнообразие окраски; кроме того, он способен отбрасывать щупальца, если его потревожить. Этот моллюск использует испускающие свет концы щупалец как приманку для добычи[118]. Другим головоногим с органами свечения, расположенными на концах щупалец, является Taningia danae. Этот очень активный моллюск имеет клешневидные крючки на щупальцах вместо присосок и крупные (до 2 м) органы свечения на концах щупалец. Предполагается, что он использует люминесценцию для внутривидовой коммуникации, а также ослепления добычи[110].
Биолюминесценция известна и у осьминогов. Самки пелагических глубоководных осьминогов Japetella и Eledonella имеют зеленовато-жёлтое кольцо вокруг рта, которое только периодически люминесцирует[119]; это может играть роль в размножении[120]. У Stauroteuthis и других родов глубоководных осьминогов давно предполагалось наличие испускающих свечение присосок[121], но лишь недавно у них была установлена биолюминесценция[122]. Светящиеся линии, расположенные вдоль щупалец, как считают, служат для приманивания добычи.
Таким образом, разнообразие люминесцирующих структур у головоногих, как и у моллюсков в целом, чрезвычайно велико, и количество их независимых появлений в процессе эволюции гораздо больше, чем принято считать[110].
Заболевания моллюсков
Моллюски подвержены ряду вирусных, бактериальных, а также паразитарных заболеваний. Примерами вирусных заболеваний моллюсков могут служить вирусный ганглионеврит морских ушек (англ. Abalone viral ganglioneuritis, AVG)[123] и герпесоподобная вирусная инфекция (англ. Herpes-like virus infection); бактериальных — болезнь коричневого кольца (англ. Brown ring disease) и фиброз личинок/молодых особей (англ. Larval/juvenile fibrosis); паразитарных — перкинсоз (англ. Perkinsosis), мартеилиоз (англ. Marteiliosis), бонамиоз (англ. Bonamiosis), гаплоспоридиоз (англ. Haplosporidiosis) и митиликолоз (англ. Mytilicolosis)[124] (названия болезней даны по названиям паразитов-возбудителей).
Механизмы защиты у моллюсков в настоящее время в значительной мере остаются неясными. В конце прошлого века считалось, что у моллюсков отсутствуют иммуноглобулины (антитела) и приобретённый иммунитет. Главным же механизмом защиты считался фагоцитоз. Однако в последнее время были установлены большое разнообразие типов кровяных клеток (гемоцитов) моллюсков и их различия у разных моллюсков; так, у морских ушек и морских гребешков не были обнаружены гранулоциты, а у других брюхоногих — обнаружены. Происхождение, жизненный цикл, период жизни, функции каждого типа клеток ещё предстоит определить[125].
Некоторые возбудители заболеваний моллюсков способны влиять на иммунный ответ хозяина, модифицируя его. Например, микроклетки Bonamia roughleyi стимулируют фагоцитоз себя подходящими гемоцитами хозяина. Однако бактерию это не убивает; напротив, её клетки продолжают размножаться внутри клетки-хозяина, в конце концов лизируя её оболочку и высвобождаясь наружу. Это приводит к массовому разрушению кровяных клеток и гибели хозяина — устрицы[125].
Известны случаи, когда химические вещества, выделяемые патогеном, кастрируют моллюска. Например, вещества, выделяемые спороцитами Zoogonius rubellus, кастрируют его хозяина — морского брюхоногого Nassarius obsoletus. Изучение пресноводных улиток Lymnaea stagnalis, заражённых трематодой Trichobilharzia ocellata, показали, что вещества, секретируемые трематодой, индуцируют изменения в экспрессии генов хозяина. В результате подавляются митотические деления в мужском копулятивном органе и стимулируется развитие женских спинных эндокринных телец. Похожая ситуация имеет место в случае моллюска Haliotis asinina и трематоды Allopodocotyle sp. Шистосома Schistosoma mansoni использует для собственных нужд нейромедиаторы серотонин и дофамин хозяина Biomphalaria glabra, вызывая, таким образом, изменения в его эндокринной системе[125].
В 2016 году у двустворчатых моллюсков был описан заразный рак, передающийся посредством морской воды и заражающий моллюсков разных видов[126].
Классификация
По поводу количества классов моллюсков существуют различные мнения; в нижеследующей таблице рассмотрены 8 классов современных моллюсков[127], а также 2 общепризнанных класса ископаемых[128]. Классы Ямкохвостые (Caudofoveata) и Бороздчатобрюхие (Solenogastres) в некоторых старых работах объединяются в один класс Беспанцирные моллюски (Aplacophora), хотя, скорее всего, эти классы не являются близкими родственниками[129][130].
В русскоязычной литературе принято выделять два подтипа типа Моллюски: Боконервные (Amphineura), объединяющий панцирных и беспанцирных моллюсков, и Раковинные (Conchifera), включающий все остальные современные классы[57][131].
| Название | Изображение | Описание |
|---|---|---|
| Ямкохвостые, или каудофовеаты (Caudofoveata) |  Falcidens sp. |
Обитают в толще рыхлого морского осадка, где занимают экологическую нишу избирательных детритофагов или хищников[132]. Длина тела обычно 1—15 мм, некоторые особи достигают 30 мм[132]. |
| Бороздчатобрюхие (Solenogastres) |  Epimenia verrucosa |
Морские моллюски, обитающие в основном на колониях гидроидных и коралловых полипов, по которым ползают, изгибая червеобразное тело. В связи с узкой специализацией к обитанию на колониях полипов у большей части редуцируются мантийная полость, жабры, частично нога; развиты защитный кутикулярный покров, кожно-мускульный мешок, специализированная радула[58]. |
| Панцирные, или хитоны (Polyplacophora) |  Tonicella lineata |
Морские медленно ползающие животные, питаются, соскабливая водоросли с твёрдого субстрата, к которому присасываются подошвой ноги. Имеются немногочисленные хищные формы. На спинной стороне — панцирь из 8 пластинок; в случае опасности могут сворачиваться в шар, подобно ежу, выставляя пластинки наружу. В мантийной полости много пар жабр. Нога оснащена подошвой[57]. |
| Моноплакофоры (Monoplacophora) |  Helcionopsis sp. |
Один из наиболее примитивных классов, обладающий архаичными чертами — сохранением обширных целомических полостей, метамерией в строении некоторых систем органов, примитивной нервной системой[133]. |
| Двустворчатые, или пластинчатожаберные (Bivalvia) |  Tridacna sp. |
Наиболее характерные особенности строения — наличие раковины из двух створок, расположенных по бокам тела, и редукция головы и всех связанных с нею образований, включая радулу. Складки мантии подавляющего большинства двустворчатых моллюсков образуют на заднем конце тела вводной и выводной сифоны, с помощью которых двустворчатые организуют ток воды в мантийной полости[134]. |
| Лопатоногие, или ладьеногие (Scaphopoda) |  Antalis vulgaris |
Длина тела от 1,5 мм до 15 см. Тело двусторонне-симметричное, заключено в трубчатую раковину, напоминающую изогнутый клык или бивень слона. Нога (у некоторых видов редуцирована) обычно снабжена придатками в виде пары боковых лопастей либо зубчатого диска и приспособлена к рытью в грунте. На голове рот и многочисленные нитевидные придатки (каптакулы), служащие для поиска и захвата пищи. Глотка с челюстью и радулой (5 зубов в каждом сегменте). Жабры редуцированы, глаз нет. Кровеносная система лакунарного типа, циркуляция крови происходит благодаря сокращениям ноги[135]. |
| Брюхоногие, или гастроподы (Gastropoda) |  Cepaea hortensis |
Самый многочисленный класс в составе типа Mollusca, который включает около 100 000 видов, в России — 1620 видов[3]. Основной признак брюхоногих моллюсков — торсия, то есть поворот внутренностного мешка на 180°. Кроме того, для большинства гастропод характерно наличие турбоспиральной раковины[136]. |
| Головоногие (Cephalopoda) |  Sepioteuthis sepioidea |
Осьминоги, кальмары, каракатицы, адский вампир. Класс моллюсков, характеризующийся двусторонней симметрией и 8, 10 или большим количеством щупалец вокруг головы, развившихся из ноги. У представителей подкласса Coleoidea, или двужаберные, раковина редуцирована или полностью отсутствует, тогда как у представителей Nautiloidea внешняя раковина остаётся. Головоногие имеют наиболее совершенную из беспозвоночных кровеносную систему[137] и наиболее развитую нервную систему. Описано приблизительно 800 современных видов (и около 11 000 ископаемых), в России — 70 видов[3]. |
| †Rostroconchia |  Technophorus sharpei |
Ископаемые морские моллюски. Возможные предки двустворчатых[138]. |
| †Helcionelloida |  Latouchella costata |
Ископаемые морские улиткообразные моллюски. Наиболее известный представитель — Latouchella[139]. |
Сравнительная характеристика классов моллюсков
В следующей таблице приведена сравнительная характеристика строения классов моллюсков (в данной таблице классы Ямкохвостые (Caudofoveata) и Бороздчатобрюхие (Solenogastres) объединяются в один класс — Беспанцирные (Aplacophora), подробнее о классификации моллюсков см. ниже):
| Класс | |||||||
| Параметр сравнения[13] | Беспанцирные (Aplacophora)[129] | Панцирные (Polyplacophora)[140] | Моноплакофоры (Monoplacophora)[141] | Брюхоногие (Gastropoda)[142] | Головоногие (Cephalopoda)[143] | Двустворчатые (Bivalvia)[144] | Лопатоногие (Scaphopoda)[145] |
|---|---|---|---|---|---|---|---|
| Радула (тёрка) | Отсутствует у 20 % Neomeniomorpha | Есть | Есть | Есть | Есть | Нет | Внутренняя, не может выходить за пределы тела |
| Широкая мускулистая нога | Редуцирована или отсутствует | Есть | Есть | Есть | Преобразована в щупальца | Есть | Маленькая, только на «переднем» конце |
| Внутренностный мешок (висцеральная масса) | Не выражена | Есть | Есть | Есть | Есть | Есть | Есть |
| Крупный слепой отросток кишки | У некоторых отсутствует | Есть | Есть | Есть | Есть | Есть | Нет |
| Крупные метанефридии (почки) | Отсутствуют | Есть | Есть | Есть | Есть | Есть | Небольшие, простые |
Эволюция
Ископаемые


Ископаемые находки свидетельствуют о появлении в кембрийском периоде таких классов моллюсков, как брюхоногие, двустворчатые и головоногие. Происхождение же моллюсков как типа от базальной группы Lophotrochozoa и их последующая диверсификация до известных нам существующих и вымерших классов являются предметом дебатов.
Одним из основных спорных вопросов является систематическое положение некоторых представителей ископаемой эдиакарской и раннекембрийской фауны. Так, например, Kimberella (организм из отложений возрастом 555 млн лет) была описана Федонкиным как «моллюскообразное» животное[147][148], но другие исследователи сочли возможным охарактеризовать её лишь как «возможно двусторонне-симметричное»[149][150].
Ещё более остро стоит вопрос, была ли моллюском Wiwaxia (жившая 505 млн лет назад), а точнее, являлся ли её ротовой аппарат разновидностью радулы или же он был ближе к ротовому аппарату полихет[149][151]. Николас Баттерфилд, не относящий Wiwaxia к моллюскам, в то же время интерпретировал как фрагменты радулы более древние (510—515 млн лет) окаменелости[152].
Нет подобных сомнений относительно принадлежности к типу моллюсков представителей отряда Helcionelliformes, которые встречаются в отложениях возрастом 540 млн лет в Сибири и Китае[153][154]. Их раковины напоминают раковины улиток. Из этих находок можно сделать вывод, что моллюски с раковинами появились даже раньше трилобитов[139]. Большинство обнаруженных хелционеллид имеют длину лишь несколько миллиметров, но встречаются и экземпляры длиной в несколько сантиметров. Было высказано предположение, что мелкие хелционеллиды — это молодняк, а крупные — взрослые особи[155].
Некоторые исследователи относят хелционеллид к первым брюхоногим[156], но другие сомневаются в этом из-за отсутствия у них явных признаков торсии[146][157][158].
Долгое время самым ранним головоногим считалась Volborthella возрастом более 530 млн лет, но обнаружение экземпляров лучшей сохранности показало, что она, в отличие от моллюсков, не секретировала раковину, а собирала её из крупинок диоксида кремния. Кроме того, её раковины, в отличие от раковин головоногих, не разделены на камеры. Таким образом, на сегодняшний день классификация Volborthella остаётся неясной[159].
Самым древним головоногим на сегодняшний день[когда?] считается позднекембрийский Plectronoceras. Его раковина поделена на камеры перегородками — септами — и имеет сифон, как у современных наутилусов. Наличие в раковинах Plectronoceras «балласта» (каменистых отложений) привело исследователей к выводу, что этот моллюск был придонным, а не свободно плавающим, как современные головоногие[160]. Все головоногие, обладающие внешней раковиной (кроме некоторых наутилоидей), вымерли к концу мезозойской эры — 65 млн лет назад[161].
Раннекембрийские ископаемые Fordilla и Pojetaia считаются ранними двустворчатыми[162][163][164][165]. Двустворчатые моллюски, напоминающие современных, появляются в ордовикских отложениях (443—488 млн лет назад)[166].
Раньше к моллюскам относили класс хиолитов. Обладая раковинами и даже оперкулумом, они были довольно похожи на моллюсков[167]. Но в 2017 году доказано, что Hyolitha — отдельный тип из надтипа щупальцевых) (Lophophorata)[168].
Увеличение разнообразия экологических ниш моллюсков происходило постепенно. В кембрийском периоде моллюсков находят лишь в морских отложениях. Их распространение в пресноводные водоёмы произошло в девонском периоде, а первые сухопутные моллюски (лёгочные улитки) обнаружены в лишь в слоях, датируемых каменноугольным периодом[169].
Филогения
Филогения (эволюционное древо) моллюсков является предметом споров. Вдобавок к спорам по поводу того, чем является Kimberella и все Halwaxiida — моллюсками или близкими родственниками моллюсков[149][148][170][171], разногласия возникают и по поводу родственных связей между группами современных моллюсков[172]. В самом деле, некоторые группы животных, традиционно рассматриваемые в составе моллюсков, могут быть переопределены как отличные от моллюсков, хотя и родственные организмы[173].
| Lophotrochozoa |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Моллюски принадлежат к группе Lophotrochozoa[150], характеризующейся наличием трохофорной личинки и, в случае лофофорат (Lophophorata), наличием специального органа питания — лофофора. Другими представителями Lophotrochozoa являются кольчатые черви (Annelida) и ещё 7 типов морских организмов[175]. В диаграмме справа обобщены сведения по филогении моллюсков на 2007 год.
Так как родственные взаимоотношения между членами этого эволюционного древа неясны, сложно выделить черты, унаследованные всеми моллюсками от их последнего общего предка[176]. Например, непонятно, обладал ли он метамерией (то есть состоял ли он из повторяющихся одинаковых частей тела). Если это в самом деле было так, то моллюски произошли от животных, подобных кольчатым червям[177]. По этому вопросу мнения учёных расходятся: Giribet и коллеги в 2006 году сообщили, что наблюдаемая метамерия в строении жабр и ретракторных мышц ноги являются более поздними преобразованиями[178], в то время как Sigwart в 2007 году пришла к заключению, что предковый моллюск обладал метамерией, имел ногу для ползания и минерализованную раковину[172]. Считается также, что раковина раковинных моллюсков произошла от спикул (небольших игл) беспанцирных моллюсков, однако это плохо согласуется с появлением спикул в ходе онтогенеза[176].
Раковина моллюсков произошла от слизистых покровов, которые, постепенно укрепляясь, превратились в кутикулу. Кутикула непроницаема для воды и газов, поэтому с её появлением стал невозможен газообмен через покровы, что повлекло за собой развитие более сложного дыхательного аппарата — жабр[139]. В дальнейшем кутикула становилась более минерализованной, при этом активизировался тот же транскрипционный фактор (engrailed), что и у других двусторонне-симметричных при формировании скелета[177]. Первая раковина моллюсков была укреплена почти исключительно минералом арагонитом[179].
Как отмечалось выше, родственные связи между группами моллюсков также являются предметом обсуждений. Диаграммы, приведённые ниже, отображают две наиболее распространённые точки зрения по этому вопросу.
Морфологические исследования склоняют к выделению клады раковинных моллюсков, однако это находит меньше подтверждений со стороны молекулярного анализа[180]. Впрочем, молекулярный анализ показал и такие неожиданные парафилии, как разбиение двустворчатых по всем другим группам моллюсков[181].
Однако в 2009 году при сопоставлении данных морфологии и молекулярной филогенетики было показано, что моллюски не являются монофилетической группой; в частности, лопатоногие и двустворчатые оказались отдельными монофилетическими группами, не родственными остальным классам моллюсков. Таким образом, традиционно рассматриваемый тип Моллюски оказался полифилетическим, и его монофилию можно восстановить, лишь исключив из него двустворчатых и лопатоногих[173]. Анализ 2010 года подтверждает традиционное выделение групп раковинных и нераковинных моллюсков, однако он также подтвердил, что моллюски не являются монофилетической группой. На этот раз было показано, что бороздчатобрюхие ближе стоят к некоторым немоллюскам, чем к моллюскам[182].
Имеющихся на данный момент молекулярных данных недостаточно, чтобы чётко установить филогению моллюсков. Кроме того, современные методы определения самостоятельности клад склонны к переоценке, поэтому рискованно придавать слишком много значения их данным даже тогда, когда различные исследования приходят к одинаковым заключениям[183]. Вместо устранения заблуждений о неверных родственных связях последние исследования привнесли новые видения взаимосвязей групп моллюсков, так что даже гипотеза относительно выделения группы раковинных моллюсков была поставлена под сомнение[184].
Охрана моллюсков

В Международной Красной книге МСОП приведены по состоянию на октябрь 2017 года данные для 7276 видов моллюсков, из которых 297 видов считаются вымершими, а ещё 1984 вида (в основном относящиеся к классу брюхоногих) находятся в категориях повышенного риска (категории EW, CR, EN, VU списка)[186]. В Красную книгу России занесено 42 вида моллюсков[187]. Подавляющее большинство видов, находящихся под угрозой исчезновения различной степени риска, являются сухопутными и пресноводными[188].
Основными факторами риска для моллюсков МСОП считает загрязнение окружающей среды (в основном жидкими отходами сельского хозяйства и деревообрабатывающей промышленности), а также модификацию водных источников под нужды человека (постройка дамб, отвод воды)[186]. Иными словами, антропогенные факторы оказывают значительно более сильное влияние на численность моллюсков, чем природные. Антропогенные факторы во много раз ускоряют процесс вымирания моллюсков. Так, на Гавайских островах до их колонизации европейцами частота вымирания была равна порядка 1 вид на миллион лет. С появлением на них полинезийцев эта частота возросла до 1 вида на 100 лет. С 1778 года, когда капитан Джеймс Кук открыл Гавайи для европейцев, частота вымирания достигла 1—3 вида в год. На острове Муреа во Французской Полинезии 8 видов и подвидов рода Partula вымерли за период менее чем 10 лет из-за интродукции хищной улитки Euglandina rosea[188].
Для моллюсков, находящихся под угрозой исчезновения, характерен ряд общих черт: позднее половое созревание, относительно высокая продолжительность жизни, низкая плодовитость, ограниченный ареал и специфическая среда обитания[188].
Отдельную группу среди моллюсков под угрозой составляют островные моллюски-эндемики: представители эндемичного для Галапагосских островов семейства брюхоногих Bulimulidae; подсемейства брюхоногих Achatinellinae, эндемиков Гавайских островов, и другие[188].
Однако существуют моллюски, которых можно назвать «успешными»: гигантская африканская улитка Lissachatina fulica, уже упоминавшаяся хищная улитка Euglandina rosea, пресноводный двустворчатый моллюск Corbicula fluminea. Обладающие фантастической плодовитостью и способностью приспосабливаться к различным условиям, они быстро захватывают вакантные экологические ниши и в настоящее время встречаются в самых разных местообитаниях[188].
Взаимодействие с человеком
На протяжении тысяч лет моллюски употреблялись человеком в пищу. Кроме того, моллюски служили источником разнообразных ценных материалов, как например жемчуг, перламутр, пурпур, тхелет и виссон. В некоторых культурах раковины моллюсков служили валютой. Причудливые формы и гигантские размеры некоторых моллюсков породили мифы о морских чудовищах, таких как кракен. Моллюски некоторых видов ядовиты и могут представлять опасность для человека. Есть среди моллюсков и сельскохозяйственные вредители, например ахатина гигантская.
Использование

- В пищевой промышленности
Моллюски, в особенности двустворчатые, например мидии и устрицы, издревле служили пищей человеку[189]. Другие моллюски, которых часто употребляют в пищу, включают осьминогов, кальмаров, каракатиц и улиток[190]. В 2010 году в аквакультурных хозяйствах было выращено 14,2 млн тонн моллюсков, что составляет 23,6 % от всей массы моллюсков, употребляемых в пищу[191]. Некоторые страны регулируют импорт моллюсков и других морепродуктов, в основном для минимизации риска отравления токсинами, которые накапливаются в этих организмах[192].
По объёмам промысла брюхоногие моллюски уступают двустворчатым. В пищу употребляют таких морских брюхоногих, как морское блюдце (Patella), морское ухо (Haliotis), трубачи (Buccinum) (в России на Дальнем Востоке ведётся промысел, из них изготовляют консервы), литторины (Littorina), морские зайцы (Aplysia). Из сухопутных улиток в некоторых странах едят улиток родов Achatina, Lissachatina, Helix, слизней[193]. В некоторых европейских странах виноградных улиток (Helix pomatia) разводят в специальных хозяйствах[63].
В настоящее время добыча двустворчатых моллюсков уступает их искусственному разведению в марикультуре. Таким образом на специальных хозяйствах выращивают мидий и устриц. Особенно больших успехов такие хозяйства достигли в США, Японии, Франции, Испании, Италии. В России подобные хозяйства расположены на берегах Чёрного, Белого, Баренцева и Японского морей. Кроме того, в Японии развита марикультура морской жемчужницы (Pinctada)[194]. Стромбус гигантский является ценным промысловым моллюском для местного населения стран Карибского бассейна, включая Кубу[195].
Головоногие моллюски являются промысловыми животными, в пищу используется мясо каракатиц, кальмаров и осьминогов. Каракатиц и некоторых осьминогов добывают для получения чернильной жидкости, из которой изготавливают натуральные тушь и чернила[196].
- В производстве предметов роскоши и украшений

Большинство моллюсков, имеющих раковины, образуют жемчуг, но коммерческой ценностью обладают лишь жемчужины, покрытые слоем перламутра. Их создают только двустворчатые и некоторые брюхоногие моллюски[146][197]. Среди натурального жемчуга наибольшей ценностью обладает жемчуг двустворок Pinctada margaritifera и Pinctada mertensi, обитающих в тропической и субтропической частях Тихого океана. Промышленная добыча жемчуга на жемчужных фермах заключается в контролируемом внедрении твёрдых частиц в устриц и последующем сборе жемчужин. Материалом для внедряемых частиц часто служат перетёртые раковины других моллюсков. Использование этого материала в промышленных масштабах поставило некоторые пресноводные виды двустворок в юго-восточной части США на грань вымирания[197]. Промышленное разведение жемчуга послужило толчком к интенсивному изучению болезней моллюсков, необходимому для обеспечения здоровья поголовья культивируемых видов[198].


Добываемый из раковин перламутр используется для изготовления различных изделий, например пуговиц, а также для инкрустаций[199].
Кроме жемчуга, моллюски служат источником некоторых других предметов роскоши. Так, пурпур добывают из гипобранхиальных желёз некоторых иглянок. По свидетельству историка IV века до н. э. Феопомпа, пурпур ценился на вес серебра[200]. Большое количество раковин иглянок, обнаруженных на Крите, подтверждает предположение, что Минойская цивилизация была пионером в использовании пурпура уже в XX—XVIII веках до н. э., задолго до Тира, с которым этот материал часто ассоциируется[201][202].
Тхелет (ивр. תכלת) — краситель животного происхождения, применявшийся в древности для окрашивания ткани в синий, голубой или пурпурно-голубой цвета. Тхелет важен для некоторых обрядов иудаизма в качестве обязательного атрибута таких предметов, как цицит (кисти ви́дения) и одежда первосвященника. Несмотря на то, что метод получения тхелета был утрачен в VI веке н. э., к настоящему времени в научном мире практически сложился консенсус, согласно которому источником тхелета также был представитель семейства иглянок — обрубленный мурекс (Hexaplex trunculus)[203]. Виссон — дорогостоящая ткань, материалом для изготовления которой служит биссус. Это белковый материал, который выделяют некоторые виды двустворчатых моллюсков (наиболее известен Pinna nobilis) для крепления к морскому дну[204]. Прокопий Кесарийский, описывая персидские войны середины VI века н. э., утверждал, что только представителям правящих классов дозволялось носить хламиды из виссона[205].


Раковины моллюсков (или отдельные их фрагменты) использовались в некоторых культурах в качестве валюты. Ценность раковин не была фиксированной, а зависела от их количества на рынке. Поэтому они были подвержены непредвиденным скачкам инфляции, связанным с нахождением «золотой жилы» или усовершенствованием методов перевозки[206]. В некоторых культурах украшения из раковин служили признаками социального статуса[207].
- В качестве домашних животных
В домашних условиях чаще всего содержат сухопутных ахатин гигантских[208] и виноградных улиток. В аквариумистике распространены ампуллярии, мелании[209], катушки и прудовики[210]. В крупных океанариумах можно встретить осьминогов, кальмаров и каракатиц[211].
- В научно-исследовательской сфере
Токсины конусов отличаются высокой специфичностью производимого ими эффекта. Сравнительно небольшие размеры их молекул облегчают их лабораторный синтез. Два этих качества делают токсины конусов объектом для исследований в области неврологии[212][213]. Моллюски также представляют большой интерес для разработки лекарственных препаратов. Особенное внимание на себя обращают моллюски, в пищеварительном тракте которых обитают симбиотические бактерии. Возможно, вещества, выделяемые этими бактериями, найдут своё применение как антибиотики или нейрологические средства[214].
- Прочее использование
Минерализированная раковина моллюсков хорошо сохраняется в ископаемом виде. Поэтому в палеонтологии ископаемые моллюски служат «геологическими часами», позволяющими с большой точностью производить стратиграфическую датировку слоёв пород[215]. Раковины моллюсков с давних времён использовались как материал для изготовления различных инструментов: рыболовных крючков, резцов, скребков, насадок для мотыги[199]. Сами раковины употреблялись в качестве сосудов, а также музыкальных инструментов (конх) и украшений[199].
Раковины преимущественно брюхоногих, а также двухстворчатых и головоногих моллюсков являются объектами широко распространённого в мире вида коллекционирования[216]. Зародилось оно во времена Античности, а своей наибольшей популярности достигло в эпоху Великих географических открытий. В середине XIX века в интерьере викторианских домов непременно присутствует застеклённый шкаф, где наряду с окаменелостями и минералами выставлялись раковины морских моллюсков. Данный вид коллекционирования остаётся популярным и в наши дни[216].
Вредители

Некоторые виды моллюсков (в основном улитки) являются вредителями сельскохозяйственных культур[217]. Такой вид, попадая в новую среду обитания, способен вывести из равновесия местную экосистему. В качестве примера можно привести ахатину гигантскую (Lissachatina fulica) — вредителя растений. Она была интродуцирована во многие области Азии, а также на многие острова в Индийском и Тихом океанах. В 1990-х годах этот вид достиг Вест-Индии. Попытка бороться с ней путём интродукции хищной улитки Euglandina rosea только ухудшила ситуацию: этот хищник игнорирует ахатину и вместо неё истребляет местные виды улиток[218].
Виноградная улитка вредит винограду, а слизни — огородным культурам[193]. Полевой слизень (Agriolimax agrestis) наносит вред озимым посевам, картофелю, табаку, клеверу, огородным растениям, а сетчатый слизень (Deroceras reticulatum) наносит ущерб урожаям помидоров и капусты[66]. В южных районах угрозу для садов и огородов представляют слизни рода Parmacella[63].
Новозеландская пресноводная улитка Potamopyrgus antipodarum впервые была зарегистрирована в Северной Америке в середине 1980-х годов — сначала в западных, а затем и в восточных штатах США[219]. Хотя длина одной улитки составляет в среднем около 5 мм[220], её исключительная плодовитость приводит к концентрации до полумиллиона особей на один квадратный метр, что приводит к быстрому вымиранию местных насекомых и моллюсков, а также рыб, связанных с ними пищевой цепочкой[221].
Некоторые моллюски являются врагами промысловых моллюсков, например, вышеупомянутые хищные улитки. Crepidula fornicata иногда появляются на устричных банках (то есть отмелях Северного моря и Атлантического океана[70]) и в таких количествах, что самих устриц становится не видно; в результате устрицы погибают[99].
Корабельные черви из класса двустворчатых поселяются в погружённой в воду древесине, в том числе в подводных частях деревянных лодок и кораблей, а также в стационарных гидротехнических сооружениях. В процессе своей жизнедеятельности (см. выше раздел питание) корабельный червь протачивает в древесине многочисленные ходы, чем способствует её быстрому разрушению[222]. Наносимый корабельными червями ежегодный ущерб исчисляется миллионами[223].
Мелкая двустворка Dreissena polymorpha прикрепляется к твёрдому субстрату биссусом и образует значительные скопления. Часто она поселяется в трубах и водоводах, засоряя их[224].
Моллюски и здоровье человека

Многие моллюски производят или аккумулируют из окружающей среды токсины, представляющие угрозу для здоровья, а иногда и жизни человека. Отравление может происходить при укусе моллюска, соприкосновении с ним или при употреблении его в пищу. Среди смертельно опасных моллюсков существуют некоторые виды конусов из класса брюхоногих и синекольчатого осьминога (который нападает на человека, только если его спровоцировать)[225]. Все осьминоги в той или иной степени ядовиты[226].
Количество людей, погибших от контакта с моллюсками, составляет менее 10 % от людей, гибнущих от контакта с медузами[227]. Укус тропического вида осьминогов Octopus apollyon вызывает серьёзное воспаление, которое может продолжаться больше месяца даже при правильном лечении[228]. Укус Octopus rubescens при неверном лечении может вызвать некроз тканей, а при верном дело может ограничиться неделей головных болей и общей слабости[229].

Конусы всех видов ядовиты и могут ужалить при прикосновении. Но представители большинства видов слишком малы, чтобы быть серьёзной угрозой человеку. Обычно эти хищные брюхоногие питаются морскими беспозвоночными (некоторые крупные виды питаются также и рыбами). Их яд — смесь многих токсинов, часть из которых быстродействующие, а другие действуют медленнее, но более сильны. Судя по химическому составу токсинов конусов, для их выработки нужно меньше энергии, чем для выработки токсинов змей или пауков[212]. Есть документированные подтверждения многочисленных случаев отравлений, а также некоторое количество смертельных случаев[227]. По-видимому, серьёзную опасность для человека представляют только немногие крупные виды: те, которые способны поймать и убить рыбу[230].
Существуют также двустворчатые моллюски, ядовитые для человека; отравление может сопровождаться паралитическим эффектом (англ. Paralytic shellfish poisoning, PSP), потерей памяти (англ. Amnesic shellfish poisoning, ASP), гастроэнтеритами, долговременными нейрологическими расстройствами и даже смертью. Ядовитость двустворок обусловлена накоплением ими выделяющих токсины одноклеточных: диатомовых водорослей или динофлагеллят, которых они отфильтровывают из воды; иногда токсины сохраняются даже в хорошо приготовленных моллюсках[231]. Так, ядовитость двустворки Crassostrea echinata обусловлена токсинами протиста Pyrodinium bahamense из группы динофлагеллят[232].
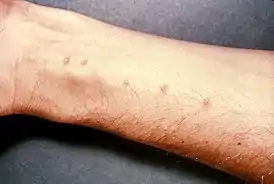
Пресноводные улитки в тропиках являются промежуточными хозяевами кровяных сосальщиков (трематод) из рода Schistosoma, которые вызывают заболевание шистосомоз[233]. S. mansoni проходит личиночную стадию в улитках из рода Biomphalaria, обитающих в Африке, на Аравийском полуострове и в Южной Америке. S. haematobium в качестве промежуточного хозяина использует улиток рода Bulinus, распространённых в пресных водоёмах Африки и Аравийского полуострова. Встречающийся по всей территории России малый прудовик (Limnea truncatula) является промежуточным хозяином печёночного сосальщика, который паразитирует в протоках печени копытных млекопитающих и человека[234].
Гигантская тридакна (Tridacna gigas) теоретически может представлять опасность для человека, во-первых, из-за острых краёв, а во-вторых, она может зажать створками конечность ныряльщика. Однако в настоящий момент случаев человеческих смертей из-за тридакны зарегистрировано не было[235].
Образ моллюсков в культуре
В человеческой культуре сформированы устойчивые стереотипы по отношению к трём самым известным классам моллюсков — брюхоногим, двустворчатым и головоногим.
Головоногие


Образ головоногого морского чудовища является одним из самых популярных стереотипов моллюсков. Мифическое существо кракен описывалось как гигантское головоногое[236] настолько убедительно, что даже вошло в первое издание «Системы природы» Линнея. Образ гигантского осьминога или спрута, представляющего опасность для кораблей и людей, был неоднократно зафиксирован как в литературе (например, сцена борьбы со спрутами в романе Жюля Верна «Двадцать тысяч льё под водой»), так и в живописи и кинематографе (например, в серии фильмов «Пираты Карибского моря»). Слово «спрут» стало устойчивым эвфемизмом для обозначения преступной организации, как, например, в одноимённом телесериале. Современный образ головоногого чудища, Катацуморидако, был создан братьями Стругацкими и описан в романе «Волны гасят ветер»[237].
Брюхоногие
Стереотип улитки в культуре — это, как правило, образ маленького, медлительного[238] и беззащитного существа. Образ «улитки на склоне», от которой ничего не зависит и которая ничего не может изменить, использован в названии одноимённого романа Стругацких, являясь аллюзией на известнейшее хокку Иссы («Тихо, тихо ползи, улитка, по склону Фудзи, вверх, до самых высот!»). Вместе с тем в Японии в образе улитки почитался дух — «Хозяин воды». По мнению Д. Трофимова, раковина улитки в рассказе Вирджинии Вулф «Kew Gardens» символизирует развитие сюжета по спирали[239]. Кроме японцев, улитки являются центральными персонажами алтайской, меланезийской мифологий, а также мифологии жителей Науру[240]. В христианстве медлительность улиток послужила тому, что они стали символом смертного греха — лени[241].

Двустворчатые
Двустворчатые моллюски в древнегреческой культуре были связаны с культом Афродиты. Так, на картине «Рождение Венеры» кисти Боттичелли Венера плывёт к берегу на створке раковины. Раковина присутствует и на фреске с аналогичным сюжетом, найденной в Помпеях. Раковины морского гребешка служили существенной частью культа богини-матери в Фесте[242]. Изображение морского гребешка, а порой и саму раковину, во времена Средневековья прикрепляли к одежде путешественники, пустившиеся в паломничество к Святым Местам. Подобная раковина служила одновременно и духовным, и совершенно земным целям, как то сосудом для сбора милостыни и тарелкой для еды. Из-за привычки паломников украшать себя подобным образом во французский язык вошло современное обозначение морского гребешка — «раковина Св. Иакова» (фр. coquille St. Jacques).
Примечания
- Шарова, 2002, с. 276.
- Ponder, Lindberg, 2008, p. 1.
- Высшие таксоны животных: данные о числе видов для России и всего мира. ЗООИНТ. Зоологический институт Российской академии наук. Дата обращения: 13 июля 2013.
- Extreme Bivalves (англ.) (недоступная ссылка). Rock the Future. Paleontological Research Institution and its Museum of the Earth. Дата обращения: 14 октября 2013. Архивировано 8 января 2014 года.
- Walde A., Hofmann J. B. Lateinisches etymologisches Wörterbuch. — Heidelberg: Carl Winter’s Universitätsbuchhandlung, 1938. — S. 103.
- de Vaan M. Etymological dictionary of Latin and the other Italic languages. — Leiden — Boston: Brill, 2008. — P. 386.
- Shorter Oxford English Dictionary (англ.) / L. Little, H. W. Fowler, J. Coulson, C. T. Onions. — Oxford University Press, 1964.
- Конхиология // Конда — Кун. — М. : Советская энциклопедия, 1973. — С. 88. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 13).
- Rawat, 2010, p. 7.
- Моллюски // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- C. Michael Hogan. Марианская впадина (недоступная ссылка). Загадки нашей планеты. zoopage.ru (23 августа 2010). Дата обращения: 21 июля 2013. Архивировано 7 октября 2013 года.
- Hayward, P. J. Handbook of the Marine Fauna of North-West Europe (англ.). — Oxford University Press, 1996. — P. 484—628. — ISBN 0-19-854055-8.
- Brusca R. C. and Brusca G. J. Invertebrates. — 2. — Sinauer Associates, 2003. — С. 702. — ISBN 0-87893-097-3.
- Ruppert, Fox, Barnes, 2004, pp. 284—291.
- Giribet G., Okusu A., Lindgren A. R., Huff S. W., Schrödl M. and Nishiguchi M. K. Evidence for a clade composed of molluscs with serially repeated structures: Monoplacophorans are related to chitons (англ.) // Proceedings of the National Academy of Sciences : journal. — United States National Academy of Sciences, 2006. — May (vol. 103, no. 20). — P. 7723—7728. — doi:10.1073/pnas.0602578103. — . — PMID 16675549.
- Rawat, 2010, p. 4.
- Беклемишев В. Н. Основы сравнительной анатомии беспозвоночных. М.: Наука, 1964, т. 1, с. 159.
- Заренков Н. А. Сравнительная анатомия беспозвоночных. Моллюски. М.: Изд-во Московского университета, 1989, с. 3.
- Rawat, 2010, p. 142.
- Rawat, 2010, p. 5.
- Wilbur, Karl M.; Trueman E. R.; Clarke M. R., eds. The Mollusca, 11. Form and Function. — N. Y.: Academic Press, 1985. — P. 4. — ISBN 0-12-728702-7.
- Ruppert E. E., Fox R. S. and Barnes R. D. Invertebrate Zoology. — 7. — Brooks / Cole, 2004. — С. 284—291. — ISBN 0-03-025982-7.
- Shigeno, S; Sasaki, T; Moritaki, T; Kasugai, T; Vecchione, M; Agata, K. Evolution of the cephalopod head complex by assembly of multiple molluscan body parts: Evidence from Nautilus embryonic development (англ.) // Journal of Morphology : journal. — Wiley-VCH, 2008. — January (vol. 269, no. 1). — P. 1—17. — doi:10.1002/jmor.10564. — PMID 17654542.
- Беклемишев В. Н. Основы сравнительной анатомии беспозвоночных. М.: Наука, 1964, т. 1, с. 156.
- Обнаружено ископаемое животное, близкое к общим предкам моллюсков и кольчатых червей
- Porter, S. Seawater Chemistry and Early Carbonate Biomineralization (англ.) // Science : journal. — 2007. — Vol. 316, no. 5829. — P. 1302. — doi:10.1126/science.1137284. — . — PMID 17540895.
- Dr. Ellis L. Yochelson. Discussion of early Cambrian “molluscs” // Journal of the Geological Society. — 1975. — Vol. 131. — P. 661—662. — doi:10.1144/gsjgs.131.6.0661.
- Cherns L. Early Palaeozoic diversification of chitons (Polyplacophora, Mollusca) based on new data from the Silurian of Gotland, Sweden // Lethaia. — 2004. — Vol. 37, № 4. — P. 445—456. — doi:10.1080/00241160410002180.
- Tompa A. S. A comparative study of the ultrastructure and mineralogy of calcified land snail eggs (Pulmonata: Stylommatophora) (англ.) // Journal of Morphology. — Wiley-VCH, 1976. — Vol. 150, no. 4. — P. 861—887. — doi:10.1002/jmor.1051500406.
- Chen C., Linse K., Copley J. T., Rogers A. D. The ‘scaly-foot gastropod’: a new genus and species of hydrothermal vent-endemic gastropod (Neomphalina: Peltospiridae) from the Indian Ocean (англ.) // Journal of Molluscan Studies. — 2015. — Vol. 81, no. 3. — P. 322—334. — doi:10.1093/mollus/eyv013.
- Инге-Вечтомов С. Г. Генетика с основами селекции. — СПб.: Издательство Н-Л, 2010. — С. 295. — 718 с. — ISBN 978-5-94869-105-3.
- Rawat, 2010, p. 6.
- Шарова, 2002, с. 277—279.
- Saxena, 2005, p. 2.
- Асеев Н. Эфферентная копия активности нейронов в пищевом поведении виноградной улитки Helix pomatia L. (недоступная ссылка). Дата обращения: 22 августа 2013. Архивировано 26 сентября 2013 года.
- Пименова, Пименов, 2005, с. 121—122.
- Пименова, Пименов, 2005, с. 122.
- Пименова, Пименов, 2005, с. 119.
- Шарова, 2002, с. 330.
- Rawat, 2010, p. 8.
- Шарова, 2002, с. 291.
- Пойкилосмотические животные // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Осморегуляция // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Dillon, Robert T. The Ecology of Freshwater Molluscs. — Cambridge University Press, 2000. — 509 p.
- Kidney-like organ helps freshwater snail osmoregulate.
- G. BELLO, P. PAPARELLA, A. CORRIERO, N. SANTAMARIA. Protandric hermaphroditism in the bivalve Arca noae (Mollusca: Arcidae) // Mediterranean Marine Science. — 2013. — Т. 14, № 1. — С. 86—91.
- Шарова, 2002, с. 324.
- Пименова, Пименов, 2005, с. 124.
- Hartfield P. and Hartfield E. (1996). Observations on the conglutinates of Ptychobranchus greeni (Conrad, 1834) (Mollusca: Bivalvia: Unionoidea). American Midland Naturalist 135(2) 370—75.
- Шарова, 2002, с. 312.
- Пименова, Пименов, 2005, с. 130.
- Encyclopedia of Life: Introduction to Mollusks.
- Variability of marine climate on the North Icelandic Shelf in a 1357-year proxy archive based on growth increments in the bivalve Arctica islandica.
- Продолжительность жизни // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- I. D. Ridgway, C. A. Richardson, S. N. Austad. Maximum Shell Size, Growth Rate, and Maturation Age Correlate With Longevity in Bivalve Molluscs // J Gerontol A Biol Sci Med Sci. — 2011. — Vol. 66А, № 2. — P. 183—190. — doi:10.1093/gerona/glq172.
- I. Thompson, D. S. Jones, J. W. Ropes. Advanced age for sexual maturity in the ocean quahog Arctica islandica (Mollusca: Bivalvia) // Marine Biology. — 1980. — Vol. 57, № 1. — P. 35—39. — ISSN 1432-1793. — doi:10.1007/BF00420965.
- Шарова, 2002, с. 279.
- Шарова, 2002, с. 283.
- Шарова, 2002, с. 284.
- Шарова, 2002, с. 321.
- Шарова, 2002, с. 286.
- И. Х. Шарова. Зоология беспозвоночных. — Москва: ВЛАДОС, 2004. — С. 288.
- Догель, 1981, с. 470.
- Шарова, 2002, с. 288.
- Шарова, 2002, с. 298.
- Пименова, Пименов, 2005, с. 127.
- Ivan O. Nekhaev. Two species of parasitic molluscs new for Russian seas // Ruthenica. — 2011. — Vol. 21, № 1. — P. 69—72.
- Шарова, 2002, с. 304.
- Шарова, 2002, с. 295.
- Догель, 1981, с. 481.
- Шарова, 2002, с. 315.
- Пименова, Пименов, 2005, с. 134.
- Шарова, 2002, с. 316.
- Lützen, J.; Berland, B.; Bristow, G. A. Morphology of an endosymbiotic bivalve, Entovalva nhatrangensis (Bristow, Berland, Schander & Vo, 2010) (Galeommatoidea) (англ.) // Molluscan Research : journal. — 2011. — Vol. 31, no. 2. — P. 114—124.
- Шарова, 2002, с. 322.
- Догель, 1981, с. 498.
- Шарова, 2002, с. 332.
- Шарова, 2002, с. 333.
- Steneck R. S.; Watling L. Feeding capabilities and limitation of herbivorous molluscs: A functional group approach // Marine biology. — 1982. — Vol. 68, № 3. — P. 299—319. — doi:10.1007/BF00409596.
- Ole Secher Tendal. Xenophyophores (Protozoa, Sarcodina) in the diet of Neopilina galatheae (Molluscs, Monoplacophora) (англ.) // Galathea : journal. — Vol. 16. — P. 095—098. Архивировано 30 ноября 2012 года.
- Publishers, Bentham Science. Current Organic Chemistry. — 1999.
- Gele H. Diet of some Antarctic nudibranchs (Gastropoda, Opisthobranchia, Nudibranchia) // Marine biology. — 1989. — Vol. 100, № 4. — P. 439—441. — doi:10.1007/BF00394819.
- Lambert W. J. Coexistence of Hydroid Eating Nudibranchs: Do Feeding Biology and Habitat Use Matter? (англ.) : journal. — doi:10.2307/1542096.
- Crown of thorns starfish (Acanthaster planci) (недоступная ссылка). Дата обращения: 21 августа 2013. Архивировано 5 октября 2013 года.
- Солемии — статья из Биологического энциклопедического словаря
- Пименова, Пименов, 2005, с. 135.
- Jensen K. R. (November 2007). Biogeography of the Sacoglossa (Mollusca, Opisthobranchia) Архивная копия от 5 октября 2013 на Wayback Machine. Bonner zoologische Beiträge 55(2006)(3—4): 255—281.
- Шарова, 2002, с. 318.
- Natural Enemies of Terrestrial Molluscs / G. M. Barker. — CABI, 2004. — 644 p. — ISBN 0-85199-319-2.
- Charles D. Derby. Escape by Inking and Secreting: Marine Molluscs Avoid Predators Through a Rich Array of Chemicals and Mechanisms // Biol. Bull. — 2007. — Vol. 213, № 3. — P. 274—289.
- Thorp J. H.; Delong M. D.; Casper A. F. In situ experiments on predatory regulation of a bivalve mollusc (Dreissena polymorpha) in the Mississippi and Ohio Rivers (англ.) // Freshwater Biology : journal. — 1998. — Vol. 39, no. 4. — P. 649—661. — doi:10.1046/j.1365-2427.1998.00313.x.
- Hulscher J. B. The oystercatcher Haematopus ostralegus as a predator of the bivalve Macoma balthica in the Dutch Wadden Sea (англ.) // Ardea : journal. — 1982. — Vol. 70. — P. 89—152. (недоступная ссылка с 30-12-2013 [2982 дня])
- Ingolfsson, Agnar; Bruce T. Estrella. The development of shell-cracking behavior in herring gulls (англ.) // The Auk : journal. — 1978. — Vol. 95, no. 3. — P. 577—579.
- Ястребы и канюки // Детская энциклопедия. Царство животных / Пер. с англ. С. В. Чудова. — М.: ЗАО «Издательский Дом Оникс», 2000. — С. 100. — 256 с. — ISBN 5-249-00214-5.
- Hall K. R. L.; Schaller G. B. Tool-using behavior of the California sea otter (англ.) // Journal of Mammalogy. — 1964. — Vol. 45, no. 2. — P. 287—298. — doi:10.2307/1376994. — .
- Fukuyamaa A. K.; Olivera J. S. Sea star and walrus predation on bivalves in Norton Sound, Bering Sea, Alaska (англ.) // Ophelia : journal. — 1985. — Vol. 24, no. 1. — P. 17—36. — doi:10.1080/00785236.1985.10426616.
- Harper, Elizabeth M. The role of predation in the evolution of cementation in bivalves (англ.) // Palaeontology : journal. — 1990. — Vol. 34, no. 2. — P. 455—460. (недоступная ссылка)
- Wodinsky, Jerome. Penetration of the shell and feeding on gastropods by octopus (англ.) // American Zoologist : journal. — Oxford University Press, 1969. — Vol. 9, no. 3. — P. 997—1010. — doi:10.1093/icb/9.3.997.
- Моллюски — статья из Энциклопедии Кольера
- Pacific razor clam. California Department of Fish and Game (2001). Дата обращения: 9 мая 2012. Архивировано 24 августа 2013 года.
- Bourquin, Avril. Bivalvia: The foot and locomotion (недоступная ссылка). The Phylum Mollusca (2000). Дата обращения: 19 апреля 2012. Архивировано 24 августа 2013 года.
- Hodgson A. N. Studies on wound healing, and an estimation of the rate of regeneration, of the siphon of Scrobicularia plana (da Costa) (англ.) // Journal of Experimental Marine Biology and Ecology : journal. — 1981. — Vol. 62, no. 2. — P. 117—128. — doi:10.1016/0022-0981(82)90086-7.
- Fleming P. A.; Muller D.; Bateman P. W. Leave it all behind: a taxonomic perspective of autotomy in invertebrates (англ.) // Biological Reviews : journal. — 2007. — Vol. 82, no. 3. — P. 481—510. — doi:10.1111/j.1469-185X.2007.00020.x. — PMID 17624964.
- R. M. L. Ates. Observations on the symbiosis between Colus gracilis (Da Costa, 1778) (Mollusca: Gastropoda) and Hormathia digitata (O. F. Müller, 1776) (Cnidaria: Actiniaria).
- MARK A. FARMER, WILLIAM K. FITT, ROBERT K. TRENCH. Morphology of the Symbiosis Between Corculum cardissa (Mollusca: Bivalvia) and Symbiodinium corculorum (Dinophyceae) // Biol. Bull. — 2001. — Vol. 200. — P. 336—343.
- Пименова, Пименов, 2005, с. 131.
- Мухин В. А., Третьякова А. С. Биологическое разнообразие: водоросли и грибы. — Ростов н/Д.: Феникс, 2013. — С. 42—43. — 269 с. — ISBN 978-5-222-20177-0.
- Bizarre Bioluminescent Snail: Secrets of Strange Mollusk and Its Use of Light as a Possible Defense Mechanism Revealed.
- Mollusks: Bioluminescence (недоступная ссылка). Дата обращения: 13 октября 2013. Архивировано 25 января 2014 года.
- Steven H. D. Haddock, Mark A. Moline, James F. Case. Bioluminescence in the Sea // Annual Review of Marine Science. — 2010. — Vol. 2. — P. 443—493. — doi:10.1146/annurev-marine-120308-081028.
- Herring P. J. Luminescence in cephalopods and fish // Symp. Zool. Soc. Lond. — 1977. — № 38. — P. 127—159.
- Ruby E. G., McFall-Ngai M. J. A squid that glows in the night: development of an animal-bacterial mutualism // J. Bacteriol. — 1992. — № 174. — P. 4865—4870.
- Jones B., Nishiguchi M. Counterillumination in the Hawaiian bobtail squid, Euprymna scolopes Berry (Mollusca: Cephalopoda) // Mar. Biol. — 2004. — № 144. — P. 1151—1155.
- Nyholm S. V., McFall-Ngai M. The winnowing: establishing the squid-vibrio symbiosis // Nat. Rev. Microbiol. — 2004. — № 2. — P. 632.
- Nyholm S. V., Stewart J. J., Ruby E. G., McFall-Ngai M. J. Recognition between symbiotic Vibrio fischeri and the haemocytes of Euprymna scolopes // Environ. Microbiol. — 2009. — № 11. — P. 483—493.
- Herring P. J., Widder E. A., Haddock S. H. D. Correlation of bioluminescence emissions with ventral photophores in the mesopelagic squid Abralia veranyi (Cephalopoda: Enoploteuthidae) // Mar. Biol. — 1992. — № 112. — P. 293—298.
- Robison B. H., Reisenbichler K. R., Hunt J. C., Haddock S. H. D. Light production by the arm tips of the deep-sea cephalopod Vampyroteuthis infernalis // Biol. Bull. — 2003. — № 205. — P. 102—109.
- Bush S. L., Robison B. H., Caldwell R. L. Behaving in the dark: locomotor, chromatic, postural, and bioluminescent behaviors of the deep-sea squid Octopoteuthis deletron Young 1972 // Biol. Bull. — 2009. — Vol. 216, № 1. — P. 7—22.
- Robison B. H., Young R. E. Bioluminescence in pelagic octopods. — 1981. — № 35. — P. 39—44.
- Herring P. J. Sex with the lights on? A review of bioluminescent sexual dimorphism in the sea // J. Mar. Biol. Assoc. UK. — 2007. — № 87. — P. 829—842.
- Chun C. Die Cephalopoden. Oegopsida // Wissenschaftliche Ergebnisse der Deutschen Tiefsee-Expedition, «Valdivia» 1898—1899. — Stuttgart, Germany: Fischer Verlag, 1910. — Bd. 18. — S. 1—522.
- Johnsen S., Balser E. J., Fisher E. C., Widder E. A. Bioluminescence in the deep-sea cirrate octopod Stauroteuthis syrtensis verrill (Mollusca: Cephalopoda) // Biol. Bull. — 1999. — № 197. — P. 26—39.
- Viral diseases of molluscs: Abalone viral ganglioneuritis (AVG) (недоступная ссылка). Дата обращения: 22 августа 2013. Архивировано 12 февраля 2014 года.
- F. Berthe. Report about mollusc diseases.
- J. BRIAN JONES. Current trends in the study of molluscan diseases // Diseases in Asian Aquaculture. — № 7.
- Metzger Michael J., Villalba Antonio, Carballal María J., Iglesias David, Sherry James, Reinisch Carol, Muttray Annette F., Baldwin Susan A., Goff Stephen P. Widespread transmission of independent cancer lineages within multiple bivalve species // Nature. — 2016. — Июнь (т. 534, № 7609). — С. 705—709. — ISSN 0028-0836. — doi:10.1038/nature18599.
- Haszprunar, G. Encyclopedia of Life Sciences. — John Wiley & Sons, Ltd., 2001. — doi:10.1038/npg.els.0001598.
- Edited by Winston F. Ponder, David R. Lindberg. Phylogeny and Evolution of the Mollusca / Ponder, W. F. and Lindberg, D. R.. — Berkeley: University of California Press, 2008. — С. 481. — ISBN 978-0-520-25092-5.
- Ruppert E. E., Fox R. S. and Barnes R. D. Invertebrate Zoology. — 7th ed. — Brooks / Cole, 2004. — P. 291—292. — ISBN 0-03-025982-7.
- Healy J. M. The Mollusca // Invertebrate Zoology (англ.) / Anderson, D. T.. — 2. — Oxford University Press, 2001. — P. 120—171. — ISBN 0-19-551368-1.
- Догель, 1981, с. 443.
- Рупперт Э. Э., Фокс Р. С., Барнс Р. Д. Низшие целомические животные // Зоология беспозвоночных. Функциональные и эволюционные аспекты = Invertebrate Zoology: A Functional Evolutionary Approach / пер. с англ. Т. А. Ганф, Н. В. Ленцман, Е. В. Сабанеевой; под ред. А. А. Добровольского и А. И. Грановича. — 7-е издание. — М.: Академия, 2008. — Т. 2. — 448 с. — 3000 экз. — ISBN 978-5-7695-2740-1.
- Enrico Schwabe, A summary of reports of abyssal and hadal Monoplacophora and Polyplacophora (Mollusca), Zootaxa 1866: 2005—222 (2008)
- Vaught, K. C. A Classification of the Living Mollusca. — American Malacologists, 1989. — ISBN 978-0-915826-22-3.
- Introduction to the Scaphopoda
- Биологический словарь. Улитки
- Wells M. J. (1 April 1980). «Nervous control of the heartbeat in octopus». Journal of Experimental Biology 85 (1): 112. http://jeb.biologists.org/cgi/content/abstract/85/1/111
- Clarkson E. N. K. Invertebrate Palaeontology and Evolution. — Blackwell, 1998. — С. 221. — ISBN 0-632-05238-4.
- Runnegar, B. and Pojeta, J. Molluscan phylogeny: the paleontological viewpoint (англ.) // Science. — 1974. — Vol. 186, no. 4161. — P. 311—317. — doi:10.1126/science.186.4161.311. — . — PMID 17839855.
- Ruppert et al., 2004, pp. 292—298.
- Ruppert et al., 2004, pp. 298—300.
- Ruppert et al., 2004, pp. 300—343.
- Ruppert et al., 2004, pp. 343—367.
- Ruppert et al., 2004, pp. 367—403.
- Ruppert et al., 2004, pp. 403—407.
- Ruppert, Fox, Barnes, 2004, pp. 300—343.
- Fedonkin M. A.; Waggoner B. M. The Late Precambrian fossil Kimberella is a mollusc-like bilaterian organism (англ.) // Nature : journal. — 1997. — Vol. 388, no. 6645. — P. 868. — doi:10.1038/42242. — .
- Fedonkin M. A., Simonetta A. and Ivantsov A. Y. New data on Kimberella, the Vendian mollusc-like organism (White Sea region, Russia): palaeoecological and evolutionary implications (англ.) // Geological Society, London, Special Publications : journal. — 2007. — Vol. 286. — P. 157—179. — doi:10.1144/SP286.12. — . Архивировано 21 июля 2008 года.
- Butterfield N. J. Hooking some stem-group «worms»: fossil lophotrochozoans in the Burgess Shale (англ.) // BioEssays : journal. — 2006. — Vol. 28, no. 12. — P. 1161—1166. — doi:10.1002/bies.20507. — PMID 17120226.
- Sigwart J. D. and Sutton M. D. Deep molluscan phylogeny: synthesis of palaeontological and neontological data (англ.) // Proceedings of the Royal Society: Biology : journal. — 2007. — October (vol. 274, no. 1624). — P. 2413—2419. — doi:10.1098/rspb.2007.0701. — PMID 17652065. Резюме — в The Mollusca. University of California Museum of Paleontology. Дата обращения: 2 октября 2008. Архивировано 15 декабря 2012 года.
- Caron J. B.; Scheltema A., Schander C. and Rudkin D. A soft-bodied mollusc with radula from the Middle Cambrian Burgess Shale (англ.) // Nature : journal. — 2006. — 13 July (vol. 442, no. 7099). — P. 159—163. — doi:10.1038/nature04894. — . — PMID 16838013.
- Butterfield N. J. An Early Cambrian Radula (англ.) // Journal of Paleontology. — Paleontological Society, 2008. — May (vol. 82, no. 3). — P. 543—554. — doi:10.1666/07-066.1.
- P. Yu. Parkhaev. The Cambrian 'basement' of gastropod evolution // Geological Society, London, Special Publications. — 2007. — Т. 286. — С. 415—421. — ISBN 978-1-86239-233-5. — doi:10.1144/SP286.31. — .
- Michael Steiner, Guoxiang Li, Yi Qian, Maoyan Zhu and Bernd-Dietrich Erdtmann. Neoproterozoic to early Cambrian small shelly fossil assemblages and a revised biostratigraphic correlation of the Yangtze Platform (China) (англ.) // Palaeogeography, Palaeoclimatology, Palaeoecology : journal. — 2007. — Vol. 254. — P. 67—99. — doi:10.1016/j.palaeo.2007.03.046.
- Mus, M. M.; Palacios, T.; Jensen, S. Size of the earliest mollusks: Did small helcionellids grow to become large adults? (англ.) // Geology : journal. — 2008. — Vol. 36, no. 2. — P. 175. — doi:10.1130/G24218A.1.
- Landing E., Geyer G., Bartowski K. E. Latest Early Cambrian Small Shelly Fossils, Trilobites, and Hatch Hill Dysaerobic Interval on the Quebec Continental Slope (англ.) // Journal of Paleontology : journal. — Paleontological Society, 2002. — Vol. 76, no. 2. — P. 287—305. — doi:10.1666/0022-3360(2002)076<0287:LECSSF>2.0.CO;2.
- Frýda, J.; Nützel A. and Wagner P. J. Paleozoic Gastropoda // Phylogeny and evolution of the Mollusca / W. F. Ponder, D. R. Lindberg. — California Press, 2008. — С. 239—264. — ISBN 0-520-25092-3.
- Kouchinsky, A. Shell microstructures in Early Cambrian molluscs // Acta Palaeontologica Polonica. — Polish Academy of Sciences, 2000. — Т. 45, № 2. — С. 119—150.
- Hagadorn J. W., Waggoner B. M. Proterozoic-Cambrian of the Great Basin and Beyond, Pacific Section SEPM Book 93 (англ.) / F. A. Corsetti. — SEPM (Society for Sedimentary Geology), 2002. — P. 135—150. Архивированная копия (недоступная ссылка). Дата обращения: 10 июля 2013. Архивировано 1 октября 2008 года.
- Vickers-Rich P., Fenton C. L., Fenton M. A. and Rich T. H. The Fossil Book: A Record of Prehistoric Life (англ.). — Courier Dover Publications, 1997. — P. 269—272. — ISBN 0-486-29371-8.
- Marshall C. R. and Ward P. D. Sudden and Gradual Molluscan Extinctions in the Latest Cretaceous of Western European Tethys (англ.) // Science : journal. — 1996. — Vol. 274, no. 5291. — P. 1360—1363. — doi:10.1126/science.274.5291.1360. — . — PMID 8910273.
- Pojeta J. Cambrian Pelecypoda (Mollusca) // American Malacological Bulletin. — 2000. — Т. 15. — С. 157—166.
- Schneider J. A. Bivalve systematics during the 20th century (англ.) // Journal of Paleontology. — Paleontological Society, 2001. — November (vol. 75, no. 6). — P. 1119—1127. — doi:10.1666/0022-3360(2001)075<1119:BSDTC>2.0.CO;2.
- Gubanov A. P., Kouchinsky A. V. and Peel J. S. The first evolutionary-adaptive lineage within fossil molluscs (англ.) // Lethaia : journal. — 2007. — Vol. 32, no. 2. — P. 155—157. — doi:10.1111/j.1502-3931.1999.tb00534.x.
- Gubanov A. P. and Peel J. S. The early Cambrian helcionelloid mollusc Anabarella Vostokova // Palaeontology. — 2003. — Т. 46, № 5. — С. 1073—1087. — doi:10.1111/1475-4983.00334.
- Zong-Jie F. An introduction to Ordovician bivalves of southern China, with a discussion of the early evolution of the Bivalvia (англ.) // Geological Journal : journal. — 2006. — Vol. 41, no. 3—4. — P. 303—328. — doi:10.1002/gj.1048.
- Malinky J. M. Permian Hyolithida from Australia: The Last of the Hyoliths? (англ.) // Journal of Paleontology : journal. — Paleontological Society, 2009. — Vol. 83, no. 1. — P. 147—152.
- Moysiuk J., Smith M. R., Caron J.-B. Hyoliths are palaeozoic lophophorates (англ.) // Nature. — 2017. — Vol. 541. — P. 394—397. — doi:10.1038/nature20804.
- Rawat, 2010, p. 11.
- Caron J. B.; Scheltema A., Schander C. and Rudkin D. A soft-bodied mollusc with radula from the Middle Cambrian Burgess Shale (англ.) // Nature : journal. — 2006. — 13 July (vol. 442, no. 7099). — P. 159—163. — doi:10.1038/nature04894. — . — PMID 16838013.
- Butterfield N. J. An Early Cambrian Radula (англ.) // Journal of Paleontology. — Paleontological Society, 2008. — May (vol. 82, no. 3). — P. 543—554. — doi:10.1666/07-066.1.
- Julia D. Sigwart, Mark D. Sutton. Deep molluscan phylogeny: synthesis of palaeontological and neontological data // Proc Biol Sci. — 2007. — Vol. 1624, № 274. — P. 2413—2419. — doi:10.1098/rspb.2007.0701.
- Goloboff, Pablo A.; Catalano, Santiago A.; Mirande, J. Marcos; Szumik, Claudia A.; Arias, J. Salvador; Källersjö, Mari; Farris, James S. Phylogenetic analysis of 73 060 taxa corroborates major eukaryotic groups (англ.) // Cladistics. — Wiley-Blackwell, 2009. — Vol. 25, no. 3. — P. 211—230. — doi:10.1111/j.1096-0031.2009.00255.x.
- The Mollusca. University of California Museum of Paleontology. Дата обращения: 2 октября 2008. Архивировано 15 декабря 2012 года.
- Introduction to the Lophotrochozoa. University of California Museum of Paleontology. Дата обращения: 2 октября 2008. Архивировано 13 августа 2013 года.
- Henry, J.; Okusu, A.; Martindale, M. The cell lineage of the polyplacophoran, Chaetopleura apiculata: variation in the spiralian program and implications for molluscan evolution // Developmental biology. — 2004. — Vol. 272, № 1. — P. 145—160. — doi:10.1016/j.ydbio.2004.04.027. — PMID 15242797.
- Jacobs D. K.; Wray C. G.; Wedeen C. J.; Kostriken R.; Desalle R.; Staton J. L.; Gates R. D.; Lindberg D. R. Molluscan engrailed expression, serial organization, and shell evolution // Evolution & Development. — 2000. — Vol. 6, № 2. — P. 340—347. — doi:10.1046/j.1525-142x.2000.00077.x. — PMID 11256378.
- Giribet G., Okusu A., Lindgren A. R., Huff S. W., Schrödl M. and Nishiguchi M. K. Evidence for a clade composed of molluscs with serially repeated structures: Monoplacophorans are related to chitons (англ.) // Proceedings of the National Academy of Sciences : journal. — United States National Academy of Sciences, 2006. — May (vol. 103, no. 20). — P. 7723—7728. — doi:10.1073/pnas.0602578103. — . — PMID 16675549.
- Porter S. M. Seawater chemistry and early carbonate biomineralization (англ.) // Science. — 2007. — Vol. 5829, no. 316. — P. 1301—1302. — ISSN 0036-8075. — doi:10.1126/science.1137284. — . — PMID 17540895.
- Winnepenninckx, B; Backeljau, T; De Wachter, R. Investigation of molluscan phylogeny on the basis of 18S rRNA sequences (англ.) // Molecular Biology and Evolution : journal. — Oxford University Press, 1996. — 1 December (vol. 13, no. 10). — P. 1306—1317. — doi:10.1093/oxfordjournals.molbev.a025577. — PMID 8952075.
- Passamaneck, Y.; Schander, C.; Halanych, K. Investigation of molluscan phylogeny using large-subunit and small-subunit nuclear rRNA sequences // Molecular Phylogenetics & Evolution. — 2004. — Vol. 32, № 1. — P. 25—38. — doi:10.1016/j.ympev.2003.12.016. — PMID 15186794.
- Wilson N.; Rouse G.; Giribet G. Assessing the molluscan hypothesis Serialia (Monoplacophora+Polyplacophora) using novel molecular data // Molecular Phylogenetics & Evolution. — 2010. — Vol. 54, № 1. — P. 187—193. — doi:10.1016/j.ympev.2009.07.028. — PMID 19647088.
- Wägele J.; Letsch H.; Klussmann-Kolb A.; Mayer C.; Misof B.; Wägele H. Phylogenetic support values are not necessarily informative: the case of the Serialia hypothesis (a mollusk phylogeny) // Front Zool. — 2009. — Vol. 12, № 6. — doi:10.1186/1742-9994-6-12.
- Vinther J.; Sperling E. A.; Briggs D. E. G.; Peterson K. J. A molecular palaeobiological hypothesis for the origin of aplacophoran molluscs and their derivation from chiton-like ancestors // Proceedings of the Royal Society B: Biological Sciences. — 2012. — Vol. 279, № 1732. — P. 1259—1268. — doi:10.1098/rspb.2011.1773.
- Achatinella mustelina (англ.). The IUCN Red List of Threatened Species.
- IUCN Red List of Threatened Species. Version 2013.1. IUCN. Дата обращения: 15 августа 2013. Архивировано 16 августа 2013 года.
- Красная книга России: моллюски. Дата обращения: 19 августа 2013.
- The Conservation Biology of Molluscs // E. Alison Kay. — International Union for Conservation of Nature and Natural Resources, 1995. — ISBN 2-8317-0053-1.
- Mannino M. A. and Thomas K. D. Depletion of a resource? The impact of prehistoric human foraging on intertidal mollusc communities and its significance for human settlement, mobility and dispersal (англ.) // World Archaeology : journal. — 2002. — February (vol. 33, no. 3). — P. 452—474. — doi:10.1080/00438240120107477.
- Garrow J. S., Ralph A. and James W. P. T. Human Nutrition and Dietetics. — Elsevier Health Sciences, 2000. — С. 370. — ISBN 0-443-05627-7.
- FAO 2010: Fishery and Aquaculture Statistics.
- Importing fishery products or bivalve molluscs. United Kingdom: Food Standards Agency. Дата обращения: 2 октября 2008. Архивировано 19 ноября 2012 года.
- Шарова, 2002, с. 301.
- Шарова, 2002, с. 317.
- Tewfik A. (1991). «An assessment of the biological characteristics, abundance, and potential yield of the queen conch (Strombus gigas L.) fishery on the Pedro Bank off Jamaica». Thesis submitted in partial fulfilment of the requirements for the Degree of Masters of Science (Biology). Acadia University, Canada.
- Шарова, 2002, с. 334.
- Ruppert, Fox, Barnes, 2004, pp. 367—403.
- Jones J. B. and Creeper J. Diseases of Pearl Oysters and Other Molluscs: a Western Australian Perspective (англ.) // Journal of Shellfish Research : journal. — 2006. — April (vol. 25, no. 1). — P. 233—238. — doi:10.2983/0730-8000(2006)25[233:DOPOAO]2.0.CO;2.
- Раковина / Иванов А. В. // Проба — Ременсы. — М. : Советская энциклопедия, 1975. — С. 447. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 21).
- Gulick C. B. Athenaeus, The Deipnosophists. — Cambridge, Mass.: Harvard University Press, 1941. — ISBN 0-674-99380-2.
- Reese D. S. Palaikastro Shells and Bronze Age Purple-Dye Production in the Mediterranean Basin (англ.) // Annual of the British School of Archaeology at Athens : journal. — 1987. — Vol. 82. — P. 201—206.
- Stieglitz R. R. The Minoan Origin of Tyrian Purple (англ.) // Near Eastern Archaeology. — Biblical Archaeologist, 1994. — Vol. 57, no. 1. — P. 46—54. — doi:10.2307/3210395. — .
- I. Irving Ziderman. 3600 Years of Purple-Shell Dyeing: Characterization of Hyacinthine Purple (Tekhelet), Advances in Chemistry, Vol. 212
- Webster’s Third New International Dictionary (Unabridged) 1976. G. & C. Merriam Co., p. 307.
- Turner R. D. and Rosewater J. The Family Pinnidae in the Western Atlantic (англ.) // Johnsonia. — Museum of Comparative Zoology, 1958. — June (vol. 3, no. 38). — P. 294.
- Hogendorn J. and Johnson M. The Shell Money of the Slave Trade. — Cambridge University Press, 2003. — ISBN 052154110.
- Maurer B. The Anthropology of Money // Annual Review of Anthropology. — Annual Reviews, 2006. — Октябрь (т. 35). — С. 15—36. — doi:10.1146/annurev.anthro.35.081705.123127.
- И. С. Краснов. Гигантские улитки-ахатины. Опыт успешного содержания и разведения в домашних условиях. — 2007. — 48 с. — ISBN 5-98435-484-5.
- Золотницкий Н. Ф. Аквариум любителя. — М.: ТЕРРА, 1993. — С. 570.
- Вершинина Т. А. Беспозвоночные в аквариуме. Обзор видов. Жизнь в природе. Содержание в аквариуме. — 2008. — ISBN 978-5-9934-0170-6.
- Nick Dakin. The Book of the Marine Aquarium. — Tetra Press (January 1993), 1992. — 400 p. — ISBN 1564651029.
- Concar, D. Doctor snail—Lethal to fish and sometimes even humans, cone snail venom contains a pharmacopoeia of precision drugs (англ.) // New Scientist : journal. — 1996. — 19 October.
- Haddad V. (junior), de Paula Neto J. B. and Cobo V. J. Venomous mollusks: the risks of human accidents by Conus snails (Gastropoda: Conidae) in Brazil (англ.) // Revista da Sociedade Brasileira de Medicina Tropical : journal. — Vol. 39, no. 5. — P. 498—500. — doi:10.1590/S0037-86822006000500015.
- Michael MacRae. [https://www.asme.org/engineering-topics/articles/bioengineering/engineering-drugs-from-marine-mollusks Engineering Drugs from Marine Mollusks] (англ.) // ASME.org.
- Rawat, 2010, p. 11—12.
- Наталья Московская. Раковины мира. История, коллекционирование, искусство. — Аквариум-Принт, Харвест, 2007. — 256 с.
- Barker G. M. Molluscs As Crop Pests. — CABI Publications, 2002. — ISBN 0-85199-320-6.
- Civeyrel L. and Simberloff D. A tale of two snails: is the cure worse than the disease? (англ.) // Biodiversity and Conservation : journal. — 1996. — October (vol. 5, no. 10). — P. 1231—1252. — doi:10.1007/BF00051574.
- Benson, Amy. New Zealand Mudsnail Potamopyrgus antipodarum. Southeast Ecological Science Center, U.S. Geological Survey. Дата обращения: 18 ноября 2011. Архивировано 27 декабря 2011 года.
- Levri E. P.; Kelly A. A.; Love E. The invasive New Zealand mud snail (Potamopyrgus antipodarum) in Lake Erie // Journal of Great Lakes Research. — 2007. — Vol. 33, № 1. — P. 1—6.
- Great Smoky Mountains National Park — Biological threats (англ.). Служба национальных парков США. Дата обращения: 18 ноября 2011. Архивировано 27 декабря 2011 года.
- Моллюски // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Карпов Н. Корабельный червь. Земля и люди (январь — март 2009). Дата обращения: 22 августа 2013.
- Шарова, 2002, с. 319.
- Alafaci A. Blue ringed octopus. Australian Venom Research Unit. Дата обращения: 3 октября 2008. Архивировано 28 ноября 2012 года.
- Anderson, R. C. Aquarium husbandry of the giant Pacific octopus // Drum and Croaker. — 1995. — Т. 26. — С. 14—23.
- Williamson J. A., Fenner P. J., Burnett J. W. and Rifkin J. Venomous and Poisonous Marine Animals: A Medical and Biological Handbook (англ.). — UNSW Press, 1996. — P. 65—68. — ISBN 0-86840-279-6.
- Brazzelli V., Baldini F., Nolli G., Borghini F. and Borroni G. Octopus apollyon bite // Contact Dermatitis. — 1999. — Т. 40, № 3. — С. 169—170. — doi:10.1111/j.1600-0536.1999.tb06025.x. — PMID 10073455.
- Anderson R. C. An octopus bite and its treatment (англ.) // The Festivus. — San Diego Shell Club, 1999. — Vol. 31. — P. 45—46.
- Livett B. Cone Shell Mollusc Poisoning, with Report of a Fatal Case (недоступная ссылка). Department of Biochemistry and Molecular Biology, University of Melbourne. Дата обращения: 3 октября 2008. Архивировано 1 декабря 2012 года.
- Wekell, John C.; Hurst, John; Lefebvre, Kathi A. The origin of the regulatory limits for PSP and ASP toxins in shellfish (англ.) // Journal of Shellfish Research : journal. — 2004. — Vol. 23, no. 3. — P. 927—930. (недоступная ссылка)
- J. L. MACLEAN. Paralytic Shellfish Poison in Various Bivalves, Port Moresby, 1973 // Pacific Science. — 1975. — Vol. 29, № 4. — P. 349—352.
- Brown D. S. Freshwater Snails of Africa and Their Medical Importance (англ.). — CRC Press, 1994. — P. 305. — ISBN 0-7484-0026-5.
- Пименова, Пименов, 2005, с. 126.
- Sergey M. Govorushko. Natural Processes and Human Impacts: Interactions between Humanity and the Environment. — Springer, 2012. — P. 294. — 678 p. — ISBN 978-94-007-1423-6.
- Кракен. — Три заметки из «Санктпетербургского вестника» за 1779 год. ч. 3. январь. с. 137—140. Дата обращения: 22 августа 2013. Архивировано 24 августа 2013 года.
- Off-line интервью Бориса Стругацкого от 02/07/2010 (lit.absint) : Рассылка : Subscribe.Ru
- Snails in Popular Culture (англ.) (недоступная ссылка). Infoqis Publishing, Co. Дата обращения: 25 августа 2013. Архивировано 26 октября 2013 года.
- Трофимов, Д. Пространственные образы рассказа «Kew gardens» Вирджинии Вульф (недоступная ссылка). Сайт Натальи Пахсарьян. Дата обращения: 25 августа 2013. Архивировано 26 сентября 2013 года.
- Улитка. Мифология. Дата обращения: 25 августа 2013.
- de Vries, Ad. Dictionary of Symbols and Imagery. — Amsterdam: North-Holland Publishing Company, 1976. — С. 430. — ISBN 0-7204-8021-3.
- Мифология — Морская раковина: греческая мифология
Литература
На русском языке
- Шарова И. Х. Зоология беспозвоночных. — М.: Владос, 2002. — 592 с. — ISBN 5-691-00332-1.
- Догель В. А. Зоология беспозвоночных. — 7-е изд. — М.: Высшая школа, 1981. — 614 с.
- Пименова И. Н., Пименов А. В. Зоология беспозвоночных. Теория. Задания. Ответы. — Саратов: Лицей, 2005. — 288 с. — ISBN 5-8053-0308-6.
- Жадин В. И. Моллюски пресных и солоноватых вод СССР. — М.-Л.: Изд-во АН СССР, 1952. — 376 с.
- Кантор Ю. И., Сысоев А. В. Каталог моллюсков России и сопредельных стран. — М.: Товарищество науч. изд. КМК, 2005. — 627 с.
- Скарлато О. А. Двустворчатые моллюски умеренных вод северо-западной части Тихого океана. — Л.: Наука, 1981. — 480 с.
- Малахов В. В., Медведева Л. А. Эмбриональное развитие двустворчатых моллюсков. — М.: Наука, 1991. — 136 с.
- Наталья Московская. Раковины мира. История, коллекционирование, искусство. — М.: Аквариум-Принт, Харвест, 2007. — 256 с.
На английском языке
- Salvini-Plawen L. V. & G. Steiner. Synapomorphies and symplesiomorphies in higher classification of Mollusca. Origin and evolutionary radiation of Mollusca. — J. Taylor ed., Oxford Univ. Press, 1996. — P. 29—51.
- Rawat R. Anathomy of mollusca. — 1. — New Delhi, India: International scientific publishing academy, 2010. — 260 p. — ISBN 9788182930285.
- Ruppert E. E., Fox R. S., Barnes R. D. Invertebrate Zoology. — 7. — Brooks / Cole, 2004. — ISBN 0-03-025982-7.
- Saxena A. Text Book Of Mollusca. — 1. — New Delhi, India: Discovery Publishing House, 2005. — 528 p. — ISBN 9788183560177.
- The comparative roles of suspension-feeders in ecosystems / R. Dame, S. Olenin. — Dordrecht: Springer, 2005. — 360 p.
- Winston. F. Ponder, David R. Lindberg. Phylogeny and Evolution of the Mollusca. — USA: University of California Press, 2008. — 469 p. — ISBN 9780520250925.
Ссылки
- Фотокаталог по семействам моллюскам (англ.)
- Тип Моллюски (англ.) в Мировом реестре морских видов (World Register of Marine Species).



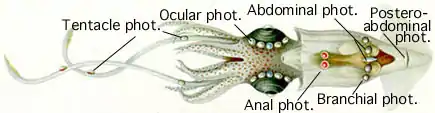
.jpg.webp)