Сиаловые кислоты
Сиаловые кислоты (от др.-греч. σίαλον «слюна») — общее название N- и O-замещённых производных нейраминовой кислоты, моносахарида с девятиатомной углеродной цепью. Наиболее распространённого представителя этого класса — N-ацетилнейраминовую кислоту (НАНК, Neu5Ac) — также часто называют сиаловой кислотой. Широко распространены в тканях животных, однако встречаются также у растений, грибов и бактерий. Впервые были обнаружены в 1930-е годы Гуннаром Бликсом, Эрнстом Кленком и другими в качестве преобладающих продуктов мягкого кислотного гидролиза гликолипидов мозга и муцинов слюны, от чего и получили своё название[1]. К 1980-м годам были идентифицированы более 30 различных производных НАНК. Другой ряд сиаловых кислот включает в себя метаболиты 2-кето-3-деоксинононовой кислоты (Kdn); с их учётом общее число сиаловых кислот достигает 50[1].
Структура
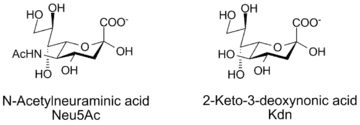
Из-за влияния карбоксильной группы на кетозидную связь сиаловые кислоты неустойчивы, эта связь легко подвергается гидролитическому расщеплению.
Нумерация структуры сиаловой кислоты начинается с карбоксильного атома углерода. Конфигурация, в которой карбоксилат-анион находится в аксиальном положении, является α-аномером.
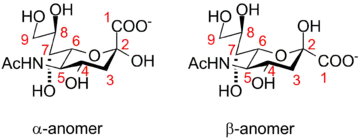
В растворе сиаловая кислота преимущественно находится в β-форме (более 90 %), а в состав гликанов входит α-аномер.
Разнообразие сиаловых кислот определяется, во-первых, природой и позицией замещения углевода, к которому гликозидной связью присоединён фрагмент сиаловой кислоты, а во-вторых, характером модификации заместителей при атомах углерода C-1, C-4, C-5, C-7, C-8 и C-9. Гликозидные связи создаются ферментами сиалилтрансферазами, чаще всего с позициями C-3 и C-6 остатков галактозы и C-6 N-ацетилгалактозамина[1].
Варьирование заместителей при атоме C-5 определяет строение четырёх ключевых сиаловых кислот: Neu5Ac (N-ацетил), Kdn (гидроксил), N-гликолилнейраминовой кислоты (Neu5Gc), N-(гидроксиацетил)), а также нейраминовой кислоты (Neu, аминогруппа). Карбоксильная группа при C-1 обычно депротонирована, однако может образовывать лактоны с соседними сахаридами, а также лактамы в случае Neu. Среди заместителей при остальных атомах углерода обычно встречаются O-метил, O-ацетил, O-сульфат, O-лактил, а также фосфатная группа. Встречаются также ненасыщенные и дегидрированные производные сиаловых кислот, наиболее распространённое среди которых — Neu2en5Ac (2-деокси-2,3-дидегидро-НАНК)[1].
Полимерные и олигомерные формы сиаловых кислот встречаются в гликопротеинах животных (в частности, в клетках мозга и рыбьей икры), характерны для некоторых патогенных бактерий[1]. Концентрация полисиаловых кислот в мозге значительно снижается при постнатальном развитии; повышение концентрации сопряжено с нейропластичностью[1].
Физико-химические свойства
Сиаловые кислоты — бесцветные кристаллические вещества, хорошо растворимые в воде, слабо растворимые в растворах спирта и эфира и нерастворимые в неполярных органических растворителях. Имеют низкие температуры плавления. При нагревании выше 130—160° C большинство сиаловых кислот разлагаются. Весьма неустойчивы: при хранении водных растворов наблюдается их распад. Разлагаются под действием минеральных и некоторых органических кислот, а также при взаимодействии с основаниями[2]. По своей природе сиаловые кислоты являются полифункциональными соединениями с ярко выраженной кислотностью (pKa = 2,6), образуют метиловые эфиры.
Специфические реакции
Сиаловые кислоты имеют ряд специфических реакций:
- прямая реакция Эрлиха;
- реакция Уоррена с тиобарбитуровой кислотой.
Первая реакция широко применяется при исследовании гликопротеинов, так как другие компоненты этих биополимеров в этих условиях не дают окрашенных соединений. Данная реакция основана на превращении сиаловых кислот в производные пиррола, которые дают окрашивание при взаимодействии 4-диметиламинобензальдегидом.
Вторая основана на образовании формилпировиноградной кислоты, которая даёт цветную реакцию при взаимодействии с тиобарбитуровой кислотой.
Методы обнаружения
Для идентификации сиаловых кислот применяется хроматография на бумаге, в тонком слое силикагеля, электрофорез на бумаге.
Распространение
Сиаловые кислоты широко распространены в природе. Встречаются в составе гликокаликса животной клетки (в том числе человека), клеточных оболочках бактерий, клеточных стенках растений, являются структурными компонентами гликопротеинов и гликолипопротеинов, входят в состав структурных компонентов олигосахаридов женского молока, простетической группы мукопротеина подчелюстной железы, ганглиозидов мозга, участвующих в проведении нервных импульсов, часто встречаются в составе спинномозговой жидкости (в свободном состоянии), секретов слюнных желез, слизей, в мембранах митохондрий, микросом[3].
Биосинтез
В бактериальных системах сиаловые кислоты синтезируются с помощью фермента альдолазы. Фермент в качестве субстрата использует производное маннозы, вставляя три атома углерода от молекулы пирувата в полученную структуру сиаловой кислоты. Альдолазы могут использоваться также для химико-ферментативного синтеза производных сиаловой кислоты[4].
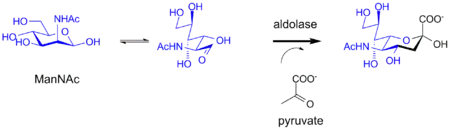
Функции
Сиаловые кислоты представляют собой важный строительный блок гликанов и гликолипидов. Их типичное расположение — на концах N-гликанов, O-гликанов и ганглиозидов, но они также могут быть промежуточными звеньями полисахаридов (преимущественно бактериальных), а также формировать олиго- и полисиаловые кислоты[1]. Наличие сиаловых кислот на концах олигосахаридных цепей животных гликопротеинов обеспечивает возможность циркуляции последних в кровотоке, предотвращая захват их клетками печени. Входя в состав биополимеров животных клеток, сиаловые кислоты во многом определяют свойства клеточной поверхности. Находясь на невосстанавливающем конце олигосахаридных цепей гликолипидов и гликопротеинов, сиаловые кислоты маскируют антигенные детерминанты биополимера[5].
Сиаловые кислоты связывают селектин в организме человека и других организмах.
Играют значительную роль в патологических процессах: воспаления, иммунного ответа, канцерогенеза (некоторые из сиаловых кислот, например, N-ацетилнейраминовая кислота участвует в проникновении метастазов в кровеносные сосуды[6]), проникновения вирусов, бактерий и грибков в организм человека итд.
Метастатические клетки рака часто имеют высокую экспрессию сиаловой кислоты, которой богаты гликопротеины. Именно избыточная экспрессия сиаловой кислоты на поверхности создает отрицательный заряд, действующий на клеточные мембраны. Это создает отталкивание между здоровыми клетками (образуя, так называемые клетки оппозиции)[6] и помогает метастазам на поздних стадиях рака попадать в кровеносные сосуды.
В 1940-е годы было обнаружено, что сиаловая кислота является клеточным рецептором вирусов гриппа и разрушается под действием фермента, впоследствии названного нейраминидазой[1]. Широко используемые лекарственные средства против гриппа (осельтамивир и занамивир) являются аналогами сиаловой кислоты и мешают проникновению вируса в клетку путём ингибирования нейраминидазы.
Регионы, богатые сиаловыми кислотами, создают отрицательный заряд на поверхности клеток. Поскольку вода является полярной молекулой с частичным положительным зарядом на обоих атомах водорода, она притягивается к поверхности клеток и мембран. Это также способствует поглощению жидкости клетками.
Патология обмена сиаловых кислот
Патология обмена включает группу наследственных заболеваний — сиалидозов. Сиалидоз I типа или муколипидоз — наследственное (аутосомно-рецессивное) заболевание, вызванное накоплением сиаловых кислот в кровотоке, вследствие дефицита лизосомного фермента — нейраминидазы (сиалидазы)[7], который способствует выведению сиаловых кислот из организма.
См. также
- Сиалидоз
- Сиалогликопротеины
- Ортомиксовирусы
Примечания
- Varki, A. Chapter 14. Sialic Acids // Essentials of Glycobiology : [англ.] / A. Varki, R. Schauer. — 2nd Edition. — Cold Spring Harbor (NY) : Cold Spring Harbor Laboratory Press. — 784 p. — ISBN 978-087969770-9. — PMID 20301246.
- Кочетков Н.К. Химия углеводов. — М.: Химия, 1967. — 674 с.
- Сиаловая кислота
- Hai Yu, Harshal Chokhawala, Shengshu Huang, Xi Chen. One-pot three-enzyme chemoenzymatic approach to the synthesis of sialosides containing natural and non-natural functionalities // Nature Protocols. — 2006. — Vol. 1. — P. 2485—2492. — doi:10.1038/nprot.2006.401. — PMID 17406495.
- Овчинников Ю.А. Биоорганическая химия. — М.: Просвещение, 1987. — 815 с.
- Mark M. Fuster, Jeffrey D. Esko. The sweet and sour of cancer: Glycans as novel therapeutic targets // Nature Reviews Cancer. — 2005. — Vol. 5. — P. 526—542. — doi:10.1038/nrc1649. — PMID 16069816.
- James, William D.; Berger, Timothy G.; et al. Andrews' Diseases of the Skin: clinical Dermatology (англ.). — Saunders Elsevier, 2006. — P. 538. — ISBN 0-7216-2921-0. (англ.)
