Ртуть
Ртуть (Hg, от лат. Hydrargyrum) — элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка, 12-й группе (по устаревшей классификации — побочной подгруппе II группы). Простое вещество ртуть — переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты, контаминант. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром).
| Ртуть | ||||
|---|---|---|---|---|
| ← Золото | Таллий → | ||||
| ||||
| Внешний вид простого вещества | ||||
| Тяжёлый жидкий металл серебристо-белого цвета | ||||
 Жидкая ртуть в ампуле |
||||
| Свойства атома | ||||
| Название, символ, номер | Ртуть / Hydrargyrum (Hg), 80 | |||
| Атомная масса (молярная масса) |
200,592(3)[1] а. е. м. (г/моль) | |||
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 | |||
| Радиус атома | 157 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 149 пм | |||
| Радиус иона | (+2e) 110 (+1e) 127 пм | |||
| Электроотрицательность | 2,00 (шкала Полинга) | |||
| Электродный потенциал | Hg←Hg2+ 0,854 В | |||
| Степени окисления | +2, +1 | |||
| Энергия ионизации (первый электрон) |
1 006,0 (10,43) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | 13,546 (20 °C) г/см³ | |||
| Температура плавления | 234,32 K (-38,83 °C)[2] | |||
| Температура кипения | 629,88 K (356,73 °C)[2] | |||
| Уд. теплота плавления | 2,295 кДж/моль | |||
| Уд. теплота испарения | 58,5 кДж/моль | |||
| Молярная теплоёмкость | 27,98[3] Дж/(K·моль) | |||
| Молярный объём | 14,81 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки | ромбоэдрическая | |||
| Параметры решётки | ahex=3,464 сhex=6,708 Å | |||
| Отношение c/a | 1,94 | |||
| Температура Дебая | 100,00 K | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 8,3 Вт/(м·К) | |||
| Номер CAS | 7439-97-6 | |||
| Эмиссионный спектр | ||||
|
|
||||
| 80 | Ртуть |
| 4f145d106s2 | |
История
Ртуть — один из семи металлов, известных с древнейших времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом ее основного минерала — киновари. Киноварная краска применялась на территории современной Турции с 8 тыс. до н. э., киноварные месторождения юго-восточных провинций современного Китая разрабатывались с 4 тыс. до н. В древнем Египте киноварь и металлическую ртуть использовали с 3-го тысячелетия до н. э., в древней Индии — с 1-2 тысячелетий до н. э. В Египте был найден сосуд с ртутью, датированный XV—XVI вв. до н. э. В Египте, Месопотамии и Китае был известен способ получения ртути из киновари при помощи меди и уксуса. В VII в. до н. э. ассирийские ремесленники применяли ртуть для золочения металлических поверхностей (амальгамирование). Aмальгамирование было известно древним грекам и римлянам, они знали и о токсичности самой ртути и её соединений, в частности сулемы. Ртуть и киноварь упоминаются в «Естественной истории» Плиния Старшего.[4][5][6]
Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Твердая ртуть впервые была получена российскими учеными Ломоносовым и Брауном, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.; было показано, что ртуть и в жидком, и в твердом состоянии проводит электрический ток[7].
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями[9].
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg6Cl4O[10] (по другим данным Hg6OCl3(OH)[11], Hg6HCl3O2[12]).
Месторождения
Ртуть считается редким металлом.[13]
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде

До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Природная ртуть состоит из смеси 7 стабильных изотопов: 196Hg (распространённость 0,155 %), 198Hg (10,04 %), 199Hg (16,94 %), 200Hg (23,14 %), 201Hg (13,17 %), 202Hg (29,74 %), 204Hg (6,82 %)[14]. Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210[15]. Из них наиболее устойчива ртуть-194 (период полураспада 444 года).
Прочие радиоактивные изотопы имеют период полураспада менее года.
Получение
Ртуть получают обжигом киновари (сульфида ртути(II)) или металлотермическим методом:
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества[16].
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски[17].
Физические свойства


Электронная оболочка атома ртути обладает заполненными электронными подуровнями, последние из которых — 4f14 5d10 6s2. Главное отличие ртути от двух других металлов с аналогичной структурой электронного облака, цинка (3d 4s) и кадмия (4d 5s) — заполненность f-подуровня, находящегося по энергии ниже 6s-подуровня. Орбитали f-электронов имеют сложную форму и большой размер, они плохо экранируют заряд ядра. Поэтому удерживающие силы, действующие на 6s-электроны, относительно велики, и 6s-подуровень намного более стабилен, чем у любых других металлов. Этим обусловлены уникальные физические и химические свойства ртути. Так, ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления составляет 234,32 K (−38,83 °C)[2], кипит при 629,88 K (356,73 °C)[2], критическая точка — 1750 K (1477 °C), 152 МПа (1500 атм). Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы — амальгамы. Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W, Co[3].
Плотность ртути при нормальных условиях — 13 596 кг/м³[18].
| t, °С | ρ, г/см³ (10³ кг/м³) | t, °С | ρ, г/см³ (10³ кг/м³) |
|---|---|---|---|
| 0 | 13,5950 | 50 | 13,4725 |
| 5 | 13,5827 | 55 | 13,4601 |
| 10 | 13,5704 | 60 | 13,4480 |
| 15 | 13,5580 | 65 | 13,4358 |
| 20 | 13,5457 | 70 | 13,4237 |
| 25 | 13,5335 | 75 | 13,4116 |
| 30 | 13,5212 | 80 | 13,3995 |
| 35 | 13,5090 | 90 | 13,3753 |
| 40 | 13,4967 | 100 | 13,3514 |
| 45 | 13,4845 | 300 | 12,875 |
| t, °C | P, мм рт. ст. | t, °C | P, мм рт. ст. | t, °C | P, мм рт. ст. | t, °C | P, мм рт. ст. |
|---|---|---|---|---|---|---|---|
| −89 | 10−10 | −42 | 10−6 | 46 | 10−2 | 254 | 100 |
| −79 | 10−9 | −25 | 10−5 | 82 | 10−1 | 357 | 760 |
| −68 | 10−8 | −6 | 10−4 | 125 | 1,0 | ||
| −55 | 10−7 | 17 | 10−3 | 202 | 10 |
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +1 | Hg2O | <Hg2(OH)2>
|
Слабоосновный | Склонность к диспропорционированию; Гидроксид не получен, существуют только соответствующие соли. |
| +2 | HgO | <Hg(OH)2> | Очень слабое основание, иногда — амфотерный | Гидроксид существует только в очень разбавленных (<10−4моль/л) растворах. |
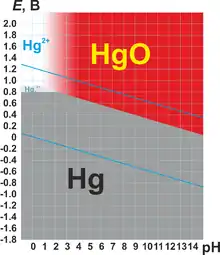
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ с ковалентной связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. При нагревании, подщелачивании среды общая электронная пара остается у одного атома — происходит диспропорционирование:
подщелачивании:
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, конпропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется:
В очень концентрированной щёлочи оксид ртути частично растворяется с образованием гидроксокомплекса:
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов группы 12 именно у ртути появляется возможность разрушения очень устойчивой 6d10 — электронной оболочки, что приводит к возможности существования соединений ртути(IV), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, сообщалось, что при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4[22][23]. Однако более новые исследования не подтвердили его существование[24].
Свойства металлической ртути
Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке[25]:
- При растворении избытка ртути в азотной кислоте на холоде образуется нитрат диртути Hg2(NO3)2.
- при растворении в горячей и концентрированной азотной кислоте образуется нитрат ртути
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути(II):
Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия:
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
.jpg.webp)
Применение ртути и её соединений
В медицине
В связи с высокой токсичностью ртуть почти полностью вытеснена из медицинских препаратов. Её соединения (в частности, мертиолят) иногда используются в малых количествах как консервант для вакцин[26]. Сама ртуть сохраняется в ртутных медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до 1960-х годов соединения ртути использовались в медицине очень активно[27]:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — ртутные диуретики;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей);
- Чёрная ртутная мазь — взвесь металлической ртути в мазевой основе, широко использовалась до появления препаратов висмута и антибиотиков при лечении сифилиса и для дезинсекции при вшивости.
При завороте кишок больному вливали в желудок стакан ртути. По мнению древних врачевателей, предлагавших такой метод лечения, ртуть благодаря своей тяжести и подвижности должна была пройти по кишечнику и под своим весом расправить его перекрутившиеся части[17].

Препараты ртути применяли с XVI в. (в СССР - вплоть до 1963 года, в США — до конца 70-х годов ХХ века) для лечения сифилиса. Это было обусловлено тем, что бледная трепонема, вызывающая сифилис, обладает высокой чувствительностью к органическим и неорганическим соединениям, блокирующим сульфгидрильные группы тиоловых ферментов — соединениям ртути, мышьяка, висмута и йода. Однако такое лечение было недостаточно эффективно и весьма токсично для организма больного, приводя к полному выпадению волос и высокому риску развития серьезных осложнений; причём возможности повышения дозы препаратов ртути или мышьяка при недостаточной противосифилитической активности стандартных доз ограничивались именно токсичностью для организма больного[28]. Также применялись методики общей меркуризации организма, при которой больной помещался в нагревающуюся ёмкость, куда подавались пары ртути. Данная методика, хотя и была относительно эффективна, несла риск смертельного отравления ртутью, что привело к вытеснению её из клинической практики.
Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб. Но после появления светоотверждаемых материалов это применение стало редким.
Ртуть-203 (T1/2 = 53 сек) используется в радиофармакологии.
В технике
- Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент термического расширения почти не зависит от температуры и (в) обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
- Парами ртути заполняют люминесцентные лампы тлеющего и дугового разряда. В спектре испускания паров ртути много ультрафиолетового света, и, чтобы преобразовать его в видимый, стекло ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жёсткого ультрафиолета (254 нм), в каковом качестве и используются для обеззараживания помещений. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
- Ртутные электрические вентили применяются в мощных выпрямительных устройствах, электроприводах, электросварочных аппаратах, тяговых и выпрямительных подстанциях и т. п.[29] со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
- Ртуть и сплавы на её основе использовались в герметичных выключателях, включающихся при определённом положении (.
- Ртуть используется в датчиках положения.
- В некоторых химических источниках тока (например, ртутно-цинковых), в эталонных источниках напряжения (нормальный элемент Вестона).
- Ртуть также иногда применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках[30].
- Ртуть ранее входила в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде. Сейчас запрещается использовать такого типа покрытия.
- Иодид ртути(I) используется как полупроводниковый детектор радиоактивного излучения[31].
- Фульминат ртути(II) («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (детонаторы).
- Бромид ртути(I) применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
- Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
- До середины XX века ртуть широко применялась в барометрах, манометрах и сфигмоманометрах (отсюда традиция измерять давление в миллиметрах ртутного столба). Сейчас чаще применяют анероиды, но ртуть остаётся незаменимой в барометрах и манометрах особо высокой точности (например, на метеорологических станциях).
- Низкое давление насыщенного пара определяет использование ртути в качестве вакуумного материала. Так, ртутные вакуумные насосы были основными источниками вакуума в XIX и начале XX веков.
- Ранее ртуть использовали для золочения поверхностей методом амальгамирования, однако в настоящее время от этого метода отказались из-за токсичности ртути.
- Соединения ртути использовались в шляпном производстве для выделки фетра.
В металлургии
- Металлическая ртуть применяется для получения целого ряда важнейших сплавов[каких?].
- Ранее различные амальгамы металлов, особенно золота и серебра, широко использовались в ювелирном деле, в производстве зеркал.
- Металлическая ртуть служит катодом для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас вместо ртутных катодов часто используют электролиз с диафрагмой, но доля едкого натра и хлора, получаемых электролизом с ртутным катодом, и ныне составляет около трети.
- Ртуть используется для переработки вторичного алюминия (см. амальгамация).
- Ртуть хорошо смачивает золото, поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта технология распространена, в частности, в Амазонии.
В химической промышленности
- Соли ртути использовали в качестве катализатора промышленного получения ацетальдегида из ацетилена (реакция Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим окислением этана или этена.
- Реактив Несслера используется для количественного определения аммиака.
- При производстве хлора и едких щелочей путем электролиза иногда применяется жидкий ртутный катод[32].
В сельском хозяйстве
Высокотоксичные соединения ртути — каломель, сулему, мертиолят и другие — используют для протравливания семенного зерна и в качестве пестицидов.
Токсикология ртути
Ртуть и многие её соединения ядовиты[33]. Воздействие ртути — даже в небольших количествах — может вызывать серьёзные проблемы со здоровьем и представляет угрозу для внутриутробного развития плода и развития ребёнка на ранних стадиях жизни. Ртуть может оказывать токсическое воздействие на нервную, пищеварительную и иммунную системы, а также на лёгкие, почки, кожу и глаза. ВОЗ рассматривает ртуть в качестве одного из десяти основных химических веществ или групп химических веществ, представляющих значительную проблему для общественного здравоохранения[34][35].
Наиболее ядовиты пары́ и растворимые соединения ртути. Сама металлическая ртуть менее опасна, однако она постепенно испаряется даже при комнатной температуре[36]. Пары могут вызвать тяжёлое отравление, для чего достаточно, например, ртути из одного разбитого медицинского термометра. Ртуть и её соединения (сулема, каломель, киноварь, цианид ртути) поражают нервную систему, печень, почки, желудочно-кишечный тракт, при вдыхании — дыхательные пути (а проникновение ртути в организм чаще происходит именно при вдыхании её паров, не имеющих запаха). По классу опасности ртуть относится к первому классу (чрезвычайно опасное химическое вещество). Опасный загрязнитель окружающей среды, особенно опасны выбросы в воду, поскольку в результате деятельности населяющих дно микроорганизмов происходит образование растворимой в воде и токсичной метилртути, накапливающейся в рыбе. Ртуть — типичный представитель кумулятивных ядов.
Органические соединения ртути (диметилртуть и др.) в целом намного токсичнее, чем неорганические, прежде всего из-за их липофильности и способности более эффективно взаимодействовать с элементами ферментативных систем организма.
В норме общее количество ртути в организме человека массой 70 кг составляет около 6 мг. В большинстве тканей организма её относительное содержание 0,2—0,7 мг/кг, в костях 0,5 мг/кг, в крови 0,008 мг/кг[37].
Гигиеническое нормирование концентраций ртути
| Среда | место | продолжительность
воздействия |
концентрация | единицы |
|---|---|---|---|---|
| Воздух | в населённых пунктах и в жилых помещениях[38] | среднесуточная | 0,0003 | мг/м³ |
| воздуха в рабочей зоне[39] | макс. разовая | 0,01 | ||
| среднесменная | 0,005 | |||
| Вода | сточная, для неорганических соединений в пересчёте на Hg (II) | 0,005 | мг/л | |
| хозяйственно-питьевого и культурного водопользования | 0,0005 | |||
| рыбохозяйственных водоёмов | 0,00001 | |||
| морских водоёмов | 0,0001 | |||
Демеркуризация
Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией. В быту самой частой ситуацией для демеркуризации является ртуть, вылившаяся из разбитого ртутного термометра, что не представляет серьёзной опасности, но требует аккуратности и соблюдения правил безопасности. Необходимо аккуратно собрать все раскатившиеся шарики ртути (например, сложить на влажное бумажное полотенце, собирать удобно пипеткой, можно кисточкой, можно широким скотчем), нужно внимательно осмотреть самые дальние углы комнаты. Затем сложите всё, что касалось ртути, в пакет с молнией и закройте его, положите в другой пакет с молнией и его тоже закройте (на случай, если один из них порвётся), после чего позвоните по номеру 112[во всех странах мира?] в единую дежурную диспетчерскую службу и выясните, куда нужно сдавать собранную ртуть, и сдайте её на переработку. Также необходимо будет проветрить помещение в течение суток (открыть окна). Выбрасывать ртуть в бытовой мусор или сливать в канализацию нельзя. Также нельзя использовать пылесос для сбора ртути — он разобьёт ртуть на мельчайшие капли и ускорит её испарение, таким образом концентрация паров ртути повысится вплоть до опасного уровня[40]. Необходимо обработать поверхность, на которой разлилась ртуть, 0,2 % раствором (2 г на 1 л воды) перманганата калия, что удобно сделать распылителем. Через день после проветривания промыть концентрированным раствором соды в мыльной воде. Антидотом при отравлении парами ртути, служит тиосульфат натрия, который наименее токсичен, из описанных антидотов (запрещено принимать в контакте с перманганатом калия или нитратами, запрещено вводить внутримышечно при единовременном использовании витамина B12). Проверить помещение на наличие паров от остатков ртутных шариков (ртуть тяжёлая и при падении термометра разлетается, закатывается в щели в паркете или ламинате). Подробнее в основной статье о демеркуризации.
Запрет использования содержащей ртуть продукции
С 2020 года международная конвенция, названная в память массового отравления ртутью и подписанная многими странами, запрещает производство, экспорт и импорт нескольких различных видов ртутьсодержащих продуктов, применяемых в быту, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давления[41]. Конвенция вводит регулирование использования ртути и ограничивает ряд промышленных процессов и отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота), производство цемента[41].
Примечания
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- Mercury: physical properties (англ.). WebElements. Дата обращения: 17 августа 2013.
- Химическая энциклопедия : в 5 т. / Под ред. Н. С. Зефирова. — Москва : Советская энциклопедия, 1995. — Т. 4. — С. 278. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8. — ISBN 5-82270-092-4 (т. 4).
- Что вы знаете и чего не знаете о ртути и ее соединениях // Химия и жизнь. — 1968. — № 6. — P. 37.
- Фигуровский Н.А. Очерк общей истории химии. От древнейших времен до начала XIX в.. — Наука, 1969. — С. 37.
- Янин Е.П. Ртуть, человек, окружающая среда. Дата обращения: 26 сентября 2020.
- А.А. Шейпак. 7.1 Первые семь металлов // История науки и техники. — М.: МГИУ, 2010. — Т. Ч. II. — С. 38.
- Фасмер М. Этимологический словарь русского языка. — Прогресс. — М., 1964–1973. — Т. 3. — С. 509—510.
- Вольфсон, Ф. И. Главнейшие типы рудных месторождений / Ф. И. Вольфсон, А. В. Дружинин. — М. : Недра, 1975. — 392 с.
- Эглестонит — статья из Геологического словаря: т.2. — М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978.
- Эглестонит — wiki.web.ru. wiki.web.ru. Дата обращения: 6 ноября 2019.
- Eglestonite
- Ebany J. Martinez-Finley, Michael Aschner. Recent Advances in Mercury Research (англ.) // Current environmental health reports. — 2014-06. — Vol. 1, iss. 2. — P. 163. — doi:10.1007/s40572-014-0014-z.
- Meija, Juris. Certification of natural isotopic abundance inorganic mercury reference material NIMS-1 for absolute isotopic composition and atomic weight : [англ.] / Juris Meija, Lu Yang, Ralph E. Sturgeon … [et al.] // Journal of Analytical Atomic Spectrometry. — 2010. — Vol. 25, no. 3. — P. 384–389. — doi:10.1039/B926288A.
- Audi, G. The NUBASE evaluation of nuclear and decay properties : [англ.] : [арх. 23 сентября 2008] / G. Audi, A. H. Wapstra, C. Thibault … [et al.] // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — . — doi:10.1016/j.nuclphysa.2003.11.001.
- Almadén and Idrija. Heritage of Mercury. UNESCO World Heritage Centre
- Венецкий С.И. Серебряная вода // Рассказы о металлах. — Москва, 1979. — С. 208—209. — 240 с. — 60 000 экз.
- Таблицы физических величин, 1976, с. 58.
- H.L. Clever. Mercury in Liquids, Compressed Gases, Molten Salts and Other Elements IUPAC SDS Vol 29 - Density of Liquid Mercury (англ.). IUPAC SOLUBILITY DATA. NIST (1987). Дата обращения: 29 сентября 2017.
- Таблицы физических величин, 1976, с. 199.
- Рассчитано по данным, взятым из: Справочник химика. — Т. 3. — М.; Л.: Химия, 1965.
- Получен фторид Hg(IV): Новости химии @ChemPort.Ru
- Wang, Xuefang. Mercury Is a Transition Metal : The First Experimental Evidence for HgF4 : [англ.] / Xuefang Wang, Lester Andrews, Sebastian Riedel … [et al.] // Angewandte Chemie International Edition. — 2007. — Vol. 46, no. 44. — P. 8371−8375. — doi:10.1002/anie.200703710.
- Is mercury a transition metal? Архивировано 12 октября 2016 года.
- Реми Г. Курс неорганической химии. — Т. 2. — М.: Мир, 1966.
- Государственная фармакопея российской федерации. — Научный центр экспертизы средств медицинского применения, 2008.
- Закусов В. В. Фармакология. — М.: Медицина, 1966.
- Ртуть (Hg) | Основные средства лечения сифилиса. www.medical-enc.ru. Дата обращения: 18 февраля 2017.
- Ртуть // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Приборостроение и автоматизация. Справочник. Изд. «Машиностроение» М. 1964
- Радиоактивные вещества : Полупроводниковые детекторы
- Катод ртутный - Справочник химика 21. chem21.info. Дата обращения: 31 марта 2018.
- Мишин В.П., Рубцов А.Ф., Серебряков Л.А, Трахтенберг И.М., Цивильно М.А. Ртуть // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1984. — Т. 22. Растворители - Сахаров. — 544 с. — 150 800 экз.
- Информационный бюллетень ВОЗ N°361
-
- Ha, E., et al., Current progress on understanding the impact of mercury on human health. Environ. Res. (2016), http://dx.doi.org/10.1016/j.envres.2016.06.042i
- Metallic Mercury — ToxFAQs / Agency for Toxic Substances and Disease Registry (ATSDR), CDC, США
- Emsley J. Nature's Building Blocks: An A-Z Guide to the Elements (англ.). — Oxford: Oxford University Press, 2001. — P. 254. — 538 p. — ISBN 9780198503415.
- СанПиН 1.2.3685-21 "Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания".
- МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ. РТУТЬ. Технические условия (Mercury. Specifications) ГОСТ 4658-73.
- Водовозов, Алексей. Мифы о лихорадке : [лекция] : [видео] : 39:00−46:22. — Гиперион, 2019. — 23 января.
- Республика Беларусь подписала Минаматскую конвенцию о ртути, ООН (24 сентября 2014). Дата обращения 25 сентября 2014.
Литература
- Ртуть // Пустырник — Румчерод [Электронный ресурс]. — 2015. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 28). — ISBN 978-5-85270-365-1.
- Ртутные руды // Горная энциклопедия: [в 5 томах] / гл. ред. Е. А. Козловский. — М.: «Советская энциклопедия», 1989. — Т. 4. Ортин — Социосфера. — С. 409—410. — 623 с. — 55 700 экз. — ISBN 5-85270-007-X.
- Ртуть // Горная энциклопедия: [в 5 томах] / гл. ред. Е. А. Козловский. — М.: «Советская энциклопедия», 1989. — Т. 4. Ортин — Социосфера. — С. 410—412. — 623 с. — 55 700 экз. — ISBN 5-85270-007-X.
- Ртуть // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные—Трипсин. — С. 278—280. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Венецкий, С. И. Серебряная вода // Рассказы о металлах. — М. : Металлургия, 1979. — С. 208—209. — 240 с. — 60 000 экз.
- Таблицы физических величин / под ред. акад. Кикоина И. К.. — М.: Атомиздат, 1976. — 1005 с.
Ссылки
- Ртуть в Популярной библиотеке химических элементов
- Месторождения ртути в открытой Геоэнциклопедии.