Оганесон
Оганесо́н[3][4] (лат. Oganesson, Og), ранее был известен под временными названиями унуно́ктий (лат. Ununoctium, Uuo) или э́ка-радо́н — химический элемент восемнадцатой группы (по устаревшей классификации — главной подгруппы восьмой группы), седьмого периода периодической системы химических элементов, атомный номер — 118. Наиболее стабильным является нуклид 294Og, чей период полураспада оценивается в 1 мс, а атомная масса равна 294,214(5) а. е. м.[1] Искусственно синтезированный радиоактивный элемент, в природе не встречается. Синтез ядер оганесона был впервые осуществлён в 2002 и 2005 годах в Объединённом институте ядерных исследований (Дубна)[5] в сотрудничестве с Ливерморской национальной лабораторией. Результаты этих экспериментов были опубликованы в 2006 году[6]. 28 ноября 2016 года временное систематическое название «унуноктий» и временное обозначение Uuo после формального подтверждения открытия элемента были заменены на постоянное название «оганесон» и обозначение Og (в честь академика Юрия Цолаковича Оганесяна), предложенные первооткрывателями и утверждённые ИЮПАК[7].
| Оганесон | ||||
|---|---|---|---|---|
| ← Теннессин | Унуненний → | ||||
| ||||
| Внешний вид простого вещества | ||||
| неизвестен | ||||
| Свойства атома | ||||
| Название, символ, номер | Оганесон / Oganesson (Og), 118 | |||
| Атомная масса (молярная масса) |
[294] (массовое число наиболее устойчивого изотопа)[1] | |||
| Электронная конфигурация | [Rn] 5f14 6d10 7s2 7p6 | |||
| Радиус атома | (расчётный) 152 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | (расчётный) 230 пм | |||
| Степени окисления | −1[2], 0, +1, +2, +4, +6 | |||
| Энергия ионизации (первый электрон) |
(расчётная) 975 ± 155 кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | (расчётная) 4,9—5,1 г/см³ | |||
| Температура кипения | (расчётная) 350 ± 30 K, 77 ± 30 °C | |||
| Уд. теплота плавления | (расчётная) 23,5 кДж/моль | |||
| Уд. теплота испарения | (расчётная) 19,4 кДж/моль | |||
| Номер CAS | 54144-19-3 | |||
| 118 | Оганесон |
| 5f146d107s27p6 | |
Номинально элемент относится к инертным газам, однако его физические и, возможно, химические свойства, вероятно, могут сильно отличаться от остальных представителей группы. Оганесон завершает седьмой период таблицы Менделеева, хотя на момент его открытия ещё оставалась незаполненной предыдущая, 117-я клетка таблицы (теннессин)[8]. В настоящее время оганесон является самым тяжелым химическим элементом, открытие которого подтверждено. Таким образом, по состоянию на 2022 год, оганесон — последний элемент Периодической таблицы химических элементов.
Происхождение названия
Согласно правилам наименования новых элементов, принятым в 2002 году, для обеспечения лингвистического однообразия всем новым элементам должны даваться названия, оканчивающиеся на «-ium»[9]. Однако в большинстве языков названия элементов 18-й группы периодической системы (благородных газов), за исключением гелия, традиционно имеют окончание «-on»: Neon — неон, Argon — аргон, Krypton — криптон, Xenon — ксенон, Radon — радон. Поэтому, вскоре после признания открытия 113-го, 115-го, 117-го и 118-го элементов, в правила были внесены изменения, согласно которым, по принятой в химической номенклатуре традиции, элементам 18-й группы должны даваться названия, заканчивающиеся на «-on»[10].
Американские учёные, ошибочно заявившие об открытии 118-го элемента в 1999 году, намеревались предложить для него название гиорсий (лат. ghiorsium, Gh) в честь Альберта Гиорсо[11].
Вскоре после открытия 118-го элемента появились неофициальные предложения назвать его московием (в честь Московской области) либо в честь Г. Н. Флёрова[12]. Однако позже название «московий» было официально предложено для 115-го элемента, а в честь Флёрова назван 114-й элемент.
8 июня 2016 года ИЮПАК рекомендовал дать элементу название «оганесон» (Oganesson, Og)[3] в честь профессора Юрия Цолаковича Оганесяна (род. в 1933 году), академика РАН, научного руководителя Лаборатории ядерных реакций им. Г. Н. Флёрова Объединённого института ядерных исследований в Дубне, за его новаторский вклад в исследование трансактиноидных элементов. Согласно пресс-релизу ИЮПАК, многие научные достижения Оганесяна включают в себя открытия сверхтяжёлых элементов и значительные достижения в области ядерной физики сверхтяжёлых ядер, включая экспериментальное свидетельство острова стабильности[13]. Название «оганесон» было представлено научной общественности для 5-месячного обсуждения с 8 июня по 8 ноября 2016 года. 28 ноября 2016 года ИЮПАК утвердил название «оганесон» для 118-го элемента[7][14]. Таким образом, оганесон стал вторым (после сиборгия) элементом, названным в честь живущего человека[15], и единственный элемент, у которого человек, в честь кого он был назван, жив до сих пор.
История открытия
Первое заявление об открытии элементов 116 и 118 в 1999 году в Беркли (США)[16] оказалось ошибочным и даже фальсифицированным[17]. Использовалась реакция холодного слияния ядер свинца и криптона:
Синтез по объявленной методике не был подтверждён в российском, немецком и японском центрах ядерных исследований, а затем и в США.
Первое событие распада 118-го элемента наблюдалось в эксперименте, проведённом в ОИЯИ в феврале—июне 2002 года[18].
9 октября 2006 года российские и американские физики-ядерщики официально сообщили о получении 118-го элемента[19]. Об открытии было объявлено не сразу, потому что энергия распада 294Og соответствовала энергии распада 212mPo — обычной примеси, образующейся в реакциях слияния при производстве сверхтяжелых элементов, и, таким образом, объявление было отложено до подтверждающего эксперимента 2005 года, направленного на производство большего количества атомов оганесона[20]. В эксперименте 2005 года использовалась другая энергия пучка (251 МэВ вместо 245 МэВ) и толщина мишени (0,34 мг/см2 вместо 0,23 мг/см2)[21]. Повторные эксперименты по синтезу проводились на дубненском ускорителе в феврале—июне 2007 года. В результате бомбардировки мишени из калифорния-249 ионами изотопа кальция-48 образовались ещё два ядра атома 118-го элемента (294Og)[6]. После суммарно двух месяцев бомбардировок мишеней и 30 000 000 000 000 000 000 столкновений группе удалось создать только три (возможно, четыре) атома нового вида[22] (одно или два в 2002 году[23] и еще два в 2005)[24][25][26][27][28]. Тем не менее, исследователи были полностью уверены в том, что результаты не были ложноположительными, поскольку вероятность того, что обнаружение было случайным, оценивалась как менее 1 из 100 000[29].
В 2011 году ИЮПАК оценил результаты сотрудничества Дубна – Ливермор в 2006 году и пришел к выводу: «Три события, описанные для изотопа Z = 118, имеют очень хорошую внутреннюю избыточность, но без привязки к известным ядрам не удовлетворяют критериям открытия»[30].
30 декабря 2015 года ИЮПАК официально признал открытие 118-го элемента и приоритет в этом учёных из ОИЯИ и Ливерморской национальной лаборатории[31].
Получение
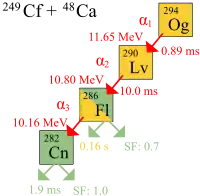
Оганесон был получен в результате ядерной реакции
Физические свойства
Так как оганесон был получен лишь в качестве отдельных атомов, а период его полураспада не позволяет его накапливать, то все физические свойства являются расчётными. Сложность получения так же не позволяет экспериментально изучать химические свойства (в данном случае период его полураспада не был бы ограничивающим значением для некоторых реакций) и они тоже являются исключительно расчётными.
Оганесон, в отличие от более лёгких элементов своей группы, должен являться не газом, а твёрдым веществом при нормальных условиях, что придаёт ему совершенно иные физические свойства[32].
При небольшом нагревании он легко должен плавиться и испаряться, его ожидаемая расчётная температура кипения составляет 80 ± 30 °C (довольно широкий диапазон вследствие вариации влияния релятивистских эффектов). Температура плавления его неизвестна, однако (по аналогии с более лёгкими элементами) ожидается, что она будет лишь немного ниже температуры кипения. Примерно такую же температуру плавления, как оганесон, имеет воск.
Столь значительное повышение температур плавления и кипения у оганесона по сравнению с радоном вызывают релятивистские эффекты 7p-оболочки, помимо простого увеличения атомной массы, которое усиливает межмолекулярное взаимодействие. Впрочем, оганесон предполагается одноатомным, хотя тенденция к образованию двухатомных молекул у него сильнее, чем у радона.
Расчётная плотность в твёрдом состоянии у оганесона при температуре плавления составляет около 5 г/см3. Это немного выше плотности радона в сжиженном состоянии (при −62 °C), которая составляет 4,4 г/см3. В газообразном состоянии оганесон будет похож на радон: тяжёлый бесцветный газ, немного выше по плотности самого радона[33].
Химические свойства
Оганесон принадлежит к инертным газам, имея завершённую 7p-электронную оболочку и завершённую электронную конфигурацию, что означает его химическую инертность и нулевую по умолчанию степень окисления[34]. Однако соединения тяжёлых благородных газов (начиная с криптона) с сильным окислителями (например, фтором или кислородом) всё же могут существовать, причём по мере роста порядкового номера электроны удаляются от ядра, поэтому лёгкость окисления инертного газа сильными окислителями от криптона к радону возрастает. Теоретически предполагается, что оганесон будет несколько активнее радона[35][36]. Его ожидаемая энергия ионизации первого электрона составляет 840 кДж/моль, что существенно ниже радона (1036 кДж/моль) и ксенона (1170 кДж/моль).
Довольно низкая энергия ионизации оганесона и его иные физические свойства предполагают, что оганесон, хотя и будет химически малоактивным по сравнению с большинством других элементов, но по сравнению с предыдущими инертными газами будет весьма химически активен.
Если более лёгкие аналоги — ксенон или криптон — требовали для окисления чрезвычайно жёстких условий и применения фтора, то оганесон должен окисляться гораздо легче. Он будет даже более активен, чем флеровий и коперниций — самые малоактивные элементы среди сверхтяжёлых элементов.
Электроотрицательными элементами оганесон сможет относительно легко окисляться до двух степеней окисления — +2 и +4, причём со фтором оганесон будет образовывать скорее ионные, чем ковалентные соединения (например, OgF4)[37]. Оганесон сможет образовать, в отличие от более лёгких аналогов, относительно стабильные соединения и с менее электроотрицательными элементами, например, хлором, азотом или, возможно, и другими элементами. Вероятно, он сможет относительно легко окисляться и кислородом. Возможна теоретически также и степень окисления +1. Возможно, сильные кислоты-окислители также смогут окислять оганесон до оксидов или даже переводить его в состав катиона, подобно металлу.
Степень окисления +6 для оганесона будет также возможна, но она будет значительно менее стабильна и требовать жёстких условий для разрушения всего 7p-подуровня. Оганесон сможет, вероятно, образовывать, оганесонистую кислоту H2OgO4 (подобно ксенону, образующему ксенонистую кислоту H2XeO4) и соли оганесаты, а все соединения его в степени окисления +6 будут очень сильными окислителями.
В отличие от ксенона, высшая теоретическая степень окисления оганесона +8 будет невозможна из-за требуемой крайне высокой энергии на распаривание 7s-электронов (как и у других 7p-элементов). Поэтому +6 будет высшей степенью окисления оганесона.
Оганесон также будет проявлять не только восстановительные свойства, но и сам служить окислителем для сильных восстановителей, проявляя степень окисления −1 за счёт релятивистских эффектов подоболочек. Теоретически инертные газы не могут выступать в качестве окислителей, поскольку у них все электронные оболочки завершены, однако на практике оганесон сможет образовывать соли с активными металлами — оганесониды (например, оганесонид цезия CsOg), выступая в качестве окислителя, в этом проявляя некоторое сходство с галогенами.
Известные изотопы
| Изотоп | Масса | Период полураспада | Тип распада |
|---|---|---|---|
| 294Og | 294 | 0,70 ± 0,3 мс[38] | α-распад в 290Lv |
Примечания
- Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265–291. — doi:10.1515/pac-2015-0305.
- Haire, Richard G. Transactinides and the future elements // The Chemistry of the Actinide and Transactinide Elements (англ.) / Morss; Edelstein, Norman M.; Fuger, Jean. — 3rd. — Dordrecht, The Netherlands: Springer Science+Business Media, 2006. — P. 1724. — ISBN 1-4020-3555-1.
- Названия новых химических элементов 113, 115, 117 и 118: Пресс-релиз Объединенного института ядерных исследований. ОИЯИ (8 июня 2016). Дата обращения: 8 июня 2016.
- IUPAC утвердил названия элементов 113, 115, 117 и 118: Пресс-релиз Объединенного института ядерных исследований. ОИЯИ (30 ноября 2016). Дата обращения: 5 декабря 2016.
- Wieser, M. E. Atomic weights of the elements 2005 (IUPAC Technical Report) (англ.) // Pure Appl. Chem. : journal. — 2006. — Vol. 78, no. 11. — P. 2051—2066. — doi:10.1351/pac200678112051.
- Yu. Ts. Oganessian et al. Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions // Physical Review C. — 2006. — Т. 74, № 4. — С. 044602.
- IUPAC Announces the Names of the Elements 113, 115, 117, and 118 (англ.). ИЮПАК (30 ноября 2016). Дата обращения: 30 ноября 2016.
- Грушина А. Биографии новых элементов // Наука и жизнь. — 2017. — Вып. 1. — С. 24—25.
- Koppenol W. H. Naming of new elements (IUPAC Recommendations 2002) (англ.) // Pure and Applied Chemistry. — 2002. — January (vol. 74, no. 5). — P. 787—791. — ISSN 0033-4545. — doi:10.1351/pac200274050787.
- Koppenol W. H. et al. How to name new chemical elements (IUPAC Recommendations 2016) (англ.) // Pure and Applied Chemistry. — 2016. — April (vol. 88, no. 4). — P. 401—405. — ISSN 0033-4545. — doi:10.1515/pac-2015-0802.
- Discovery of New Elements Makes Front Page News. Berkeley Lab Research Review Summer 1999 (1999). Дата обращения: 10 июня 2016.
- Емельянова, Ася 118-й элемент назовут по-русски. vesti.ru (17 октября 2006). Дата обращения: 25 июля 2007. Архивировано 25 декабря 2008 года.
- Губарев В. 118-й — новая звезда на небосклоне физики // В мире науки. — 2017. — Вып. 1/2. — С. 14—21.
- Образцов П. Унуноктий стал оганесоном // Наука и жизнь. — 2017. — Вып. 1. — С. 22—25.
- Виктор Ковылин. Оганесон — как странный сон
- Ninov V. et al. Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb // Physical Review Letters. — 1999. — Vol. 83, № 6. — P. 1104—1107.
- Public Affairs Department. Results of element 118 experiment retracted (англ.) (недоступная ссылка). Berkeley Lab (21 июля 2001). Дата обращения: 25 июля 2007. Архивировано 26 августа 2011 года.
- Yu. Ts. Oganessian et al. Results from the first 249Cf+48Ca experiment // JINR Communication : Препринт D7-2002-287. — ОИЯИ, Дубна, 2002.
- Yu. Ts. Oganessian, V. K. Utyonkov, Yu. V. Lobanov, F. Sh. Abdullin, A. N. Polyakov. Synthesis of the isotopes of elements 118 and 116 in the $^{249}\mathrm{Cf}$ and $^{245}\mathrm{Cm}+^{48}\mathrm{Ca}$ fusion reactions // Physical Review C. — 2006-10-09. — Т. 74, вып. 4. — С. 044602. — doi:10.1103/PhysRevC.74.044602.
- The Chemistry of Superheavy Elements. — Second edition. — Berlin, 2014. — 1 online resource (600 pages) с. — ISBN 978-3-642-37466-1, 3-642-37466-2.
- Yu. Ts. Oganessian, V. K. Utyonkov, Yu. V. Lobanov, F. Sh. Abdullin, A. N. Polyakov. Synthesis of the isotopes of elements 118 and 116 in the Cf 249 and Cm 245 + Ca 48 fusion reactions (англ.) // Physical Review C. — 2006-10-09. — Vol. 74, iss. 4. — P. 044602. — ISSN 1089-490X 0556-2813, 1089-490X. — doi:10.1103/PhysRevC.74.044602.
- The Top 6 Physics Stories of 2006 | Physics & Math | DISCOVER Magazine. web.archive.org (12 октября 2007). Дата обращения: 15 апреля 2021.
- Oganessian Yu.Ts. et al. ELEMENT 118: RESULTS FROM THE FIRST 249Cf + 48Ca EXPERIMENT (англ.) (недоступная ссылка). Архивировано 22 июля 2011 года.
- Livermore Scientists Team with Russia to Discover Element 118. web.archive.org (17 октября 2011). Дата обращения: 15 апреля 2021.
- Yuri Oganessian. Synthesis and decay properties of superheavy elements (нем.) // Pure and Applied Chemistry. — 2006-01-01. — Bd. 78, H. 5. — S. 889–904. — ISSN 1365-3075. — doi:10.1351/pac200678050889.
- Katharine Sanderson. Heaviest element made - again (англ.) // Nature. — 2006-10-17. — P. news061016–4. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/news061016-4.
- Elements 116 and 118 Are Discovered (англ.) (недоступная ссылка). Архивировано 18 января 2008 года.
- Weiss, Rick. Scientists Announce Creation of Atomic Element, the Heaviest Yet (17 октября 2006). Дата обращения 15 апреля 2021.
- MITCH JACOBY. ELEMENT 118 DETECTED, WITH CONFIDENCE // Chemical & Engineering News Archive. — 2006-10-23. — Т. 84, вып. 43. — С. 11. — ISSN 0009-2347. — doi:10.1021/cen-v084n043.p011.
- Robert C. Barber, Paul J. Karol, Hiromichi Nakahara, Emanuele Vardaci, Erich W. Vogt. Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report) (нем.) // Pure and Applied Chemistry. — 2011-06-01. — Bd. 83, H. 7. — S. 1485–1498. — ISSN 1365-3075. — doi:10.1351/PAC-REP-10-05-01.
- Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118 (англ.). ИЮПАК (30 декабря 2015). Дата обращения: 31 декабря 2015.
- Eichler, R. & Eichler, B., Thermochemical Properties of the Elements Rn, 112, 114, and 118, Paul Scherrer Institut, <http://lch.web.psi.ch/files/anrep03/06.pdf>. Проверено 23 октября 2010. Архивная копия от 7 июля 2011 на Wayback Machine
- Nash C. S., Crockett W. W. An Anomalous Bond Angle in (116)H2. Theoretical Evidence for Supervalent Hybridization (англ.) // The Journal of Physical Chemistry A. — 2006. — Vol. 110, iss. 14. — P. 4619—4621. — doi:10.1021/jp060888z.
- Grosse A. V. Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em) (англ.) // Journal of Inorganic and Nuclear Chemistry. — 1965. — Vol. 27, iss. 3. — P. 509—519. — doi:10.1016/0022-1902(65)80255-X.
- Ununoctium: Binary Compounds. WebElements Periodic Table. Дата обращения: 18 января 2008.
- Fricke B. Superheavy elements: a prediction of their chemical and physical properties (англ.) // Recent Impact of Physics on Inorganic Chemistry. — 1975. — P. 89—144. — doi:10.1007/BFb0116498.
- Han Y.-K., Lee Y. S. Structures of RgFn (Rg = Xe, Rn, and Element 118. n = 2, 4.) Calculated by Two-component Spin-Orbit Methods. A Spin-Orbit Induced Isomer of (118)F4 (англ.) // Journal of Physical Chemistry A. — 1999. — Vol. 103, iss. 8. — P. 1104—1108. — doi:10.1021/jp983665k.
- Kondev F. G., Wang M., Huang W. J., Naimi S., Audi G. The Nubase2020 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2021. — Vol. 45, iss. 3. — P. 030001-1—030001-180. — doi:10.1088/1674-1137/abddae.

Ссылки
- Оганесон на Webelements
- Оганесон в журнале «Что нового в науке и технике»
- Оганесон на сайте Минатома
- Оганесон в пресс-обзоре сайта «Инопресса»
- О синтезе элемента на сайте ОИЯИ
- Учёные из России и США получили два атома унуноктия (118 элемент), Lenta.ru, 17.10.2006.