Короткая форма периодической системы элементов
Короткая форма периодической системы элементов — один из способов изображения периодической системы химических элементов, восходящий к первоначальной версии таблицы Д. И. Менделеева[1]. Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6, как у серы и селена, и т. д. В таком виде таблица была опубликована Менделеевым в 1871 году[2].
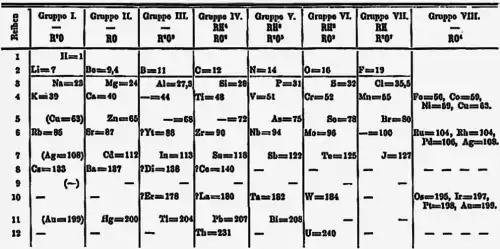
.png.webp)
Современное использование
Короткая форма таблицы была широко распространена и популяризовывалась. Так, например, будущий академик Б. М. Кедров писал в своей книге «Периодический закон Д. И. Менделеева и его философское значение» (1947 г.)
Тот факт, что результаты электронной теории так легко и естественно уложились в как бы специально предназначенные для них Менделеевым подвижные табличные формы, еще раз доказывает, что именно короткая таблица и именно с точки зрения электронного строения атома является наиболее совершенной для выражения периодической системы как естественной системы элементов.
Короткая форма таблицы отменена ИЮПАК в 1989 году. Из современной иностранной литературы короткая форма исключена полностью, вместо неё используется длинная форма, однако, благодаря своей привычности и распространённости, она все ещё периодически встречается в российских справочниках и пособиях[3], а также используется в школах для изучения, поскольку стехиометрическая (формальная) валентность элемента связана с номером его группы именно в короткой форме таблицы Менделеева. Такую ситуацию некоторые исследователи связывают в том числе с кажущейся рациональной компактностью короткой формы таблицы, а также с инерцией, стереотипностью мышления и невосприятием современной (международной) информации[4].
Вариации
| Периодическая система элементов (короткий вариант 1) | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа → Период ↓ |
I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||
| A | B | A | B | A | B | A | B | A | B | A | B | A | B | A | B | |||||||||||||||
| 1 | 1 H |
2 He |
||||||||||||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
||||||||||||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
||||||||||||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni | ||||||||||||||||||||
| 29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
|||||||||||||||||||||||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd | ||||||||||||||||||||
| 47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
|||||||||||||||||||||||
| 6 | 55 Cs |
56 Ba |
* | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt | ||||||||||||||||||||
| 79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
|||||||||||||||||||||||
| 7 | 87 Fr |
88 Ra |
** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds | ||||||||||||||||||||
| 111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
|||||||||||||||||||||||
| Лантаноиды * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||||||||||||
| Актиноиды ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||||||||||||
| Щелочные металлы | Галогены | ||
| Щёлочноземельные металлы | Благородные газы | ||
| Переходные металлы | Лантаноиды | ||
| Постпереходные металлы | Актиноиды | ||
| Полуметаллы — металлоиды | Суперактиноиды | ||
| Другие неметаллы (16-я (VI) группа — халькогены) | |||
| Периодическая система элементов (короткий вариант 2)[5]. | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа → Период ↓ |
I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||
| A | B | A | B | B | A | B | A | B | A | B | A | B | A | B | A | |||||||||||||||
| 1 | 1 H |
2 He |
||||||||||||||||||||||||||||
| 2 | 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne | ||||||||||||||||||||||
| 3 | 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar | ||||||||||||||||||||||
| 4 | 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
||||||||||||||||||||
| 29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
|||||||||||||||||||||||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
||||||||||||||||||||
| 47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
|||||||||||||||||||||||
| 6 | 55 Cs |
56 Ba |
* | 72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
||||||||||||||||||||
| 79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
|||||||||||||||||||||||
| 7 | 87 Fr |
88 Ra |
** | 104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
||||||||||||||||||||
| 111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
|||||||||||||||||||||||
| Лантаноиды * | 57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu | |||||||||||||||
| Актиноиды ** | 89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr | |||||||||||||||
Водород в короткой форме таблицы иногда помещают в 7-ю группу[6].
См. также
Примечания
- «Химическая энциклопедия», статья ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ: Структура периодической системы, изд. «Советская энциклопедия», М., 1988.
- Scerri 2007, p. 112
- Р. САЙФУЛЛИН, А. САЙФУЛЛИН Современная форма таблицы Менделеева // Наука и жизнь № 7 , 2004
- Р. С. Сайфуллин, А. Р. Сайфуллин, «Новая таблица Менделеева», Химия и жизнь, 2003, № 12, стр. 14—17. (В виде PDF-файла (недоступная ссылка) — 6,0 МБ — на сайте «Единой Коллекции цифровых образовательных ресурсов… Архивная копия от 18 марта 2016 на Wayback Machine».)
- Для облегчения восприятия символы элементов главных и побочных подгрупп выравниваются в ячейках таблицы в разные стороны. В первом варианте таблицы символы элементов главных подгрупп выровнены влево, а символы элементов побочных подгрупп — вправо. Приводимый здесь вариант отличается тем, что в первой строке каждого периода символы элементов выровнены влево, а во второй строке — вправо. Таким образом выравнивание оказывается одинаковым, но ради этого подгруппы перемешиваются. Во втором и третьем периоде, которые состоят только из одной строки, используется смешанное выравнивание
- Некрасов Б. В., Основы общей химии, т. 1, 1973, с. 238.
Литература
- Scerri, Eric. The periodic table: Its story and its significance (англ.). — Oxford: Oxford University Press, 2007. — ISBN 0-19-530573-6.
- Mazurs, E.G. Graphical Representations of the Periodic System During One Hundred Years (англ.). — Alabama: University of Alabama Press, 1974. — ISBN 978-0-8173-3200-6.
- Некрасов Б.В. Основы общей химии. — 3-е изд. — М.: Химия, 1973. — Т. 1. — 656 с.
- Советский энциклопедический словарь. — М.: Издательство Советская Энциклопедия, 1980. — С. 1000. — 1600 с., с илл.
Ссылки