Предсказанные Менделеевым элементы
В 1869 году Дмитрий Иванович Менделеев опубликовал Периодическую таблицу элементов, в которой химические элементы были расположены в соответствии с наличием у них сходных свойств в порядке возрастания атомного веса[1].
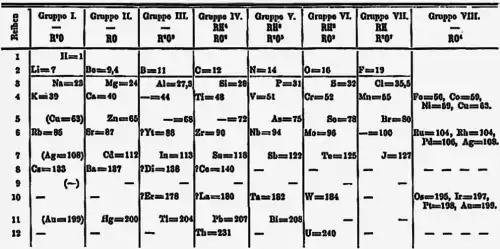
В отличие от работ предшественников Менделеев исходил из допущения существования еще не открытых элементов на основе периодического изменения физических и химических свойств известных элементов. Им были оставлены в таблице пустые ячейки для ещё не открытых элементов и предсказаны их свойства. Чтобы дать предсказанным элементам «временные» названия, Менделеев использовал приставки «эка», «дви» и «три» (от санскритских слов «один», «два» и «три»), в зависимости от того, на сколько позиций вниз от уже открытого элемента с похожими свойствами находился предсказанный элемент. Так, германий до своего открытия в 1886 году носил название «экасилиций», а рений, открытый в 1926 году, назывался «двимарганец».
Первоначальные предсказания (1869—1870 годы)
Уже в первом варианте Периодической таблицы, опубликованном Д. И. Менделеевым в 1869 году, включено больше элементов, чем их было открыто на тот момент. В нём оставлены четыре свободные ячейки для еще неизвестных элементов и указаны их атомные веса (в «паях», близких по значению к массе атома водорода).
Развивая в 1869—1871 годах идеи периодичности, Д. И. Менделеев ввёл понятие о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов. Для предсказания свойств простых веществ и соединений он исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы, двух соседних элементов в периоде и элементов по диагонали — так называемое «правило звезды». На этой основе, в частности, опираясь на результаты изучения последовательности изменения стеклообразующих оксидов, исправил значения атомных масс 9 элементов. Предсказал в 1870 году существование, вычислил атомные массы и описал свойства трёх ещё не открытых тогда элементов — «экаалюминия», «экабора» и «экасилиция»[2]. Затем предсказал существование ещё восьми элементов, в том числе «двителлура» — полония, «экаиода» — астата, «экамарганца» — технеция, «экацезия» — франция.
Предсказания Менделеева вызвали в научном мире скепсис и острую критику. Так, немецкий физикохимик Вильгельм Оствальд, будущий лауреат Нобелевской премии, утверждал, что открыт не закон, а принцип классификации «чего-то неопределенного». Роберт Бунзен, первооткрыватель рубидия и цезия, писал, что Менделеев увлекает химиков «в надуманный мир чистых абстракций», а Герман Кольбе в 1870 г. назвал работу Менделеева спекулятивной. Правота Менделеева была убедительно доказана, когда были открыты предсказанные им элементы: галлий (Поль Лекок де Буабодран, 1875), скандий (Ларс Нильсон, 1879) и германий (Клеменс Винклер, 1886) — соответственно экаалюминий, экабор и экасилиций.
Триумф Периодического закона
В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл в минерале вюртците — сульфиде цинка ZnS — предсказанный Менделеевым «экаалюминий» и назвал его в честь своей родины галлием Ga (латинское название Франции — Галлия). Он писал: «Я думаю, нет необходимости настаивать на огромном значении подтверждения теоретических выводов господина Менделеева». Менделеев точно предсказал свойства галлия: его атомную массу, плотность металла, формулу оксида, хлорида, сульфата. Менделеев предугадал, что это будет очень легкоплавкий металл. Ниже в таблице сравниваются свойства, предсказанные Менделеевым, с действительными характеристиками галлия.
| Свойство | Экаалюминий | Галлий |
|---|---|---|
| Атомная масса | 68 | 69,72 |
| Плотность (г/см³) | 6,0 | 5,904 |
| Температура плавления (°C) | низкая | 29,78 |
| Формула оксида | Ea2O3 (плотность 5,5 г см−3, растворяется и в кислотах, и в основаниях) | Ga2O3 (плотность 5,88 г см−3, растворяется и в кислотах, и в основаниях) |
| Формула хлорида | Ea2Cl6 (летучий) | Ga2Cl6 (летучий) |
В 1879 г. шведский химик Ларс Нильсон открыл в сложном минерале гадолините скандий. Позже Пер Теодор Клеве доказал совпадение свойств предсказанного экабора и только что открытого скандия и известил об этом Менделеева. Менделеев предсказал для экабора атомную массу 44, а атомная масса скандия оказалась равна 44,955910. Нильсон писал: «Не остается никакого сомнения, что в скандии открыт экабор… Так подтверждаются нагляднейшим образом соображения русского химика, которые не только дали возможность предсказать существование скандия и галлия, но и предвидеть заранее их важнейшие свойства».
По поводу элемента экасилиция Менделеев писал: «Мне кажется, наиболее интересным из несомненно недостающих металлов будет тот, который принадлежит к IV группе аналогов углерода, а именно к III ряду. Это будет металл, следующий тотчас же за кремнием, и потому назовем его экасилицием». Германий был впервые выделен в 1886 году во Фрейбурге немецким химиком Клеменсом Винклером при анализе редкого минерала аргиродита. Его открытие оказалось лучшим на то время подтверждением теории Менделеева, поскольку германий по своим свойствам значительно резче отличается от соседних элементов, чем два предсказанных ранее элемента.
| Свойство | Экасилиций | Германий |
|---|---|---|
| Атомная масса | 72 | 72,61 |
| Плотность (г/см³) | 5,5 | 5,35 |
| Температура плавления (°C) | высокая | 947 |
| Цвет | серый | серый |
| Тип оксида | тугоплавкий диоксид | тугоплавкий диоксид |
| Плотность оксида (г/см³) | 4,7 | 4,7 |
| Реакция оксида | слабое основание | слабое основание |
| Температура кипения хлорида | ниже 100 °C | 86 °C (GeCl4) |
| Плотность хлорида (г/см³) | 1,9 | 1,9 |
Триумф предсказательной силы открытия Менделеева был настолько силён, что Винклер натолкнулся на неприятие со стороны некоторых химиков предложенного им названия «германий». Они стали обвинять Винклера в национализме и в присвоении открытия, которое сделал Менделеев, уже давший элементу имя «экасилиций». Обескураженный Винклер обратился за советом к самому Дмитрию Ивановичу. Тот объяснил, что именно первооткрыватель нового элемента должен дать ему название. Позже Винклер писал: «Едва ли можно найти иное более поразительное доказательство справедливости учения о периодичности, как во вновь открытом элементе. Это не просто подтверждение смелой теории, здесь мы видим очевидное расширение химического кругозора, мощный шаг в области познания».
Менделеев включил присланные ему портреты Лекока де Буабодрана, Нильсона и Винклера в общую рамку, озаглавив ее «Укрепители периодического закона». С конца 1880-х годов Периодический закон был окончательно признан в качестве одной из теоретических основ химии.
Никто из учёных, занимавшихся до Менделеева или одновременно с ним исследованиями соотношений между атомными весами и свойствами элементов, не смог сформулировать эту закономерность так ясно, как это сделал он. В частности, это относится к Дж. Ньюлендсу и Л. Мейеру. Предсказание ещё неизвестных элементов, их свойств и свойств их соединений является исключительно заслугой Д. И. Менделеева. …Наилучшим образом он смог применить свой метод горизонтальной, вертикальной и диагональной интерполяции в открытой им периодической системе для предсказания свойств…
— Анорганикум : В 2-х т. / [Блументаль Г., Энгельс З., Фиц И. и др.] ; Ред. Л. Кольдиц. - М. : Мир, 1984
.
В 1937 году был открыт 43-й элемент (экамарганец) — технеций[3].
Предсказания тяжёлых элементов
В 1871 году Менделеев предсказал существование элемента, расположенного между торием и ураном. Тридцатью годами позже, в 1900 году, Уильям Крукс выделил протактиний как неизвестную радиоактивную примесь в образце урана. Различные изотопы протактиния затем выделяли в Германии в 1913 и 1918 годах[4], но современное название элемент получил только в 1948 году.
Версия Периодической таблицы, изданная в 1869, предсказывала существование более тяжёлого аналога титана и циркония, но в 1871 году Менделеев поместил на это место лантан. Открытие в 1923 году гафния подтвердило первоначальное предположение Менделеева.
В период создания первых вариантов периодической таблицы свойства редкоземельных элементов были изучены плохо и недостоверно. Кроме того, для тяжелых элементов периодическое изменение свойств имеет более сложный характер: критерий аналогии атомов не мог помочь Менделееву, как в случае экабора, экаалюминия и экасилиция; в этом случае этот критерий был лишен по крайней мере предсказательной силы, что снижало его научную ценность. Это объясняет, почему предсказания Менделеева для более тяжёлых элементов сбылись не так точно, как для лёгких, и почему эти предсказания не так широко известны.
Гипотеза об трансводородных элементах
В 1902 году после открытия гелия и аргона Менделеев поместил их в нулевую группу таблицы[5]. Сомневаясь в правильности атомной теории, объясняющей закон постоянства состава, он не мог априори считать водород легчайшим из элементов и полагал, что ещё более лёгкий член химически инертной нулевой группы мог оказаться незамеченным. Существованием этого элемента Менделеев пытался объяснить радиоактивность.
Более тяжёлый из двух гипотетических трансводородных элементов Менделеев отождествлял с коронием, получившим название по ассоциации с необъяснённой спектральной линией солнечной короны. Ошибочная калибровка прибора дала длину волны 531,68 нм, которая позже была исправлена на 530,3 нм. Эту длину волны Гротриан и Эдлен в 1939 году соотнесли с линией железа[6].
Легчайшему из газов нулевой группы, первому в Периодической таблице, приписывалась теоретическая атомная масса между 5,3·10−11 и 9,6·10−7. Частицам этого газа, названного им ньютонием, Менделеев приписал кинетическую скорость порядка 2,5·106 м/с. Почти невесомые, частицы обоих этих газов, по Менделееву, должны были легко проходить через толщу материи, практически не вступая в химические реакции. Высокая подвижность и очень малая атомная масса трансводородных газов приводила бы к тому, что они могли быть очень разреженными, по внешним признакам оставаясь при этом плотными.
Позже Менделеев опубликовал теоретическую разработку об эфире. Книга, называвшаяся «Химическая концепция эфира», вышла в 1904 году, и в ней вновь содержалось упоминание о двух гипотетических инертных газах легче водорода, коронии и ньютонии[7]. Под «эфирным газом» Менделеев понимал межзвёздную атмосферу, состоящую из двух трансводородных газов с примесями других элементов и образовавшуюся в результате внутренних процессов, идущих на звёздах.
Примечания
- Kaji, Masanori. D.I.Mendeleev's concept of chemical elements and The Principles of Chemistry (англ.) // Bulletin for the History of Chemistry : journal. — 2002. — Vol. 27, no. 1. — P. 4—16. Архивировано 17 декабря 2008 года.
- Менделеев Д. И. Естественная система элементов и применение её к указанию свойств неоткрытых элементов // Журнал Русского химического общества. — 1871. — Т. III. — С. 25—56. Архивировано 17 марта 2014 года.
- Mendeleev’s Triumph (англ.)
- Emsley, John. Nature's Building Blocks (англ.). — (Hardcover, First Edition). — Oxford University Press, 2001. — P. 347. — ISBN 0198503407.
- Менделеев, Д. Основы химии. — 7-е издание. — 1902.
- Swings, P. Edlén's Identification of the Coronal Lines with Forbidden Lines of Fe X, XI, XIII, XIV, XV; Ni XII, XIII, XV, XVI; Ca XII, XIII, XV; a X, XIV (англ.) // The Astrophysical Journal : journal. — IOP Publishing, 1943. — July (vol. 98, no. 119). — P. 116—124. — doi:10.1086/144550. и
- Менделеев, Д. Попытка химического понимания мирового эфира. — Санкт-Петербург, 1903.
Английский перевод:
Mendeléeff, D. An Attempt Towards A Chemical Conception Of The Ether (англ.) / G. Kamensky (translator). — Longmans, Green & Co., 1904.
См. также
Bensaude-Vincent, Bernadette. L’éther, élément chimique: un essai malheureux de Mendéleev en 1904 (фр.) // British Journal for the History of Science : magazine. — 1982. — Vol. 15. — P. 183—188. — doi:10.1017/S0007087400019166.
Литература
- Scerri Eric. The Periodic Table: Its Story and Its Significance (англ.). — New York: Oxford University Press, 2007. — ISBN 0195305736.