Ксенонистая кислота
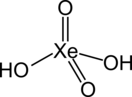
Ксенонистая кислота — соединение благородного газа, кислота ксенона в степени окисления +6. Формула ее отображается либо H2XeO4, либо H6XeO6. В основном, соли образуются от второй формы кислоты.
| Ксенонистая кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Дигидрокси(диоксо)ксенон | ||
| Хим. формула | H2XeO4 | ||
| Физические свойства | |||
| Молярная масса | 197,306 г/моль | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 290,26 °C | ||
| • кипения | 666,25 °C | ||
| Классификация | |||
| Рег. номер CAS | 1402134-83-1 | ||
| PubChem | 23422578 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 10466143 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Применяется в органической химии как сильный окислитель. При ее разложении освобождается большое количество газообразных продуктов, таких как ксенон, кислород и озон.
Существование ксенонистой кислоты было предположено Лайнусом Полингом в 1933 году[1].
Соли ксенонистой кислоты называются ксенатами, в состав их входит анион XeO42−. Они разлагаются на ксенон и перксенаты:
Соли, содержащие полностью депротонированный анион XeO42−, в настоящее время неизвестны[2].
Получение
Получается путём растворения триоксида ксенона в воде:
H2XeO4 также образуется в результате гидролиза фторида ксенона(VI) при н. у.:
При добавлении гидроксида бария к данной реакции, выпадает осадок BaXeO4, который разлагается при температуре 125 °C на ксенон, оксид бария и кислород. При взаимодействии со свежеприготовленным осадком гидроксида меди образуется ксенат меди CuXeO4, который, возможно, обладает сверхпроводимостью.
Примечания
- Linus Pauling. The Formulas of Antimonic Acid and the Antimonates (англ.) // J. Am. Chem. Soc. : journal. — 1933. — June (vol. 55, no. 5). — P. 1895—1900. — doi:10.1021/ja01332a016.
- Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman. Inorganic chemistry (неопр.). — Academic Press, 2001. — С. 399. — ISBN 0-12-352651-5.