Принцип жёстких и мягких кислот и оснований
Принцип жёстких и мягких кислот и оснований (принцип ЖМКО, принцип ЖМКО Пирсона, англ. HSAB theory) — в химии принцип, качественно описывающий способность кислот и оснований Льюиса к эффективному взаимодействию. Данный принцип был предложен американским химиком-неоргаником Ральфом Пирсоном в 1963 году[1][2][3]. В соответствии с данным принципом, кислоты и основания Льюиса делятся на жёсткие и мягкие, причём мягкие кислоты преимущественно реагируют с мягкими основаниями, а жёсткие кислоты — с жёсткими основаниями[4].
Суть принципа
Принцип ЖМКО касается взаимодействий, рассматриваемых в теории кислот и оснований Льюиса. Согласно этой теории, основание Льюиса B отдаёт электронную пару на образование ковалентной связи с кислотой Льюиса A, которая имеет вакантную орбиталь. Эффективность такого взаимодействия зависит от химического состава и электронного строения реагирующих кислоты и основания. Данные параметры учтены Пирсоном при классификации кислот и оснований на мягкие и жёсткие.
Согласно Пирсону, жёсткие кислоты — это акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Молекулярная орбиталь, на которую переходит электронная пара, у жёстких кислот имеет низкую энергию. Соответственно, жёсткие основания — это доноры с аналогичными свойствами (с большим отрицательным зарядом, большой электроотрицательностью и низкой поляризуемостью). Их орбиталь, с которой отдаётся электронная пара, также имеет низкую энергию. Мягкие кислоты — это кислоты Льюиса с малым положительным зарядом, большим размером, низкой электроотрицательностью и высокой поляризуемостью. Мягкие основания — это основания Льюиса с теми же свойствами. Как у мягких кислот, так и у мягких оснований энергия орбиталей, участвующих в реакции высока. Поскольку такие свойства как заряд, электроотрицательность и поляризуемость изменяются плавно, существует ряд кислот и оснований Льюиса, которые занимают промежуточное положение между жёсткими и мягкими[5].
Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ковалентного характера[6].
| Жёсткие кислоты | Промежуточные кислоты | Мягкие кислоты |
|---|---|---|
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, -RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены |
| Жёсткие основания | Промежуточные основания | Мягкие основания |
| OH-, RO-, F-, Cl-, RCOO-, NO3-, NH3, RNH2, H2O, ROH, SO42-, CO32-, R2O, NR2-, NH2- | Br-, C6H5NH2, NO2-, C5H5N | RS-, RSH, I-, H-, R3C-, алкены, C6H6, R3P, (RO)3P, CN- |
Помимо условного деления на три типа, можно также проследить зависимость жёсткости или мягкости в рядах отдельных кислот и оснований Льюиса. Например, при движении по группе периодической системы сверху вниз жёсткость оснований уменьшается[7]:
Для изоэлектронных соединений жёсткость возрастает при движении по периоду слева направо[7]:
Жёсткость кислот уменьшается при движении по группе сверху вниз[7]:
Применение в органической химии
В органической химии принцип ЖМКО широко применяется для предсказания или объяснения протекания химических реакций.
Например, реакцию между тиоэфиром CH3COSR и алкоголят-ионом RO- можно представить как переход ацильного катиона CH3CO+ (жёсткой кислоты Льюиса) от мягкого основания Льюиса RS- к жёсткому основанию Льюиса RO-. Согласно принципу ЖМКО, аддукт жёсткой кислоты и жёсткого основания более устойчив, поэтому равновесие в реакции сдвинуто вправо[7].

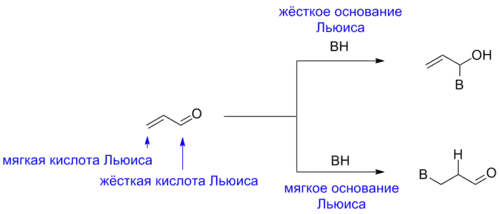
Принцип Пирсона также полезен для предсказания реакционной способности соединений с двумя реакционными центрами, например, енолят-ионов или α,β-ненасыщенных соединений. Последние, например, склонны к реакциям с нуклеофилами по двум положениям, причём преимущественное направление реакции зависит от жёсткости нуклеофила как основания Льюиса[7].
См. также
Примечания
- Pearson в JACS, 1963.
- Pearson в JCE 1, 1968.
- Pearson в JCE 2, 1968.
- Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М.: Большая Российская энциклопедия, 1992. — Т. 2. — С. 145. — ISBN 5-85270-039-8.
- Москва В. В. Понятие кислоты и основания в органической химии // Соросовский образовательный журнал. — 1996. — № 12. — С. 33—40.
- Золотов Ю. А., Дорохова Е. Н., Фадеева В. И. и др. Основы аналитической химии. Книга 1. Общие вопросы. Методы разделения / Под ред. Ю. А. Золотова. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1999. — С. 152—153. — ISBN 5-06-003558-1.
- Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. — 3-е изд.. — М.: Бином. Лаборатория знаний, 2010. — Т. 1. — С. Глава 3. — ISBN 978-5-94774-614-9.
Литература
Оригинальные работы
- Pearson R. G. Hard and Soft Acids and Bases (англ.) // J. Am. Chem. Soc. — 1963. — Vol. 85, no. 22. — P. 3533—3539. — doi:10.1021/ja00905a001.
- Pearson R. G. Hard and soft acids and bases, HSAB, part 1: Fundamental principles (англ.) // J. Chem. Educ. — 1968. — Vol. 45, no. 9. — P. 581—586. — doi:10.1021/ed045p581.
- Pearson R. G. Hard and soft acids and bases, HSAB, part II: Underlying theories (англ.) // J. Chem. Educ. — 1968. — Vol. 45, no. 10. — P. 643—648. — doi:10.1021/ed045p643.
Обзоры
- Москва В. В. Понятие кислоты и основания в органической химии // Соросовский образовательный журнал. — 1996. — № 12. — С. 33—40.