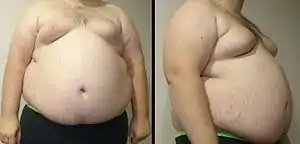
Метаболический синдром и антипсихотики
Метаболический синдром, развивающийся при терапии антипсихотиками (нейролептиками), — наличие у пациента ожирения, гиперлипидемии и резистентности к инсулину, которые могут приводить к развитию диабета и сердечно-сосудистых заболеваний[1]. Повышение интереса к часто встречающимся у пациентов, получающих нейролептики, метаболическим нарушениям возникло в связи с распространением в клинической практике атипичных антипсихотиков[2], по этой причине метаболические расстройства описываются чаще всего применительно к препаратам данной группы (но не применительно к препаратам группы «старых», типичных нейролептиков, которые в действительности тоже могут вызывать такие нарушения).
В понятие «метаболический синдром» не входят изменения уровня таких гормонов, регулирующих метаболизм, как кортизол, гормон роста, пролактин: эти расстройства, связанные с приёмом антипсихотиков, рассматриваются в специальной литературе обычно отдельно.
Факторы риска
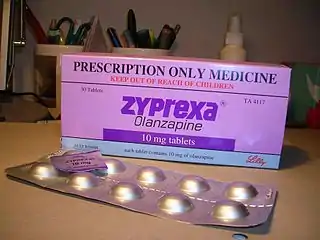
Риск развития метаболического синдрома у пациентов, принимающих нейролептики, повышают следующие факторы:
- возраст старше 45 лет[3]
- возраст до 16 лет[4]
- наличие ожирения, дислипидемии или артериальной гипертензии[3]
- малоподвижный образ жизни[3]
- поликистоз яичников[3]
- принадлежность пациента к азиатской или африканской расе[3]
- метаболические или сердечно-сосудистые заболевания у родственников[3]
- женский пол[5]
- нарциссическая акцентуация у пациента[5]
- отмечаемое у пациента усиление аппетита при возникновении тревожных или депрессивных состояний[5]
- большая длительность приёма нейролептика[6]
По данным многих исследований, частота диабета и ожирения у лиц, страдающих аффективными расстройствами и шизофренией, значительно выше, чем в популяции. Высказывается предположение, что некоторые свойственные пациентам, страдающим шизофренией, особенности (например, пассивный образ жизни, переедание) увеличивают риск развития сахарного диабета, даже если пациент не принимает антипсихотики. Отмечалась и возможность генетических ассоциаций между шизофренией и диабетом. Результаты ограниченных исследований метаболического профиля и риска развития диабета у ранее не лечившихся пациентов с возникновением симптомов шизофрении противоречивы; по некоторым данным, значительный процент таких пациентов уже изначально обнаруживают нарушенный уровень глюкозы натощак, гиперинсулинемию.[7]
Тем не менее у пациентов с шизофренией[7] и биполярным аффективным расстройством[8], не принимающих антипсихотики, риск развития ожирения и метаболического синдрома существенно ниже, чем у пациентов с теми же расстройствами, антипсихотики принимающих[7][8].
В наибольшей степени риск развития метаболических нарушений характерен для клозапина и оланзапина, в меньшей степени — для рисперидона и кветиапина, в то время как амисульприд и арипипразол заметно не влияют на развитие этих расстройств[9].
Метаболический синдром и история антипсихотиков
О том, что терапия нейролептиками может сопровождаться развитием метаболических нарушений, было известно задолго до появления атипичных антипсихотиков. Ещё в 1956 году после появления первого антипсихотика хлорпромазина (аминазина) B. Hiles опубликовала сообщение о 5 случаях развития гипергликемии и глюкозурии у пациентов, получающих аминазин. Кроме того, она упомянула о 5 клинических случаях декомпенсации прежде контролируемого диабета после начала приёма аминазина и о возврате к прежнему состоянию после его отмены. В том же году было опубликовано другое сообщение о пациенте, у которого развились диабет, желтуха и гемолитическая анемия после 12 дней применения аминазина.[1]
На протяжении 1950—60-х годов последовали другие сообщения о связи аминазина и диабета. Однако вследствие того, что неврологические побочные эффекты (экстрапирамидные нарушения) были более частыми и очевидными, они вышли на первый план и обсуждались в научной литературе, проблема же развития диабета упоминалась очень редко. Поэтому миновало более 10 лет от первого клинического сообщения до публикации результатов клинических исследований, касающихся развития диабета при приёме аминазина. Отмечалось, что с 1954 по 1966 г. в психиатрических клиниках диабет развился у 27% женщин, получающих нейролептики группы фенотиазина, и у 9% женщин, не получающих нейролептики этой группы. Механизм возникновения диабета при применении нейролептиков был неизвестен. Кроме того, в 1950-х — 1960-х годах публиковались также клинические наблюдения о нарушениях липидного обмена (в особенности холестерола) у пациентов, принимающих аминазин.[1]
Увеличение массы тела, связанное с применением первых нейролептиков, тоже было описано в первые годы после начала их применения в клинической практике (Planansky K., Heilizer F., 1959; Klett C., Caffey E., 1960). Оно наблюдалось при использовании и таблетированных антипсихотиков, и антипсихотиков-пролонгов. Эта проблема, как и проблема диабета, тоже не привлекала пристального внимания исследователей из-за наличия других, более явных побочных эффектов.[10]
Впоследствии стало очевидно, что такие побочные явления терапии нейролептиками, как повышение веса[10], диабет и нарушения липидного обмена, представляют собой проблему, связанную с применением не только традиционных препаратов, но и некоторых новых — атипичных антипсихотиков.[1] Появление атипичных антипсихотиков, гораздо более «мягких» и более безопасных в сравнении со старыми препаратами, определило переход к новым стандартам переносимости и безопасности. В связи с этим интерес к часто встречающимся у пациентов, получающих антипсихотическую терапию, метаболическим нарушениям повысился.[2]
Диагностика метаболического синдрома и его общая распространённость
В целом (безотносительно к применению антипсихотиков) метаболический синдром представляет собой очень распространённое в общей популяции явление: встречается он примерно у одного из пяти взрослых человек с избыточным весом и у 40% людей старше 60 лет.[2]
Наиболее важный критерий метаболического синдрома — абдоминальный тип ожирения, который проявляется увеличением объёма талии.[10]
По определению Американской диабетической ассоциации, понятие «метаболический синдром» включает в себя такие проявления, как[2]:
- абдоминальное ожирение (окружность талии более 102 см у мужчин и 88 см у женщин или оценка с помощью ИМТ — индекса массы тела);
- повышенный уровень триглицеридов (более 150 мг/дл);
- сниженный уровень липопротеинов высокой плотности (менее 40 мг/дл у мужчин и менее 50 мг/дл у женщин);
- гипертония (артериальное давление 130/85 мм рт.ст. и более);
- содержание глюкозы в крови натощак более 110 мг/дл.
Согласно определению Международной федерации диабета (2005), основными клиническими проявлениями метаболического синдрома у лиц европеоидной расы являются[11]:
- центральное ожирение (окружность талии > 94 см у мужчин и > 80 см у женщин) и два из следующих четырёх факторов:
- повышение триглицеридов 1,7 ммоль/л (150 мг/дл)1;
- снижение холестерина липопротеидов высокой плотности < 1,0 ммоль/л (40 мг/дл) у мужчин и < 1,3 ммоль/л (50 мг/дл) у женщин1;
- повышение артериального давления ≥ 130/85 мм рт.ст.1;
- содержание глюкозы в крови натощак 5,6 ммоль/л (100 мг/дл) или диагностированный ранее сахарный диабет 2-го типа.
- 1 Либо же пациент получает лечение по поводу этого состояния.
Стоит отметить, что, согласно данным крупных эпидемиологических исследований, диагностика патологических состояний гипергликемии лишь по уровню глюкозы крови натощак, как рекомендовалось Американской диабетической ассоциацией, приводит к недооценке истинной распространённости диабета более чем на 1/3. При диагностике диабета следует учитывать не только пороговые уровни гликемии натощак, но и уровни через 2 часа после приёма глюкозы. Это позволяет выявлять как сахарный диабет, так и преддиабетные состояния — нарушенную толерантность к глюкозе.[12] При правильно проводимых мерах профилактики у пациентов с преддиабетным состоянием можно предотвратить развитие в будущем у них диабета.[13]
Критерии диагностики нарушенной толерантности к глюкозе — гликемия натощак (капиллярная кровь) <6,1 ммоль/л; а через 2 часа после нагрузки глюкозой >7,8 и <11,1 ммоль/л.[13]
Понятие метаболического синдрома также включает в себя следующие лабораторные аномалии[14]:
- микроальбуминурия
- гиперурикемия
- повышение уровня свободных жирных кислот
- повышение фактора свёртывания крови VII (с увеличением концентрации фибриногена и/или PAI 1 (ингибитора активатора плазминогена 1) и, следовательно, нарушением фибринолиза и повышением вязкости крови)
Увеличение массы тела
Под фармакогенным увеличением массы тела принято понимать нежелательный побочный эффект лекарства в виде повышения массы тела более чем на 5—7%, если это повышение приводит к отказу от режима терапии и/или различным медицинским проблемам.[15]
Все нейролептики могут повышать массу тела в той или иной степени[15]. Увеличение её наиболее выражено при приёме клозапина и оланзапина[16][15], но применение других атипичных антипсихотиков тоже довольно часто приводит к её повышению[15]. Меньший риск ожирения, чем для клозапина и оланзапина, характерен для рисперидона, кветиапина, амисульприда, зотепина[17], палиперидона, илоперидона[18], сертиндола[19]; минимальный риск — для зипрасидона, арипипразола[17][18], азенапина и луразидона[18] (по другим данным, азенапин характеризуется промежуточным риском[19]). Сертиндол вызывает увеличение массы тела в большей мере, чем рисперидон, рисперидон — в большей мере, чем амисульприд[16].
Среднее увеличение веса при приёме атипичных нейролептиков выше, чем при приёме типичных. Среди типичных нейролептиков в особенности способствуют повышению массы тела препараты с высокой антигистаминовой активностью[15] (тиоридазин[20], аминазин, тизерцин, труксал[15]), в наименьшей мере — такие препараты, как галоперидол, трифтазин[15], флуфеназин, перфеназин[20].
По данным различных исследований, увеличение массы тела на 20% и более отмечается у 40—80% пациентов, принимающих антипсихотики. Результаты более 80 исследований показывают, что при терапии антипсихотиками средняя прибавка в весе через 10 недель терапии клозапином составляет 4,45 кг, оланзапином 4,15 кг, рисперидоном 2,1 кг против 1,08 кг при терапии галоперидолом.[21] У пациентов, принимающих 15 мг оланзапина в сутки, через 1 год терапии вес увеличился в среднем на 11,8 кг. В краткосрочных исследованиях действия кветиапина у 23% пациентов выявлено повышение массы тела более чем на 7%. Через 1 год терапии кветиапином средняя прибавка в весе составила 2,2 кг[14]. В целом длительность применения антипсихотиков является фактором, значительно воздействующим на увеличение веса и индекса массы тела[22].
Прибавка в весе при приёме нейролептиков может происходить быстро в первые несколько недель, после чего скорость прибавки веса постепенно снижается до тех пор, пока через несколько месяцев не будет достигнуто плато прироста веса — через 4—9 месяцев для оланзапина и через 42—46 месяцев для клозапина[16].
Сочетанная фармакотерапия (приём нейролептиков в сочетании с, например, нормотимиками[23] или трициклическими антидепрессантами[24]) дополнительно повышает риск увеличения массы тела[23][24].
Диагностика
При диагностике увеличения массы тела особое внимание нужно уделять локализации жировых отложений, особенно их количеству в области живота (абдоминальное ожирение). Для оценки можно использовать такой показатель, как соотношение объёма талии к объему бёдер (WHR): значение WHR более 0,9 для мужчин и более 0,85 для женщин означает наличие избыточного абдоминального жира.[2] Критерием метаболического синдрома также является окружность живота больше 40 дюймов (102 см) у мужчин и больше 35 дюймов (89 см) у женщин.[23]
На практике часто также используется понятие «индекс массы тела» (body mass index — BMI): масса тела в килограммах делится на рост в метрах в квадрате. По данным Всемирной Организации Здравоохранения, показателем избыточной массы является ИМТ ≥ 25 кг/м2, при ИМТ ≥ 30 кг/м2 диагностируется ожирение.[10]
Механизм развития
Считается, что метаболические изменения, происходящие в организме пациента при приёме антипсихотиков, обусловливают быстрое увеличение массы тела (в первые несколько месяцев после начала приёма), а длительная прибавка (в течение нескольких лет), по всей видимости, вызывается поведенческими факторами: предпочтениями в питании и уровнем физической активности. T. Lambert (2002) была предложена теория «[скорости] зайца и черепахи», согласно которой одни препараты имеют свойство вызывать быструю прибавку веса с последующим выходом на «плато» — «скорость зайца»; другие же, не обладающие таким потенциалом, при длительном применении тоже приводят к увеличению массы тела в связи с воздействием на образ жизни пациента — «скорость черепахи»[2] (в частности, на уровень физической активности может негативно влиять седативный эффект нейролептиков[25]).
Что касается метаболических изменений, возникающих вследствие приёма препаратов в первые месяцы и приводящих к ожирению, то высказываются различные мнения о механизме их возникновения. Так, блокада антипсихотиками серотониновых рецепторов может приводить к повышению веса путём стимулирования пищевого рефлекса; на возрастание массы тела влияет и блокада гистаминовых рецепторов: нейролептики с высоким сродством к H1-рецепторам (клозапин и оланзапин) вызывают максимальное увеличение веса[25]. Гистаминовые H1- и H3-рецепторы являются медиаторами потребления энергии, и те из атипичных антипсихотиков, которые обладают выраженной антигистаминной активностью, снижают скорость метаболизма (и вызывают сопутствующий седативный эффект) благодаря блокаде H1-рецепторов[4]. М-холиноблокирующее действие антипсихотиков тоже может быть ответственно за развитие ожирения, поскольку оно вызывает сухость слизистых и жажду, для утоления которой пациенты используют высококалорийные напитки[5]. Ожирение может быть обусловлено также и дофаминблокирующим действием нейролептиков: блокируя дофаминовые рецепторы, нейролептики тем самым снижают способность получать удовольствие, что компенсируется за счёт повышенного потребления калорийной (в том числе жирной и сладкой) пищи[20].
Кроме того, к повышению массы тела приводит увеличение уровня андрогенов у женщин и снижение уровня андрогенов у мужчин, в результате которого происходит понижение чувствительности нейронов насыщения в гипоталамусе. Повышение уровня пролактина, развивающееся вследствие приёма нейролептиков, может прямо способствовать увеличению веса тела за счёт снижения чувствительности к инсулину или же опосредованно за счёт дальнейшего нарушения уровня андрогенов и эстрогенов.[25]
Существуют и другие биологические механизмы, отвечающие за формирование пищевого поведения. Так, в нескольких клинических исследованиях было показано, что клозапин и оланзапин повышают уровень TNF-α, интерлейкина-2 и лептина. Фактор некроза опухолей (tumor necrosis factor, TNF-α) играет основную роль в различных метаболических и иммунных процессах и в пищевом поведении, влияет на метаболизм глюкозы, белков и жиров.[15] Лептин — гормон, продуцируемый адипоцитами, имеющий важное значение в регулировании массы тела и влияющий на аппетит; ожирение нередко сопровождается повышением уровня лептина в крови и, вероятно, снижением чувствительности к нему рецепторов гипоталамуса, что и приводит к повышенному аппетиту и росту массы тела. Повышенный уровень лептина в крови может также влиять на тканевую инсулинорезистентность (связь ожирения и резистентности к инсулину).[1] Ещё один механизм увеличения веса тела — развитие гипергликемии за счет нарушения регуляции глюкозы и инсулина, а также нарушения в липидном обмене[25].
Последствия ожирения
Повышение массы тела существенно снижает качество жизни пациентов, приводит к стигматизации, ухудшает соблюдение медицинских рекомендаций вплоть до полного отказа от лечения.[15] Ожирение может влиять на самооценку и приводить к большему дискомфорту, чем другие частые побочные эффекты атипичных антипсихотиков (седация или сексуальная дисфункция). Негативная оценка ожирения окружающими и самим пациентом препятствует реинтеграции в общество. Отрицательное отношение к ожирению может приводить к социальному снижению в таких областях, как занятость, образование и семейная жизнь.[25]
Избыточная масса тела повышает риск заболеваемости артериальной гипертонией, ишемической болезнью сердца, инсультом, сахарным диабетом 2-го типа[23], дислипидемией, желчекаменной болезнью, остеоартритами, ночным апноэ[15] и расстройствами сна[26], респираторными болезнями, злокачественными опухолями эндометрия, молочной железы, простаты и толстого кишечника[15], бесплодием, депрессией[23]. Уровень смертности при развитии ожирения резко возрастает.[15]
Подсчитано, что с каждым килограммом лишнего веса риск развития сахарного диабета 2-го типа возрастает на 4,5%.[25] Вероятность развития сахарного диабета (как и артериальной гипертензии, ишемической болезни сердца) выше, если основная масса жира расположена на туловище и в брюшной полости.[27]
Ожирение является фактором риска развития деменции. В зрелом возрасте (40—45 лет) оно имеет чёткую корреляцию с повышенным риском развития деменции в последующие тридцать лет. У людей с высоким индексом массы тела (30 и выше) деменция развивается на 75% чаще, чем у людей с нормальными показателями индекса массы тела (ИМТ от 18,5 до 24,9).[28]
Абдоминальное ожирение крепче связано с риском развития деменции, чем ожирение всего тела: жировая ткань, покрывающая внутренние органы (висцеральный жир), имеет, по-видимому, более высокую метаболическую активность, чем подкожный жир.[28]
Нарушения липидного обмена (дислипидемия)
Повышение веса часто сопровождается нарушением липидного обмена[15]. Имеющиеся данные указывают на то, что увеличение липидов в сыворотке крови связано с увеличением массы тела[29]. Дислипидемия является основным фактором риска развития сердечно-сосудистых заболеваний и часто сопровождается сахарным диабетом 2-го типа[25]. Приём антипсихотиков может оказывать в том числе и первичное действие на регуляцию липидного обмена — влиять на неё не только опосредованно благодаря влиянию на массу тела, но и непосредственно, вне зависимости от влияния на неё[20][30] (в особенности это касается оланзапина и клозапина[30]).
Связь между приёмом антипсихотиков и изменениями липидного обмена впервые была продемонстрирована на примере хлорпромазина (аминазина). В дальнейшем было показано, что аминазин и другие производные фенотиазина влияют на липидный спектр сильнее, чем другая группа типичных антипсихотиков — бутирофеноны (галоперидол и др.).[5]
Дислипидемия чаще развивается при лечении атипичными, чем типичными антипсихотиками. Изменения уровня липидов при приёме нейролептиков имеют типично атерогенный характер и заключаются в повышении уровня общего холестерина, триглицеридов, повышении уровня холестерина липопротеинов низкой плотности и снижении уровня холестерина липопротеинов высокой плотности. Среди атипичных нейролептиков гиперхолестеринемию чаще всего вызывают оланзапин, клозапин и амисульприд; несколько в меньшей степени — кветиапин, ещё реже — рисперидон; в наименьшей мере на уровни липидов влияют арипипразол и зипрасидон[20].
По данным ретроспективного анализа историй болезни 19 600 пациентов в Великобритании, риск развития дислипидемии оказался в 3 раза выше при терапии оланзапином по сравнению с терапией типичными нейролептиками. В исследовании CATIE наибольшие изменения метаболических параметров были связаны с применением оланзапина, а наименьшее изменение показателей — с применением зипрасидона.[15]
Согласно некоторым данным, риск неблагоприятных изменений липидного обмена значительно выше при более высокой нейролептической нагрузке. Комбинированная психотропная терапия (сочетание типичных нейролептиков с атипичными) тоже повышает этот риск.[31]
Инсулинорезистентность и сахарный диабет
Механизм развития
Основная активность инсулина на уровне периферических тканей (например, скелетные мышцы, печень, жировая ткань) состоит в регулировании транспорта глюкозы через клеточные мембраны и угнетении липолиза. Резистентность к инсулину приводит к гиперлипидемии и компенсаторному повышению выработки инсулина (гиперинсулинемии). При длительном сохранении такого нарушения и декомпенсации развиваются гипергликемия и сахарный диабет. К другим факторам риска развития инсулинорезистентности относятся пожилой возраст, наличие в семейном анамнезе сахарного диабета 2-го типа, ожирение, курение, снижение физической активности.[1]
Атипичные антипсихотики могут опосредованно (ожирение, седация и в результате — снижение физической активности) быть причиной резистентности к инсулину, вторичной гиперинсулинемии и гиперлипидемии, а это, в свою очередь, повышает риск развития диабета 2-го типа и сердечно-сосудистых заболеваний.[1] Вместе с тем имеются данные о возникновении диабета и у пациентов с нормальной массой тела.[20][32][33] Таким образом, вероятно, некоторые антипсихотики могут непосредственно влиять на чувствительность к инсулину и его секрецию. Было показано, что некоторые из нейролептиков (клозапин, оланзапин и аминазин) могут взаимодействовать с переносчиками глюкозы и блокировать её обратный захват.[33]
Существует предположение, что влияние клозапина и оланзапина на серотонин может частично объяснять развитие резистентности к инсулину. В то время как блокада атипичными антипсихотиками серотониновых рецепторов подтипа 5-HT2C играет важную роль в механизме увеличения веса и опосредованно может способствовать развитию инсулинорезистентности за счёт увеличения жировой ткани, блокада серотониновых рецепторов подтипа 5-HT1A снижает уровень инсулина и, следовательно, вызывает гипергликемию. Блокада 5-HT2А-рецепторов, напротив, снижает уровень глюкозы крови (тогда как агонисты 5-HT2А-рецепторов вызывают гипергликемию).[15]
Высказывается предположение об обусловленности метаболических осложнений главным образом блокадой 5-HT2C-рецепторов, основанное на том, что именно клозапин и оланзапин, характеризующиеся наибольшим риском таких осложнений, снижают экспрессию 5-HT2C-рецепторов в ЦНС.[34] Кроме того, значительную роль в развитии диабета может играть блокада H1-гистаминовых рецепторов (посредством влияния на уровень лептина приводящая к увеличению веса и резистентности к инсулину) и М3-холинорецепторов (влияние на бета-клетки поджелудочной железы и тем самым — на стимулируемую ацетилхолином секрецию инсулина)[29].
Нейролептики могут вызывать нарушения метаболизма глюкозы также вследствие их влияния на секрецию С-пептида и других нейропептидов и гормонов (кортизола, соматотропного гормона и пр.)[35].
Распространённость и сроки развития
При ретроспективной оценке базы данных, состоящей из результатов обследования 38 632 пациентов, было выявлено, что сахарный диабет 2-го типа статистически достоверно чаще регистрировался в группе, принимавшей атипичные нейролептики, по сравнению с пациентами, принимавшими типичные нейролептики. Аналогичные результаты были получены и в результате оценки базы данных, включающей 21 145 пациентов[15]. В ретроспективном контролируемом исследовании, в котором участвовало свыше 8000 стационарных больных, также обнаружен более высокий риск развития диабета у пациентов, принимающих атипичные антипсихотики, чем у получающих типичные. Крупное исследование, охватившее более 56 000 пациентов, получающих антипсихотические средства через Министерство по делам ветеранов США, тоже показало, что этот риск выше у пациентов, принимающих клозапин или оланзапин, чем у принимающих типичные нейролептики[29].
Применение оланзапина статистически достоверно повышает риск развития сахарного диабета по сравнению со здоровыми людьми в 6 раз; риск этот весьма высок и при приёме клозапина. Применение типичных нейролептиков (аминазин, флюанксол, модитен, галоперидол, неулептил, этаперазин, сонапакс, сульпирид, трифтазин, клопиксол) тоже, хотя и в меньшей мере, повышает риск заболевания сахарным диабетом[15].
Среди атипичных антипсихотиков рисперидон, зипрасидон и сертиндол характеризуются значительно меньшим риском развития диабета по сравнению с клозапином, оланзапином и кветиапином.[36] Существуют и данные о том, что для рисперидона риск диабета более характерен, чем для зипрасидона, амисульприда и арипипразола.[37]
Клинические проявления сахарного диабета чаще всего могут возникать в течение полугода после начала приёма нейролептика, но описаны случаи его развития также и через несколько лет непрерывной терапии.[38] Так, у 36,6% пациентов, принимавших клозапин более 5 лет, был выставлен диагноз сахарного диабета II типа.[36]
Вероятность развития диабета при приёме антипсихотиков выше у пациентов в возрасте до 40 лет.[36] По данным исследования, в котором участвовали 48 229 детей, страдающих психическими расстройствами, было обнаружено, что абсолютный риск развития сахарного диабета 2-го типа среди детей, получающих антипсихотики, составлял 0,72%, а среди тех, кто не принимал данные препараты, — не выше 0,27%. Факторами риска, согласно результатам исследования, также являлся более поздний возраст постановки психиатрического диагноза и женский пол: у девочек, страдающих психическими расстройствами, сахарный диабет развивался чаще, чем у мальчиков; кроме того, среди них чаще встречались проблемы с лишним весом.[39]
Осложнения гипергликемии и сахарного диабета


Сахарный диабет сопровождается осложнениями со стороны мелких и крупных сосудов, нервной системы. К ним относятся ретинопатия, нефропатия, сердечно-сосудистые заболевания, поражения периферических сосудов. Они представляют собой главную причину заболеваемости и смертности у больных диабетом, но успешное регулирование уровня глюкозы в крови в значительной мере снижает риск соматических осложнений.[40]
Круг возможных отдалённых исходов сахарного диабета очень широк, начиная с незначительных соматических осложнений и заканчивая слепотой, ампутацией конечностей, почечной недостаточностью или нейропатией.[40]
Стоит отметить, что осложнения у пациентов с нарушенной толерантностью к глюкозе могут возникать уже на ранней стадии (гипергликемия при отсутствии сахарного диабета). Гипергликемия может длительное время не сопровождаться внешними проявлениями, но в то же время её наличие может приводить к серьёзным последствиям для физического здоровья пациента. Уровень глюкозы, превышающий норму, но недостаточно высокий для постановки диагноза сахарного диабета, способствует увеличению риска возникновения микрососудистых осложнений: диабетической ретинопатии (приводящей к слепоте), диабетической невропатии, диабетической нефропатии (являющейся причиной терминальной стадии почечной недостаточности). Повышение содержания глюкозы способствует также увеличению риска макрососудистых осложнений, таких как ишемическая болезнь сердца, инсульт, инфаркт миокарда, заболевания периферических сосудов[41].
Некоторые атипичные антипсихотики, особенно оланзапин и клозапин, могут вызвать диабетический кетоацидоз и гиперосмолярную кому — сравнительно редкие и чрезвычайно опасные осложнения сахарного диабета. Многократно описывались случаи, когда диабетический кетоацидоз развивался внезапно, в отсутствие диагностированного ранее диабета. Возможность диабетического кетоацидоза необходимо всегда иметь в виду: его психические проявления легко спутать с симптомами шизофрении.[42]
Психические осложнения сахарного диабета
Вероятность психических нарушений у больных диабетом, если они выполняют все врачебные рекомендации в отношении диеты и лечения, очень существенно снижается, тогда как при неблагоприятно текущем диабете (особенно юношеском) изменения психической сферы могут быть выраженными.[43]
В патогенезе психических расстройств при сахарном диабете играют роль гипоксия головного мозга при поражении церебральных сосудов, гипогликемия, интоксикация по причине поражения печени и почек, непосредственное поражение ткани мозга. Кроме того, имеют значение социально-психологические факторы (снижение трудоспособности, эмоциональная и двигательная депривация, снижение половой функции), неблагоприятные внешние воздействия в форме перенапряжения и психических потрясений, влияние длительного медикаментозного лечения. Сам факт наличия у больного сахарного диабета может быть источником психотравмирующей ситуации.[44]
Для пациентов с сахарным диабетом характерен высокий процент развития неврозоподобных расстройств. Диабет нередко сопровождается астенической симптоматикой в виде повышенной утомляемости, снижения работоспособности, нарушений сна, головной боли, эмоциональной лабильности. Характерна повышенная возбудимость и истощаемость нервных процессов, когнитивные нарушения, обсессивные расстройства, раздражительность и гневливость, угнетённость, повышенная тревожность и боязливость, склонность застревать на различных эмоциональных конфликтах, своенравность, упрямство, некоторая интеллектуальная негибкость. Возможны также психопатоподобные нарушения.[44] Часто встречается неврастенический синдром. Истерические расстройства при сахарном диабете редки.[45]
Характерен высокий риск развития тревожных расстройств, симптоматика которых включает в себя самые различные вегетативные нарушения, панические атаки, фобии[46]. Нередко отмечаются депрессивные и ипохондрические проявления, высокий суицидальный риск.[44]
Выраженная депрессия может иметь место на протяжении всего заболевания, либо же депрессия может быть рекуррентным расстройством, при котором периоды депрессии чередуются с периодами хорошего самочувствия.[45] По данным международного мета-анализа (2001), популяция больных сахарным диабетом как минимум в 2 раза чаще подвержена депрессии (30—40%), чем здоровые люди. Многие пациенты с сахарным диабетом II типа испытывают повторные депрессивные эпизоды на протяжении периода наблюдения в 5 лет.[47]
Возможны парестезии, алгии, другие тягостные внутренние ощущения с сенестопатическим оттенком.[45] В некоторых случаях распознавание у пациентов депрессивных расстройств бывает затруднено по причине сходства их проявлений с проявлениями собственно сахарного диабета (в частности, астения, парестезии, болевой синдром). Парестезии в конечностях, ощущающиеся в виде жжения, покалывания, онемения, могут быть проявлением либо депрессии, либо диабетической полинейропатии.[47]
Может наблюдаться саморазрушающее поведение (нарушения диеты и др.)[48]; могут развиваться или усугубляться такие вредные привычки, как курение, злоупотребление алкоголем либо другими психоактивными веществами[40].
При сахарном диабете часто возникают психосексуальные нарушения; в частности, у многих мужчин с диабетом наблюдается эректильная дисфункция.[40]
Психические расстройства особенно выражены при длительном течении диабета с гипер- и гипогликемическими состояниями в анамнезе. Энцефалопатия может возникать у больных диабетом при отсутствии адекватного лечения психических и соматических расстройств, игнорировании имеющегося заболевания, несоблюдении предписываемых врачом рекомендаций. Повторные комы способствуют развитию острой и хронической энцефалопатии с нарастанием интеллектуально-мнестических нарушений и эпилептиподобными проявлениями. По мере утяжеления заболевания и нарастания органической симптоматики чисто астеническая симптоматика приобретает характер сочетания астении с дистимией или апатией.[44] У пациентов с энцефалопатией, вызванной диабетом, медленно прогрессирующий когнитивный дефицит является неизбежным. [45] Завершающей стадией может явиться формирование деменции.[44]
Собственно психотические расстройства при сахарном диабете встречаются нечасто. Могут иметь место делириозные, делириозно-аментивные и аментивные состояния, острая галлюцинаторная спутанность, возможны также психозы с шизофреноподобной симптоматикой. Встречаются и психотические расстройства типа прогрессивного паралича, псевдопаралича и т.п. Возможно и возникновение диссоциативных расстройств.[44]
У многих детей, рождённых женщинами, страдающими сахарным диабетом, обнаруживаются признаки умственной отсталости. Причиной её могут стать даже недиагностируемый лёгкий диабет и предиабет. При раннем возникновении заболевания у ребёнка может отмечаться замедление психического развития.[44]
Сердечно-сосудистые нарушения
Развитие у пациента, принимающего нейролептики, ожирения и липидных изменений создаёт повышенный риск возникновения сердечно-сосудистых заболеваний и их неблагоприятной динамики, что, в свою очередь, приводит к высокому риску смертности.[7]
Так, увеличение массы тела коррелирует с изменениями систолического артериального давления и относится к серьёзным факторам риска развития гипертонии.[7] По некоторым данным, развитие и неблагоприятные (смертельные) исходы ишемической болезни сердца у пациентов психиатрических стационаров могут быть связаны с высокой нейролептической нагрузкой.[31]
Как отмечают некоторые исследователи, стигматизация лиц с психическими расстройствами нередко затрудняет получение ими адекватного лечения соматических заболеваний, в том числе и артериальной гипертонии, в поликлиниках и непсихиатрических стационарах. Из-за наличия у многих больных когнитивных расстройств, возникающих вследствие психического заболевания, они часто не могут проявить необходимой настойчивости в поиске помощи по поводу гипертонии или же не соблюдают должным образом назначений врача. Таким образом, адекватного лечения эти пациенты зачастую не получают.[49]
Формирующаяся на фоне артериальной гипертензии дисциркуляторная энцефалопатия часто приводит к тяжёлым психическим последствиям, к изменению уровня ответа на психофармакотерапию и к изменениям социальной адаптации.[49]
При оценивании в исследовании CATIE (Clinical Antipsychotic Trials of Intervention Effectiveness) риска развития ишемической болезни сердца на протяжении 10 лет при приёме антипсихотиков обнаружилось, что повышенный риск развития ИБС связан с приёмом оланзапина и кветиапина, а при приёме рисперидона, зипразидона и типичного нейролептика перфеназина этот риск был ниже[16].
Профилактика и лечение
Хотя не существует общепринятых руководств, в медицинской литературе присутствуют различные рекомендации по профилактике и лечению метаболических побочных эффектов атипичных антипсихотиков.
Профилактика
Должна включать в себя, согласно различным рекомендациям:
- При первоначальном обследовании больного (до начала приёма нейролептиков) — сбор семейного и личного анамнеза с тщательным изучением наличия в семье случаев ожирения, сахарного диабета, артериальной гипертонии, сердечно-сосудистых заболеваний, дислипидемии[9], выяснением наличия или отсутствия у пациента сердечно-сосудистых заболеваний, курения, физической активности, диеты[4].
- Контролирование перед началом приёма нейролептиков и в процессе их приёма веса тела[1][25][50] и индекса массы тела[25][50], измерение объёма висцерального жира[51], окружности талии[9][24][51] и бёдер[51], уровня артериального давления[25][50][9], уровня глюкозы натощак (или гемоглобина A1c[36]) и уровней липидов в плазме крови[1][42][25][50]. В особенности это касается таких препаратов, как клозапин, оланзапин, кветиапин и зотепин.[1] Также важно перед началом приёма нейролептиков и в процессе их приёма измерить уровень аланинтрасферазы (АЛТ) и гамма-глутамилтрансферазы (ГГТ), чтобы выявить пациентов с высоким риском гепатотоксичности и жирового гепатоза. Аланинтрасфераза является предиктором нераспознанной патологии паренхимы печени, а повышенный уровень гамма-глутамилтрансферазы может коррелировать с сахарным диабетом 2-го типа, инсулинорезистентностью, алкоголизмом, ишемической болезнью сердца[4]. Уровень глюкозы натощак не должен превышать 126 мг/дл, гемоглобина A1c — не превышать 6,1%.[36] Желательно также измерять не только уровень глюкозы натощак, но и её уровень через 2 часа после приёма глюкозы.[12] У пациентов с факторами риска (семейный анамнез, избыточный вес) мониторинг уровня глюкозы следует проводить каждые 2—4 месяца.[36] Уровень холестерина липопротеинов низкой плотности у пациентов с хроническими психическими расстройствами и метаболическим синдромом не должен превышать 130 мг/дл, у пациентов с коморбидными соматическими заболеваниями (сахарный диабет 2-го типа, ишемическая болезнь сердца, аневризма брюшной аорты, структурная патология периферических артерий и др.) не должен превышать 100 мг/дл[4].
- Медленное наращивание дозы антипсихотика, которое позволяет частично предотвратить увеличение массы тела. Особенно важны при этом первые недели нейролептической терапии, так как предупредить рост массы тела значительно легче, чем снижать её в дальнейшем.[5]
- Выбор препарата с минимальным влиянием на прибавку веса при назначении антипсихотика.[23] Сопоставление пользы от уже принимаемого антипсихотика и риска ожирения — если последний перевешивает, следует подумать о смене препарата.[42] По мнению Американской диабетической ассоциации, при повышении массы тела на 5% и более от исходной необходимо заменить принимаемый нейролептик другим препаратом этого класса, обладающим меньшим воздействием на развитие ожирения.[20] При переводе пациента с одного антипсихотика на другой следует осуществлять перекрёстное титрование, то есть постепенно снижать дозу одного антипсихотика и постепенно повышать дозу второго. Особенно осторожно нужно осуществлять отмену клозапина для предотвращения серьёзных психических последствий отмены.[52]
- Внимательное отношение к образу жизни и режиму питания пациента. Необходимо, чтобы питание было по возможности менее калорийным, а образ жизни посильно более активным. При этом диета и физические нагрузки требуют тщательного дозирования.[27] Рекомендуется уменьшение потребления насыщенных жиров и холестерина, увеличенное потребление волокнистой пищи. Также рекомендуется отказ от курения.[53]
- Мониторинг потребления алкоголя и сигарет[4].
- Направление пациента к диетологу и специалисту по лечебной физкультуре, если замечена существенная прибавка веса.[42]
- При приёме высоких доз нейролептиков — осторожный подход к сочетанию их с другими диабетогенными препаратами (бета-адреноблокаторы, глюкокортикоиды, ингибиторы протеаз, тиазидные диуретики).[1]
Лечение
- Эффективными средствами для снижения массы тела являются, по данным исследований, физические упражнения, рациональное питание и когнитивно-поведенческая терапия.[54] Из физических нагрузок рекомендуются, в частности, ходьба, плавание[55]. Диета должна быть умеренно калорийной (не более 1500—1800 килокалорий/сутки), не сопряжённой с жёсткими ограничениями, хорошо переносимой пациентами. При ожирении не следует добиваться идеальной массы тела: это трудновыполнимо, связано с значительными усилиями пациента и медицинскими затратами. Оптимальным будет снижение веса на 5—10%. Не следует форсировать и темпы снижения массы тела, достаточным считается уменьшение веса на 0,5—1 кг в неделю. Такие темпы снижения массы тела не только легче достигаются, но и, в отличие от стремительного похудения, дают более стойкий эффект.[27] При введении диеты желательно максимальное ограничение высококалорийных продуктов (богатых жирами и сахаром); умеренное потребление продуктов из белков и углеводов (крахмал); свободное потребление низкокалорийных продуктов.[56]
- Эффективным медикаментозным средством при избыточной массе тела является метформин[54][57], который снижает уровень и других факторов риска развития сердечно-сосудистых заболеваний (таких, как триглицериды) и может предотвращать развитие сахарного диабета 2-го типа или способствовать его отсрочке[57]; при этом метформин снижает массу тела только у пациентов с уже развившимся ожирением и не предотвращает развитие ожирения у пациентов, принимающих антипсихотики[4]. Доказана также, хотя и в меньшей степени, эффективность при ожирении топирамата, но его приём в исследованиях сопровождался частыми побочными эффектами, в том числе усилением симптомов психоза; отмечалось большое количество лекарственных взаимодействий[54]. В ряде стран (в том числе страны Европы и США) одобрен к применению при ожирении препарат орлистат[14]. Есть данные и в пользу применения при ожирении агониста дофаминовых рецепторов амантадина; H2-блокатора низатидина[42][58]; ингибиторов обратного захвата норадреналина[42]. По результатам мета-анализа 32 РКИ был предложен следующий ряд препаратов, которые способны снижать массу тела у пациентов с ожирением, развившимся на фоне приёма антипсихотиков (препараты расположены в порядке убывания их способности снижать массу тела у этих пациентов): метформин, D-фенфлурамин, сибутрамин, топирамат, ребоксетин, амантадин, низатидин, орлистат, комбинация метформина и сибутрамина, фамотидин, декстроамфетамин, флуоксетин, розиглитазон[4].
- При тяжёлом ожирении может применяться бариатрическая хирургия[57]. Как правило, она рекомендуется пациентам с патологическим ожирением и ИМТ в диапазоне 35—39 кг/м2, у которых присутствует хотя бы одно коморбидное заболевание, или пациентам с ИМТ более 40 кг/м2 без коморбидных заболеваний[4].
- Так как на массу тела может влиять повышенный уровень пролактина у лиц, принимающих нейролептики (в том числе путём влияния пролактина на водно-солевой обмен и обмен веществ, что приводит к задержке жидкости в организме), рекомендуется при увеличении массы тела измерить уровень пролактина в плазме крови и при обнаружения гиперпролактинемии — концентрацию половых гормонов и объём суточной мочи. Терапия при гиперпролактинемии проводится агонистами дофамина (бромокриптин, каберголин). При выявлении отёков (количество потребляемой жидкости превышает количество выделяемой) целесообразно включать в схему лечения также диуретические препараты (например, диакарб).[59]
- Если развившееся у пациента ожирение не поддаётся коррекции, можно снизить дозировку нейролептика или поменять один антипсихотик на другой.[5] В случае невозможности подобрать адекватную альтернативу принимаемому препарату врач должен информировать об этом пациента и обсудить с ним риски и преимущества продолжения, обрыва терапии и смены дозировки нейролептика.[27]
- При назначении пациентам с повышенным давлением гипотензивных средств следует добиваться, чтобы артериальное давление не превышало 140/80 мм рт. ст., а при назначении пациентам с дислипидемией диеты или статинов нужно добиваться, чтобы уровень холестерина липопротеинов низкой плотности натощак был менее 3 ммоль/л, холестерина липопротеинов высокой плотности — выше 1 ммоль/л, триглицеридов — ниже 20 ммоль/л[4]. В некоторых недавних исследованиях польза статинов подвергается сомнению: так, проведённый в 2013 году повторный анализ РКИ, рекомендовавшего людям с невысоким риском сердечно-сосудистых заболеваний принимать для повышения продолжительности жизни статины, показал, что их терапевтический эффект незначителен и предполагаемую их пользу перевешивает риск тяжёлых побочных действий — диабета и миопатии[60].
- Для предупреждения развития опасных для жизни состояний, связанных с сахарным диабетом (ацидоз и кома), необходимо заблаговременно распознавать и начинать лечение развивающегося диабета. Психиатры при терапии клозапином, оланзапином, кветиапином, зотепином должны проявлять настороженность в отношении таких симптомов диабета, как потеря массы тела, сонливость, жажда, полиурия[1], при необходимости обеспечивать своему пациенту консультацию эндокринолога[36]. Медикаментозное лечение диабета можно осуществлять только после консультации эндокринолога[55].
- Пациентов с диагностированным диабетом, нарушениями липидного обмена или гиперинсулинемией следует переводить на атипичные антипсихотики, минимально влияющие на развитие метаболических расстройств (амисульприд, арипипразол). Если смена терапии приводит к обострению психического расстройства, нужно применять минимальные дозы применявшихся прежде препаратов, постоянно контролируя при этом массу тела, уровень глюкозы в крови натощак и концентрации инсулина и липидов.[1]
См. также
Примечания
- Melkersson K, Dahl M-L. Метаболические нарушения на фоне терапии атипичными антипсихотиками (реферат) // Психиатрия и психофармакотерапия. — 2006. — Т. 11, № 2. Архивировано 2 февраля 2013 года.
- Ястребов Д.В. Метаболические нарушения при терапии антипсихотическими препаратами: рекомендации по диагностике и подбору терапии (обзор литературы) // Неврология. Психиатрия. — 10 ноября 2005. — № 22. Архивировано 10 ноября 2012 года.
- Снедков Е.В. Атипичные антипсихотики: поиск решения старых и новых проблем // Психиатрия и психофармакотерапия. — 2006. — Т. 8, № 4. Архивировано 3 января 2013 года.
- Алфимов П.В., Рывкин П.В., Ладыженский М.Я., Мосолов С.Н. Метаболический синдром у больных шизофренией (обзор литературы) // Современная терапия психических расстройств. — 2014. — № 3. — С. 8—14.
- Дробижев М.Ю. Кардиологические аспекты проблемы переносимости и безопасности нейролептика // Психиатрия и психофармакотерапия. — 2004. — Т. 6, № 2. Архивировано 7 ноября 2011 года.
- Бурчинский С.Г. Проблема безопасности в стратегии фармакотерапии атипичными нейролептиками // Нейро News: психоневрология и нейропсихиатрия. — Сентябрь 2010. — № 5 (24). (недоступная ссылка)
- Мазаева Н.А. Риски и преимущества применения атипичных антипсихотиков в психиатрии (по данным зарубежных публикаций последних лет) // Психиатрия и психофармакотерапия. — 2006. — Т. 8, № 5. Архивировано 3 января 2013 года.
- Мазо Г.Э., Шманева Т.М. Метаболический синдром у пациентов с биполярным расстройством // Обозрение психиатрии и медицинской психологии. — 2012. — № 2. Архивировано 14 октября 2014 года.
- Абрамова Л.И. К вопросу физического здоровья больных шизофренией в условиях нейролептической терапии // Современная терапия в психиатрии и неврологии. — 2012. — Вып. № 2. — С. 5—9.
- Мосолов С.Н., Рывкин П.В., Сердитов О.В. Метаболические нарушения при лечении больных шизофренией // Современная терапия психических расстройств. — 2008. — № 3. Архивировано 28 декабря 2013 года.
- Мкртумян А.М., Бирюкова Е.В., Маркина Н.В., Гарбузова М.А. Уникальные эффекты метформина в лечении метаболического синдрома // Русский медицинский журнал. — 2009. — № 10. — С. 692—697.
- Шишкова В.Н. Взаимосвязь развития метаболических и когнитивных нарушений у пациентов с сахарным диабетом, предиабетом и метаболическим синдромом // Неврология/ревматология, приложение consilium medicum. — 2010. — № 1. — С. 22—29. Архивировано 20 декабря 2013 года.
- Шестакова М.В., Дедов И.И. Пути профилактики сахарного диабета типа 2 // Сахарный диабет. — 2002. — Вып. 4.
- Green AI, Patel JK, Goisman RM, Allison DB, Blackburn G. Weight gain from novel antipsychotic drugs: need for action // Gen Hosp Psychiatry. — 2000 Jul-Aug. — Vol. 22, no. 4. — P. 224-35. — PMID 10936629. На русском: Прибавка в весе, связанная с новыми нейролептиками: необходимость коррекции.
- Денисов Е.М. Метаболический синдром у больных шизофренией: роль антипсихотиков. Сообщение 1 // Журнал психиатрии и медицинской психологии. — Редакционно-издательский отдел Донецкого национального медицинского университета им. М. Горького, 2010. — № 1—2 (24—25). — С. 151—160.
- Rummel-Kluge C., Komossa K., Schwarz S., Hunger H., Schmid F., Lobos C. A., Kissling W., Davis J. M., Leucht S. Head-to-head comparisons of metabolic side effects of second generation antipsychotics in the treatment of schizophrenia: a systematic review and meta-analysis. (англ.) // Schizophrenia Research. — 2010. — November (vol. 123, no. 2-3). — P. 225—233. — doi:10.1016/j.schres.2010.07.012. — PMID 20692814.
- Newcomer JW. Second-generation (atypical) antipsychotics and metabolic effects: a comprehensive literature review // CNS Drugs. — 2005. — Т. 19 Suppl 1. — С. 1—93. — PMID 15998156.
- Скугаревский О.А. Антипсихотическая терапия: новые направления разработки уникальных препаратов // Психиатрия, психотерапия и клиническая психология. — 2013. — № 3 (13). Архивировано 17 июня 2015 года.
- Musil R, Obermeier M, Russ P, Hamerle M. Weight gain and antipsychotics: a drug safety review // Expert Opin Drug Saf. — 2015 Jan. — Т. 14, № 7. — С. 73—96. — doi:10.1517/14740338.2015.974549. — PMID 25400109.
- Юнилайнен О.А., Старостина Е.Г. Влияние антипсихотических препаратов на обмен веществ // Ожирение и метаболизм. — 2012. — № 3. — С. 11—13.
- Нейроэндокринные побочные эффекты нейролептиков и их коррекция. Научно-методический центр эндокринологии Московского НИИ психиатрии Росздрава РФ. Дата обращения: 3 июня 2013.
- Bak M, Fransen A, Janssen J, van Os J, Drukker M. Almost all antipsychotics result in weight gain: a meta-analysis // PLoS One. — 2014 Apr 24. — Vol. 9, no. 4. — P. e94112. — doi:10.1371/journal.pone.0094112. — PMID 24763306.
- Виршинг Д.А. Шизофрения и ожирение: влияние антипсихотических препаратов // Социальная и клиническая психиатрия. — Москва, 2007. — Т. 17, вып. 4. Архивировано 12 марта 2012 года.
- Гурович И.Я., Любов Е.Б. Сероквель в ряду других антипсихотиков при лечении больных шизофренией // Русский медицинский журнал. — 2008. — № 12. — С. 1705—1710.
- Мосолов С.Н., Рывкин П.В., Сердитов О.В., Ладыженский М.Я., Потапов А.В. Метаболические побочные эффекты современной антипсихотической фармакотерапии // Социальная и клиническая психиатрия. — Москва, 2008. — Т. 18, вып. 3. — С. 75—90. Архивировано 12 марта 2012 года.
- Михайлова Н.М., Сиряченко Т.М. Плохой сон — жалобы, симптомы и лечение // Русский медицинский журнал. — 2007. — № 6. — С. 524—532. Архивировано 4 февраля 2015 года.
- Горобец Л.Н. Эндокринные побочные эффекты нейролептической терапии. — Общероссийская общественная организация инвалидов вследствие психических расстройств и их семей «Новые возможности». IV межрегиональное совещание. 17—20 апреля. Москва, 2005. Дата обращения: 6 ноября 2011.
- Уайтмер Р. {{{заглавие}}} // Diabetes Voice. — 2008. — Т. 53, вып. 1. Перевод на русский: Болезнь Альцгеймера, деменция и диабет — где связь?
- Nasrallah H. A. Atypical antipsychotic-induced metabolic side effects: insights from receptor-binding profiles. (англ.) // Molecular psychiatry. — 2008. — Vol. 13, no. 1. — P. 27—35. — doi:10.1038/sj.mp.4002066. — PMID 17848919.
- Развитие дислипидемии при лечении антипсихотиками не зависит от массы тела (недоступная ссылка). Дата обращения: 28 декабря 2014. Архивировано 30 декабря 2014 года. Источник: Journal of Clinical Psychopharmacology. — 2008. — Vol. 28, № 2. P. 132—137.
- Рыбакова С.В. Влияние психотропных средств на липидный обмен и исходы сердечно-сосудистых заболеваний у психически больных (клинико-экспериментальное исследование) / Автореферат диссертации на соискание ученой степени кандидата медицинских наук. — Казань, 2008.
- Мосолов С.Н., Капилетти С.Г., Шафаренко А.А. Российское мультицентровое эпидемиологическое исследование по оценке нарушений обмена глюкозы и других проявлений метаболического синдрома у больных шизофренией // Биологические методы терапии психических расстройств (доказательная медицина — клинической практике) / Под ред. С.Н. Мосолова. — Москва : Издательство «Социально-политическая мысль», 2012. — С. 863—884. — 1080 с. — 1000 экз. — ISBN 978-5-91579-075-8.
- Цыганков Б.Д., Агасарян Э.Г. Современные и классические антипсихотические препараты: сравнительный анализ эффективности и безопасности // Психиатрия и психофармакотерапия. — 2006. — Т. 8, № 6. Архивировано 8 декабря 2012 года.
- Шагиахметов Ф.Ш. Атипичные антипсихотики: больше сходств или различий? Теоретические предпосылки (Часть 2) // Современная терапия в психиатрии и неврологии. — 2014. — № 2. — С. 4—9.
- Горобец Л.Н. Нейроэндокринные дисфункции у больных шизофренией // Социальная и клиническая психиатрия. — 2005. — Т. 15, № 1.
- Маляров С. А.; подг. М. Добрянская. Побочные реакции антипсихотических средств // Нейро News: психоневрология и нейропсихиатрия. — Январь 2010. — № 1 (20).
- Chabroux S, Haffen E, Penfornis A. Diabetes and second-generation (atypical) antipsychotics // Ann Endocrinol (Paris). — 2009 Sep. — Т. 70, № 4. — С. 202—210. — doi:10.1016/j.ando.2009.07.003. — PMID 19700142.
- Данилов Д.С. Дифференцированное применение современных антипсихотических средств при лечении шизофрении // Журнал неврологии и психиатрии им. С.С.Корсакова. — 2009. — № 4. Архивировано 8 сентября 2014 года.
- Nielsen RE, Laursen MF, Vernal DL et al. Risk of Diabetes in Children and Adolescents Exposed to Antipsychotics: A Nationwide 12-Year Case-Control Study // J Am Acad Child Adolesc Psychiatry. — 2014 Sep. — Т. 53, № 9. — С. 971—979. — doi:10.1016/j.jaac.2014.04.023. — PMID 25151420.
- Панькив В.И. Психиатрические аспекты сахарного диабета // Новости медицины и фармации. — 2011. — № 383.
- Абрамова Л.И. К вопросу физического здоровья больных шизофренией в условиях нейролептической терапии // Современная терапия в психиатрии и неврологии. — 2012. — № 2. — С. 5—9.
- Lehman AF, Lieberman JA, Dixon LB, McGlashan TH, Miller AL, Perkins DO, Kreyenbuhl J. Practice Guideline for the Treatment of Patients With Schizophrenia. — 2nd ed. — American Psychiatric Association, 2004. Перевод фрагмента: Применение нейролептиков при шизофрении // Стандарты мировой медицины. — 2005. — № 2/3. — С. 83—112. Архивировано 25 сентября 2013 года.
- Тиганов, А. С., Снежневский А. В., Орловская Д. Д. и другие. Руководство по психиатрии / Под ред. А. С. Тиганова. — М.: Медицина, 1999. — Т. 2. — 10 000 экз. — ISBN 5-225-02676-1.
- Безбах В.Н. Стратегия лечения и особенности клиники психических расстройств и психосоциальных проблем у больных сахарным диабетом. Социально-психиатрические аспекты сахарного диабета // Международный эндокринологический журнал. — 2005. — № 1(1).
- Елфимова Е.В., Елфимов М.А. Сахарный диабет и психика: этиопатогенетические взаимосвязи // Заместитель главного врача. — 2008. — № 3. Архивировано 20 декабря 2013 года.
- Старостина Е.Г. Нетяжелые психические расстройства у больных сахарным диабетом // Consilium medicum. — 2011. — Т. 13, № 12. (недоступная ссылка)
- Воробьева О.В. Депрессия у больных сахарным диабетом второго типа // Медицинский вестник. — 15 апреля 2013. — № 11 (624). Архивировано 25 апреля 2013 года.
- Старшенбаум Г.В. Психосоматика и психотерапия: Исцеление души и тела. — Москва: Издательство Института психотерапии, 2005. — 496 с. — (Золотой фонд психотерапии). — ISBN 5-89939-125-1.
- Подвигин С.Н., Ширяев О.Ю., Шаповалов Д.Л., Кузнецова Н.А., Фролова А.И. Клинические и терапевтические особенности амбулаторных больных шизофренией, коморбидной с артериальной гипертензией // Научно-медицинский вестник Центрального Черноземья. — I квартал 2009. — № 35. (недоступная ссылка)
- Психиатрия. Национальное руководство / Под ред. Дмитриевой Т.Б., Краснова В.Н., Незнанова Н.Г., Семке В.Я., Тиганова А.С. — Москва: ГЭОТАР-Медиа, 2011.
- Атипичные нейролептики — есть риски, но есть и преимущества // Московская областная психиатрическая газета. — Февраль 2007 г. — № 2 (29). Архивировано 18 мая 2015 года.
- American Association of Clinical Endocrinologists., North American Association for the Study of Obesity. Consensus development conference on antipsychotic drugs and obesity and diabetes. (англ.) // Diabetes Care. — 2004. — February (vol. 27, no. 2). — P. 596—601. — doi:10.2337/diacare.27.2.596. — PMID 14747245.
- Hert MD, Schreurs V, Vancampfort D, Van Winkel R. Метаболический синдром у лиц, страдающих шизофренией: обзор // Всемирная психиатрия. — февраль 2009. — Т. 8, № 1. — С. 22—31. Архивировано 7 мая 2012 года.
- Руководство по лечению шизофрении: Подг. С. Костюченко на основе национального клинического руководства Шотландской межуниверситетской сети по созданию клинических руководств (2013) // Нейро News: психоневрология и нейропсихиатрия. — 2013. — № 6 (51).
- Рациональная фармакотерапия в психиатрической практике: руководство для практикующих врачей / Под общ. ред. Ю. А. Александровского, Н. Г. Незнанова. — Москва: Литтерра, 2014. — 1080 с. — (Рациональная фармакотерапия). — ISBN 978-5-4235-0134-1.
- Горобец Л.Н. Методы профилактики и лечения побочных эндокринных эффектов нейролептических препаратов // Новые возможности. — Москва, 2006.
- Chwastiak L, Tek C. Должны ли врачи-психиатры лечить ожирение у своих пациентов? / Перевод статьи М.Ю.Даниловой, под ред. М.К.Резникова // Дневник психиатра. — 2014. — № 4. — С. 6—8. Оригинал публикации: World Psychiatry 2014; 13 (2): 193–5.
- Горобец Л.Н. Нейроэндокринные побочные эффекты антипсихотических препаратов: итоги и перспективы // Психофармакология и биологическая наркология. — 2008. — Т. 8, № 1—2—1.
- Горобец Л.Н. Диагностика, коррекция и профилактика нейроэндокринных дисфункций у больных шизофренией в условиях современной антипсихотической фармакотерапии // Биологические методы терапии психических расстройств (доказательная медицина — клинической практике) / Под ред. С.Н. Мосолова. — Москва : Издательство «Социально-политическая мысль», 2012. — С. 830—862. — 1080 с. — 1000 экз. — ISBN 978-5-91579-075-8.
- Талантов, Пётр Валентинович. 0,05 : Доказательная медицина от магии до поисков бессмертия. — М. : АСТ : CORPUS, 2019. — 560 с. — (Библиотека фонда «Эволюция»). — ББК 54.1. — УДК 616. — ISBN 978-5-17-114111-0.
Литература
- Bak M, Fransen A, Janssen J et al. Almost all antipsychotics result in weight gain: a meta-analysis (англ.) // PLOS One. — Public Library of Science, 2014. — Vol. 9, no. 4. — doi:10.1371/journal.pone.0094112. — PMID 24763306.
- Lisi DM. Diabetes and the Psychiatric Patient // US Pharm. — 2010. — Т. 35, № 11. — С. 62—79.
- Rummel-Kluge C., Komossa K., Schwarz S., Hunger H., Schmid F., Lobos C. A., Kissling W., Davis J. M., Leucht S. Head-to-head comparisons of metabolic side effects of second generation antipsychotics in the treatment of schizophrenia: a systematic review and meta-analysis. (англ.) // Schizophrenia Research. — 2010. — November (vol. 123, no. 2-3). — P. 225—233. — doi:10.1016/j.schres.2010.07.012. — PMID 20692814.
- Кобалава Ж.Д., Толкачева В.В. Метаболический синдром: принципы лечения // Русский медицинский журнал. — 2005. — № 7. — С. 451—458. Архивировано 23 марта 2015 года.
Ссылки
- Диабет: Информационный бюллетень ВОЗ №312
- Определение метаболического синдрома Международной диабетической федерации. Подг. Л.М. Доборджгинидзе и Н.А. Грацианским.
- Увеличение массы тела и метаболический синдром. Сайт Med Check