Ритонавир
Ритонавир (Ritonavir, ранее известный как ABT-358) — антиретровирусный препарат, который используется вместе с другими лекарствами для лечения ВИЧ/СПИДа[1] (такое комбинированное лечение известно как высокоактивная антиретровирусная терапия) и вирусного гепатита С (ВГС) генотипа 4[2], продаётся под торговым названием Norvir. Низкие дозы ритонавира часто используются с другими ингибиторами протеазы. Его принимают перорально[1].
| Ритонавир | |
|---|---|
 | |
 | |
| Химическое соединение | |
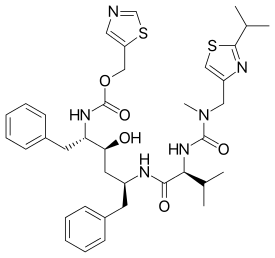
| ИЮПАК | 1,3-thiazol-5-ylmethyl N-[(2S,3S,5S)-3-hydroxy-5-[(2S)-3-methyl-2-{[methyl({[2-(propan-2-yl)-1,3-thiazol-4-yl]methyl})carbamoyl]amino}butanamido]-1,6-diphenylhexan-2-yl]carbamate |
| Брутто-формула | C37H48N6O5S2 |
| Молярная масса | 720.946 г/моль |
| CAS | 155213-67-5 |
| PubChem | 392622 |
| DrugBank | DB00503 |
| Состав | |
| Классификация | |
| АТХ | J05AE03 |
| Фармакокинетика | |
| Связывание с белками плазмы | 98-99% |
| Метаболизм | В печени |
| Период полувывед. | 3-5 часа |
| Экскреция | в основном с фекалиями |
| Способы введения | |
| oral | |
Типичные побочные эффекты включают тошноту, рвоту, потерю аппетита, диарею, онемение рук и ног. Серьёзные побочные эффекты включают проблемы с печенью, панкреатит, аллергические реакции, и нарушения сердечного ритма. Серьёзные взаимодействия могут возникнуть с рядом других препаратов, включая амиодарон и симвастатин[1]. В малых дозах допустимо применять во время беременности[3]. Ритонавир относится к классу ингибиторов протеаз[1], он часто используется, чтобы ингибировать фермент, который метаболизирует другие ингибиторы протеазы. Такое торможение (ингибирование) фермента приводит к повышению концентрации этих препаратов[4].
Ритонавир впервые вошёл в обиход в 1996 году[5]. Всемирной организацией здравоохранения препарат включён в Перечень основных лекарственных средств и наиболее важных лекарств, необходимых в основной системе здравоохранения[6]. Выпускается в форме капсул и таблеток. Оптовая цена колеблется между 0,07 и 2.20 USD в день.[7] В Соединённых Штатах ритонавир стоит от 9.20 до 55 USD в день в зависимости от дозы.[1]. С 2018 года входит в перечень ЖНВЛП.
История
Ритонавир производится под маркой Norvir компанией AbbVie, Inc. Управление по продовольствию и медикаментам (FDA) одобрило ритонавир 1 марта 1996 года[8], таким образом он стал седьмым утверждённым антиретровирусным препаратом и вторым одобренным ингибитором протеазы в Соединённых Штатах[9]. В течение двух лет после утверждения ритонавира (и саквинавира несколькими месяцами ранее), ВИЧ-ассоциированная смертность в США снизилась с более чем 50 тысяч человек в год до примерно 18 тысяч[10].
В 2003 году компания Abbott (сейчас AbbVie, Inc.) подняла цены на Norvir с $1,71 за день до $8.57 в сутки[11], что вызвало претензии о завышении цен от объединений пациентов и некоторых членов Конгресса. Группа потребителей обратилась в Национальные институты здравоохранения США (NIH), чтобы переопределить патент на Norvir, но 4 августа 2004 года должностные лица учреждения ответили, что они не обладает законным правом разрешить производство дженериков Норвира[12].
В 2014 году FDA одобрила комбинированный препарат Viekira Pak, одним из компонентов которого является ритонавир, для лечения вирусного гепатита С (ВГС) генотипа 4[2].
Медицинское использование
Ритонавир используется вместе с другими лекарствами для лечения ВИЧ/СПИДа[1] и гепатита С генотипа 4[2].
Побочные эффекты
В настоящее время (2015) препарат гораздо более широко используется в более низких дозах в качестве фармакокинетического ингибитора. Неблагоприятные последствия при относительно низких дозах ритонавира, не были подробно описаны[13]. При введении в дозах, эффективных для анти-ВИЧ терапии, побочные эффекты ритонавира указаны ниже:
- астения, недомогание;
- понос;
- тошнота и рвота;
- боли в животе;
- головокружение;
- бессонница;
- потливость;
- изменение вкусовых ощущений;
- метаболические
- гиперхолестеринемия;
- гипертриглицеридемия;
- повышение трансаминазы;
- повышение КФК;
Одним из побочных эффектов ритонавира является гипергликемия. Представляется, что ритонавир ингибирует инсулинзависимый белок-переносчик глюкозы GLUT4. Это может привести к инсулинорезистентности и вызвать проблемы у людей с диабетом 2-го типа.
Лекарственное взаимодействие
Совместная терапия ритонавиром и различными лекарствами может привести к серьёзным, в том числе смертельным последствиям[14].
Перечень клинически значимых взаимодействий ритонавира включает, но не ограничивается следующими препаратами:
- амиодарон — снижение метаболизма, возможная токсичность;
- мидазолам и триазолам — противопоказано;
- карбамазепин — снижение метаболизма, возможная токсичность;
- цизаприд — снижение метаболизма, возможно удлинение Q-Т интервала и появление опасных для жизни аритмий;
- дисульфирам (оральный препарат с ритонавиром — снижение метаболизма ритонавира;
- эплеренон;
- этравирин;
- флекаинид — снижение метаболизма, возможная токсичность;
- МДМА — снижение метаболизма, иногда приводит к токсичному исходу, например, серотониновому синдрому, который может быть опасным для жизни[15][16];
- мескалин;
- меперидин (петидин) — возможно накопление токсических концентраций норпетидина;
- нилотиниб;
- нисолдипин;
- фенитоин;
- пимозид;
- хинидин;
- ранолазин;
- салметерол;
- Зверобой;
- статины — снижение метаболизма, без изменения дозировок повышается риск рабдомиолиза (острого некроза скелетных мышц);
- тиоридазин;
- топотекан;
- вориконазол — ритонавир повышает метаболизм вориконазола.
Механизм действия
Ритонавир изначально разрабатывался как ингибитор ВИЧ-протеазы. Это один из самых сложных ингибиторов. На современном этапе собственная противовирусная активность ритонавира используется редко, но он по-прежнему широко используется в качестве бустера (усилителя) для других ингибиторов протеазы. Проще говоря, ритонавир используется для ингибирования фермента печени цитохрома Р450-3А4 (CYP3A4), который обычно метаболизирует и обезвреживает ингибиторы протеаз[17]. Препарат на молекулярном уровне ингибирует этот цитохром, потому низкие дозы можно использовать для усиления действия других ингибиторов протеаз. Это открытие резко снизило неблагоприятные эффекты и улучшило эффективность ингибиторов протеаз и ВААРТ, впервые описано в статье, опубликованной в журнале AIDS (ISSN 0269-9370) в 1997 году исследователями из Университета Ливерпуля[18].
Полиморфизм и временное изъятие с рынка
Изначально к препарату относились как к обычным капсулам, которые не требуют хранения в холодильнике[19], однако, как и многие другие препараты, ритонавир продемонстрировал полиморфизм, то есть его молекулы оказались способны образовывать более чем один тип кристалла. Различные кристаллы, или полиморфы, формируются из тех же молекул, но в различных взаимных положениях. Растворимость и, следовательно, биодоступность получались очень разными в зависимости от типа кристаллизации[20].
В ходе разработки (препарат был введен в 1996 году), изучалась только та форма, которая теперь называется полиморфной формой I, но в 1998 году была обнаружена более стабильная форма II. Это более стабильная (и, соответственно, менее растворимая) кристаллическая форма меняла биодоступность препарата. Это привело к удалению оральных капсул с рынка[20].
Даже следовые количества формы II могут катализировать превращение более биодоступной формы I в форму II. Таким образом, форма II угрожала существующим запасам ритонавира[19].
После этого открытия в конце 1990-х годов компания Abbott (сейчас AbbVie) сняла оригинальные капсулы с рынка, и рекомендовала пациентам переключиться на суспензию Norvir, в то время как исследователи работали, чтобы решить эту проблему. Обычные капсулы были заменены на желатиновые, с условием хранения в холодильнике, чтобы решить проблему кристаллизации исходного вещества.
В 2000 году американская химико-фармацевтическая корпорация Abbott (AbbVie) получила одобрение от FDA для таблетированного препарата Kaletra (так называемый Лопинавир/Ритонавир), который содержит ритонавир[21], не требующий охлаждения[22].
Исследование
В 2020 году было обнаружено, что комбинация фиксированных доз лопинавира / ритонавира не работает при тяжелой форме COVID-19. Испытание лекарства было начато примерно через тринадцать дней после появления симптомов[23].
Примечания
- Ritonavir. The American Society of Health-System Pharmacists. Дата обращения: 23 октября 2015.
- FDA approves Viekira Pak to treat hepatitis C. Food and Drug Administration (19 декабря 2014).
- Ritonavir Pregnancy and Breastfeeding Warnings. drugs.com. Дата обращения: 23 октября 2015.
- British National Formulary 69 (неопр.). — 69. — Pharmaceutical Pr, 2015. — С. 426. — ISBN 9780857111562.
- Hacker, Miles. Pharmacology principles and practice (неопр.). — Amsterdam: Academic Press/Elsevier, 2009. — С. 550. — ISBN 9780080919225.
- WHO Model List of EssentialMedicines. World Health Organization (октябрь 2013). Дата обращения: 22 апреля 2014.
- Ritonavir (недоступная ссылка). International Drug Price Indicator Guide. Дата обращения: 23 октября 2015. Архивировано 10 мая 2017 года.
- "FDA approves AIDS drug in record time", March 1, 1996. CNN International.
- Vassil St. Georgiev. National Institute of Allergy and Infectious Diseases, NIH. Volume 2: Impact on Global Health. (2009), p. 449.
- HIV Surveillance --- United States, 1981--2008. Дата обращения: 8 ноября 2013.
- Bridges, The Trade Round That Refuses to Die. Year 12 No.4 August 2008. ICTSD.
- Ceci Connolly. NIH Declines to Enter AIDS Drug Price Battle. Washington Post (5 августа 2004). Дата обращения: 16 января 2006.
- Norvir Архивировано 27 июня 2007 года., rxlist.com
- Ritonavir, Merck Manual
- Henry, J. A.; Hill, I. R. (1998).
- Papaseit, E.; Vázquez, A.; Pérez-Mañá, C.; Pujadas, M.; De La Torre, R.; Farré, M.; Nolla, J. (2012).
- Zeldin R. K., Petruschke R. A. Pharmacological and therapeutic properties of ritonavir-boosted protease inhibitor therapy in HIV-infected patients. (англ.) // The Journal of antimicrobial chemotherapy. — 2004. — Vol. 53, no. 1. — P. 4—9. — doi:10.1093/jac/dkh029. — PMID 14657084.
- Merry C., Barry M. G., Mulcahy F., Ryan M., Heavey J., Tjia J. F., Gibbons S. E., Breckenridge A. M., Back D. J. Saquinavir pharmacokinetics alone and in combination with ritonavir in HIV-infected patients. (англ.) // AIDS (London, England). — 1997. — Vol. 11, no. 4. — P. 29—33. — doi:10.1097/00002030-199704000-00001. — PMID 9084785.
- Bauer J., Spanton S., Henry R., Quick J., Dziki W., Porter W., Morris J. Ritonavir: an extraordinary example of conformational polymorphism. (англ.) // Pharmaceutical research. — 2001. — Vol. 18, no. 6. — P. 859—866. — doi:10.1023/A:1011052932607. — PMID 11474792.
- Morissette S. L., Soukasene S., Levinson D., Cima M. J., Almarsson O. Elucidation of crystal form diversity of the HIV protease inhibitor ritonavir by high-throughput crystallization. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2003. — Vol. 100, no. 5. — P. 2180—2184. — doi:10.1073/pnas.0437744100. — PMID 12604798.
- Ashish Chandwani, Jonathan Shuter. "Lopinavir/ritonavir in the treatment of HIV-1 infection: a review", Ther Clin Risk Manag. 2008 Oct; 4(5): 1023–1033. Published online 2008 Oct. doi: 10.2147/tcrm.s3285, PMCID: PMC2621403, PMID: 19209283.
- KALETRA FAQ. AbbVie's Kaletra product information. AbbVie (2011). Дата обращения: 5 июля 2014. Архивировано 7 июля 2014 года.
- Cao, Bin; Wang, Yeming; Wen, Danning; Liu, Wen; Wang, Jingli; Fan, Guohui; et al. (18 March 2020). "A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe Covid-19". New England Journal of Medicine. 382 (19): 1787–1799. doi:10.1056/NEJMoa2001282. PMC 7121492. PMID 32187464.
Ссылки
- Ritonavir (англ.). National Center for Biotechnology Information. Дата обращения: 1 марта 2016.
- Ritonavir (англ.). Drugs.com. Дата обращения: 1 марта 2016.
- Ритонавир (Ritonavir). rlsnet.ru. Дата обращения: 1 марта 2016.