Дарунавир
Дарунавир, DRV — антиретровирусное лекарственное средство для лечения ВИЧ и профилактики СПИД. Выпускается под торговой маркой Prezista.[1].
| Дарунавир | |
|---|---|
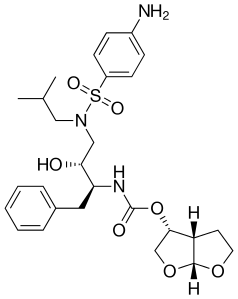 | |
| Химическое соединение | |
| ИЮПАК | [(1R,5S,6R)-2,8-dioxabicyclo[3.3.0]oct-6-yl] N-[(2S,3R)-4- [(4-aminophenyl)sulfonyl- (2-methylpropyl)amino]-3-hydroxy-1-phenyl- butan-2-yl] carbamate |
| Брутто-формула | C27H37N3O7S |
| CAS | 206361-99-1 |
| PubChem | 213039 |
| DrugBank | DB01264 |
| Состав | |
| Классификация | |
| АТХ | J05AE10 |
| Фармакокинетика | |
| Биодоступн. | 37% (без ритонавира), 82% (с ритонавиром) |
| Связывание с белками плазмы | 95% |
| Метаболизм | в печени (CYP3A4) |
| Период полувывед. | 15 часов (с ритонавиром) |
| Экскреция | Кал (80%), Моча (14%) |
| Способы введения | |
| Перорально | |
| Другие названия | |
| Презиста, TMC114 | |
Дарунавир часто используется в сочетании с другими антиретровирусными препаратами[1][2], комбинированный препарат дарунавира и кобицистата (Резолста) выпускается в виде одной таблетки[3].
Описание
Дарунавир был разработан для усиления взаимодействия с протеазой ВИЧ-1 и повышения устойчивости к мутациям протеазы ВИЧ-1[4].
На 2009 год в США и Великобритании затраты на здравоохранение при использовании усиленного дарунавира были ниже, чем при использовании других ингибиторов протеазы.
История
Дарунавир был одобрен для медицинского применения в США в 2006 г. и в Европейском Союзе в феврале 2007 года[1] [6] [7] [8] [9] [10] [6].
Первым ингибитором протеазы ВИЧ, одобренным FDA, был саквинавир, который был разработан для воздействия на протеазу дикого типа ВИЧ-1[11]. Однако этот ингибитор больше не эффективен из-за вызывающих резистентность мутаций в структуре протеазы ВИЧ-1. Геном ВИЧ обладает высокой пластичностью, поэтому он стал устойчивым ко многим ингибиторам протеазы ВИЧ-1[12]. После саквинавира FDA одобрило несколько PIs, включая дарунавир[9].
Медицинское использование
Дарунавир рекомендован Министерством здравоохранения и социальных служб США (DHHS) для лечения взрослых и подростков, независимо от того, получали ли они лечение от ВИЧ в прошлом[13]. В исследовании пациентов, которые никогда не получали лечения от ВИЧ, дарунавир был так же эффективен, как лопинавир/ритонавир, через 96 недель при дозировке один раз в день[14]. Дарунавир был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) 21 октября 2008 года для людей, ранее не лечившихся от ВИЧ[15]. Как и другие антиретровирусные препараты, Дарунавир не лечит ВИЧ/СПИД[16].
Дарунавир показан для лечения инфекции вируса иммунодефицита человека (ВИЧ-1) у взрослых и детей в возрасте от трех лет и старше при совместном применении с ритонавиром в сочетании с другими антиретровирусными средствами[2] [6].
Он часто используется с низкими дозами ритонавира или кобицистата для повышения уровня дарунавира[1]. Его можно использовать для профилактики после укола иглой или другого потенциального воздействия[1]. Дарунавир принимают перорально от одного до двух раз в день[1].
Побочные эффекты
Дарунавир обычно хорошо переносится людьми. Наиболее частым побочным эффектом (7% пациентов) является сыпь[16]. Другими частыми побочными эффектами являются диарея (2,3%), головная боль (3,8%), боль в животе (2,3%), запор (2,3%) и рвота (1,5%)[16]. Дарунавир также может вызывать аллергические реакции, и люди с аллергией на ритонавир также могут иметь реакцию на дарунавир[16].
Общие побочные эффекты включают диарею, тошноту, боли в области живота и таза, головную боль, сыпь и рвоту[1] [2]. Серьезные побочные эффекты включают аллергические реакции, проблемы с печенью и кожные высыпания, такие как токсический эпидермальный некролиз[1]. Несмотря на то, что действие препарата во время беременности мало изучен, он безопасен для ребенка[17]. Он относится к классу ингибиторов протеазы (PIs) и действует путем блокирования протеазы ВИЧ[1]. Дарунавир включен в Примерный перечень ВОЗ основных лекарственных средств[18].
Сообщалось о высоком уровне сахара в крови, диабете или обострении диабета, мышечной боли, болезненности или слабости, а также учащении кровотечений у людей с гемофилией у пациентов, принимающих лекарства с ингибиторами протеазы, такие как дарунавир[16]. У некоторых пациентов, принимающих лекарства от ВИЧ, наблюдались изменения в жировой ткани, включая потерю жира на ногах, руках и лице, увеличение жира в животе и других внутренних органах, увеличение груди и жировые образования на задней части шеи. Причины и долгосрочные последствия этих состояний для здоровья неизвестны[16].
Взаимодействие лекарственных средств
Дарунавир может взаимодействовать с лекарствами, обычно принимаемыми людьми с ВИЧ/СПИДом, такими как другие антиретровирусные препараты, и антацидами, такими как ингибиторы протонной помпы и Блокаторы H2-гистаминовых рецепторов[16]. Зверобой продырявленный может снизить эффективность дарунавира за счет увеличения расщепления дарунавира метаболическим ферментом CYP3A[16].
Примечания
- Darunavir. The American Society of Health-System Pharmacists. Дата обращения: 28 ноября 2016. Архивировано 10 ноября 2016 года.
- Prezista — darunavir. DailyMed (6 June 2019). Дата обращения: 21 апреля 2020.
- Darunavir / Cobicistat. AIDSinfo. U.S. Department of Health and Human Services.
- King, N. M. Structural and Thermodynamic Basis for the Binding of TMC114, a Next-Generation Human Immunodeficiency Virus Type 1 Protease Inhibitor : [англ.] / N. M. King, M. Prabu-Jeyabalan, E. A. Nalivaika … [et al.] // Journal of Virology. — 2004. — Vol. 78, no. 21. — P. 12012–12021. — doi:10.1128/JVI.78.21.12012-12021.2004. — PMID 15479840. — PMC 523255.
- Prezista EPAR. European Medicines Agency (EMA). Дата обращения: 21 апреля 2020.
- MacArthur, Rodger D (2007). "Darunavir: promising initial results". The Lancet. 369 (9568): 1143–1144. doi:10.1016/S0140-6736(07)60499-1. PMID 17416241. S2CID 31175809.
- FDA Approves New HIV Treatment for Patients Who Do Not Respond to Existing Drugs. Пресс-релиз. Архивировано из первоисточника 13 ноября 2016. Проверено 2021-04-01.
- HIV/AIDS Historical Time Line 2000 - 2010 (недоступная ссылка). U.S. Food and Drug Administration (5 January 2018). Дата обращения: 21 апреля 2020. Архивировано 1 июня 2019 года.
- Drug Approval Package: Prezista (Darumavir) NDA #021976. U.S. Food and Drug Administration (FDA) (6 September 2006). Дата обращения: 21 апреля 2020.
- Liu, F.; Kovalevsky, A.Y. (2008). “Effect of Flap Mutations on Structure of HIV-1 Protease and Inhibition by Saquinavir and Darunavir”. J. Mol. Biol. 381 (1): 102—115. DOI:10.1016/j.jmb.2008.05.062. PMC 2754059. PMID 18597780.
- Eron, J (2000). “HIV-1 Protease Inhibitors”. Oxford Journal of Clinical Infectious Diseases. 30: 160—170. DOI:10.1086/313853. PMID 10860901.
- Panel on Antiretroviral Guidelines for Adults and Adolescents (18 December 2019). “Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with HIV” (PDF). Department of Health and Human Services. Архивировано из оригинала (PDF) 2020-08-13. Дата обращения 21 April 2020. Lay summary. Используется устаревший параметр
|deadlink=(справка) - hivandhepatitis.com Архивировано 13 июля 2007 года., Efficacy and Safety of Boosted Darunavir (Prezista) Are Superior to Lopinavir/ritonavir (Kaletra) at 96 Weeks: ARTEMIS Trial, 2008-10-28, URL Архивировано 19 июля 2009 года..
- hivandhepatitis.com Архивировано 13 июля 2007 года., Darunavir (Prezista) Receives Full Traditional Approval, Dose Set for Treatment-naive Patients, Caution Urged for Pregnant Women, 2008-10-24, URL Архивировано 19 мая 2009 года..
- Drug Monograph, Prezista. Архивировано 11 ноября 2016 года.
- Darunavir (Prezista) Use During Pregnancy. Drugs.com (23 October 2018). Дата обращения: 21 апреля 2020.
- World Health Organization model list of essential medicines: 21st list 2019. — Geneva : World Health Organization, 2019. — ISBN WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
