Даклатасвир
Даклатасвир (англ. daclatasvir, ранее BMS-790052, торговое название Daklinza) — препарат для лечения гепатита С (HCV)[1]. Разработан компанией Bristol-Myers Squibb.
| Даклатасвир | |
|---|---|
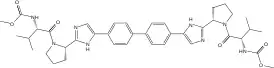 | |
| Общие | |
| Систематическое наименование |
Диметил N,N'-(бифенил-4,4'-диилбис'"`UNIQ--nowiki-00000000-QINU`"'{1H-имидазол-5,2-диил-((2S)-пирролидин-2,1-диил)((1S)-1-(1-метилэтил)-2-оксоэтан-2,1-диил)})дикарбамат |
| Хим. формула | C40H50N8O6 |
| Физические свойства | |
| Молярная масса | 738,88 г/моль |
| Классификация | |
| Рег. номер CAS | 1009119-64-5 |
| PubChem | 25154714 |
| SMILES | |
| InChI |
|
| ChEBI | 82977 |
| ChemSpider | 24609522 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Даклатасвир является пангенотипичным ингибитором белка NS5A[2][3], I волны I поколения. Недавние исследования свидетельствуют о том, что он нацелен на два этапа процесса вирусной репликации, позволяя быстро снижать количество РНК вируса гепатита C[4].
Даклатасвир был испытан в сочетании как с пэгилированным интерфероном и рибавирином[5], так и в сочетании с противовирусными препаратами прямого действия асунапревир[6][7][8][9], симепревирFDA, беклабувир и софосбувирFDA[10][11] [12]. Даклатасвир в сочетании с софосбувиром одобрен для лечения всех генотипов вируса гепатита С.
Даклатасвир был одобрен для использования в Европейском Союзе в 2014 году, а также в США и Индии в 2015 году[13].
Всемирная организация здравоохранения включила препарат даклатасвир в Перечень основных и наиболее важных лекарств, необходимых в системе здравоохранения[14] [15]. С 2018 года входит в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП).
В различных странах бренд Daklinza был отозван американской фармацевтической компанией Bristol Myers Squibb (BMS); также BMS позволило аннулировать патенты в этих странах[16]. В Индии BMS заключила договор с компанией Zydus Cadila на производство даклатасвира под торговой маркой DaciHep[17].
Медицинское использование
Даклатасвир используется только в составе комбинированной терапии для лечения гепатита С генотипа 1, 3 или 4 инфекции; агенты, используемые в комбинации, которые включают софосбувир, рибавирин и интерферон, различаются в зависимости от генотипа вируса и наличия у человека цирроза[18] [12] [19].
Неизвестно, проникает ли даклатасвир в грудное молоко или оказывает какое-либо влияние на младенцев[18].
Применение
Даклатасвир принимают внутрь один раз в день[1].
Противопоказания
Общие побочные эффекты софусбивира и даклатасвира включают головную боль, переутомление и тошноту[18].
Наиболее частыми побочными эффектами даклатасвира, софусбивира и рибавирина являются головная боль, чувство усталости, тошнота и гемолитическая анемия[18]. Его нельзя использовать с зверобоем, рифампицином или карбамазепином[1]. Он работает путем ингибирования белка NS5A HCV[12].
При использовании даклатасвира с софосбувиром и амиодароном существует серьезный риск брадикардии[18]. Поскольку он не был широко изучен как отдельный агент, неизвестно, какие конкретные побочные эффекты связаны только с этим лекарством. О нежелательных явлениях при приеме даклатасвира сообщалось только при комбинированной терапии софусбивиром или тройной терапии софусбивиром / рибавирином[18].
Общие побочные эффекты, возникающие у >5% людей, получающих комбинированную терапию (софусбивир + даклатасвир), включают головную боль и переутомление; при тройной терапии (даклатасвир + софусбивир + рибавирин) наиболее частыми побочными эффектами (> 10%) являются головная боль, усталость, тошнота и гемолитическая анемия[18].
Даклатасвир может вызвать реактивацию гепатита B у людей, коинфицированных вирусами гепатита B и C. Европейское агентство лекарственных средств (EMA) рекомендовало обследовать всех людей на гепатит B перед началом приема даклатасвира на гепатит C, чтобы минимизировать риск реактивации гепатита B[20].
Взаимодействие с другими препаратами
Изменения доз производятся при одновременном применении Даклатасвира и препаратов, влияющих на CYP3A или P-гликопротеин. При приеме даклатасвира с ненуклеозидными ингибиторами обратной транскриптазы доза даклатасвира увеличивается, чтобы преодолеть индукцию CYP3A[21].
Дозу даклатасвира следует снизить при приеме с противогрибковыми средствами, такими как Кетоконазол. В настоящее время не требуется корректировки дозировки при одновременном применении даклатасвира и иммунодепрессантов, наркотических анальгетиков, антидепрессантов, седативных средств и сердечно-сосудистых средств[21].
Одновременное применение с амиодароном, софосбувиром и даклатасвиром может привести к повышенному риску серьезного замедления сердечного ритма[18].
Примечания
- "Daclatasvir Dihydrochloride". The American Society of Health-System Pharmacists. Archived from the original on 5 November 2016. Retrieved 6 December 2016.
- Gao M., Nettles R. E., Belema M., Snyder L. B., Nguyen V. N., Fridell R. A., Serrano-Wu M. H., Langley D. R., Sun J. H., O'Boyle D. R. 2nd, Lemm J. A., Wang C., Knipe J. O., Chien C., Colonno R. J., Grasela D. M., Meanwell N. A., Hamann L. G. Chemical genetics strategy identifies an HCV NS5A inhibitor with a potent clinical effect. (англ.) // Nature. — 2010. — Vol. 465, no. 7294. — P. 96—100. — doi:10.1038/nature08960. — PMID 20410884.
- Bell T. W. Drugs for hepatitis C: unlocking a new mechanism of action. (англ.) // ChemMedChem. — 2010. — Vol. 5, no. 10. — P. 1663—1665. — doi:10.1002/cmdc.201000334. — PMID 20821796.
- Modeling shows that the NS5A inhibitor daclatasvir has two modes of action and yields a shorter estimate of the hepatitis C virus half-life.
- AASLD: Daclatasvir with Pegylated Interferon/Ribavirin Produces High Rates of HCV Suppression Архивная копия от 18 мая 2015 на Wayback Machine.
- Preliminary Study of Two Antiviral Agents for Hepatitis C Genotype 1.
- Bristol-Myers' Daclatasvir, Asunaprevir Cured 77%: Study. Bloomberg (19 апреля 2012).
- AASLD: Daclatasvir plus Asunaprevir Rapidly Suppresses HCV in Prior Null Responders Архивная копия от 8 февраля 2015 на Wayback Machine.
- High rate of response to BMS HCV drugs in harder-to-treat patients — but interferon-free prospects differ by sub-genotype.
- AASLD 2012: Sofosbuvir + Daclatasvir Dual Regimen Cures Most Patients with HCV Genotypes 1, 2, or 3 Архивная копия от 18 мая 2015 на Wayback Machine
- Mark Sulkowski et al. Daclatasvir plus Sofosbuvir for Previously Treated or Untreated Chronic HCV Infection (англ.) // New England Journal of Medicine : journal. — 2014. — 16 January. — doi:10.1056/NEJMoa1306218.
- "Daklinza film-coated tablets - Summary of Product Characteristics (SPC) - (eMC)". Electronic Medicines Compendium. September 2016. Archived from the original on 2016-11-09.
- "Hepatitis C Treatment Snapshots: Daclatasvir" (PDF). amFAR TreatAsia. February 2016. Archived (PDF) from the original on 2016-09-03.
- 19th WHO Model List of Essential Medicines (April 2015) (англ.) (PDF). WHO. Дата обращения: 23 января 2016. Архивировано 13 мая 2015 года.
- World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- "Important information about the discontinuation of Daklinza". Bristol Myers Squibb. 9 March 2020. Retrieved 19 June 2020.
- Zydus Cadila inks pact with Medicines Patent Pool for Hepatitis C drug, The Economic Times. Дата обращения 1 декабря 2021.
- "Daclatasvir label" (PDF). FDA. April 2016. Archived (PDF) from the original on 2016-11-09.
- Pol, Stanislas; Vallet-Pichard, Anaïs; Corouge, Marion (March 2016). "Daclatasvir–sofosbuvir combination therapy with or without ribavirin for hepatitis C virus infection: from the clinical trials to real life". Hepatic Medicine: Evidence and Research. 8: 21–6. doi:10.2147/HMER.S62014. PMC 4786064. PMID 27019602.
- "Direct-acting antivirals indicated for treatment of hepatitis C (interferon-free)". European Medicines Agency (EMA). 17 September 2018. Retrieved 4 February 2020.
- Garimella, Tushar; You, Xiaoli; Wang, Reena; Huang, Shu-Pang; Kandoussi, Hamza; Bifano, Marc; Bertz, Richard; Eley, Timothy (2016-11-01). "A Review of Daclatasvir Drug-Drug Interactions". Advances in Therapy. 33 (11): 1867–1884. doi:10.1007/s12325-016-0407-5. ISSN 1865-8652. PMC 5083780. PMID 27664109.