Маравирок
Маравирок, продаваемый под торговыми марками Selzentry (США) и Celsentri (ЕС), представляет собой антиретровирусный препарат из класса антагонистов рецепторов CCR5, используемый для лечения ВИЧ-инфекции. Он также классифицируется как ингибитор проникновения. В исследовании фазы I / II было также показано, что он снижает частоту реакции «трансплантат против хозяина» (РТПХ) у пациентов, получавших аллогенную трансплантацию костного мозга по поводу лейкемии[3][4].
| Маравирок | |
|---|---|
 | |
 | |
| Химическое соединение | |
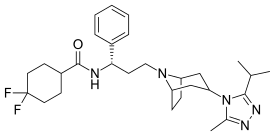
| ИЮПАК | 4,4-Difluoro-N-{(1S)-3-[3-(3-isopropyl- 5-methyl-4H-1,2,4-triazol-4-yl)-8-azabicyclo[3.2.1]oct-8-yl]-1-phenylpropyl}cyclohexanecarboxamide |
| Брутто-формула | C29H41F2N5O |
| CAS | 376348-65-1 |
| PubChem | 3002977 |
| DrugBank | DB04835 |
| Состав | |
| Классификация | |
| АТХ | J05AX09 |
| Фармакокинетика | |
| Биодоступн. | 23%[1] |
| Связывание с белками плазмы | ~76%[2] |
| Метаболизм | Печень (Цитохром P450, преимущественно CYP3A)[2] |
| Экскреция | Кал (76%), Моча (20%)[2] |
| Способы введения | |
| Перорально (Таблетки, пероральный раствор ) | |
История
Маравирок, первоначально обозначенный как UK-427857, был разработан фармацевтической компанией Pfizer в ее британских лабораториях, расположенных в Сануидже. 24 апреля 2007 года консультативная группа Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), рассмотревшая заявку на новое лекарственное средство Maraviroc, единогласно рекомендовала одобрение нового лекарства[5], а 6 августа 2007 года препарат получил полное одобрение FDA для использования в лечении опытных пациентов[6].
Маравирок был одобрен для медицинского применения в Европейском Союзе в сентябре 2007 года[7].
Наименование
Маравирок – это Международное непатентованное название (МНН)[8].
Медицинское использование
В двух рандомизированных плацебо-контролируемых клинических испытаниях сравнивали 209 человек, получавших оптимизированную терапию плюс плацебо, с 426 людьми, получавшими оптимизированную терапию плюс 150 мг маравирока один раз в день, и 414 пациентов, получавших оптимизированную терапию плюс 150 мг маравирока два раза в день. Через 48 недель 55% участников, получавших маравирок один раз в день, и 60% участников, получавших препарат два раза в день, достигли вирусной нагрузки менее 400 копий / мл по сравнению с 26% участников, принимавших плацебо; около 44% в группе маравирока, принимавшей один раз в день, и 45% в группе, принимавшей маравирок дважды в день, имели вирусную нагрузку менее 50 копий / мл по сравнению с примерно 23% тех, кто получал плацебо. Кроме того, у тех, кто получал ингибитор входа, среднее увеличение T-хелперы составило 110 клеток / мкл в группе, принимавшей один раз в день, 106 клеток / мкл в группе, принимавшей два раза в день, и 56 клеток / мкл в группе плацебо[9][10][11].
Побочные эффекты
Маравирок может вызывать серьезные, опасные для жизни побочные эффекты. К ним относятся проблемы с печенью, кожные реакции и аллергические реакции. Аллергическая реакция может возникнуть до того, как возникнут проблемы с печенью. Официальная маркировка Selzentry содержит предупреждение о гепатотоксичности в виде черного ящика[2]. Испытания MOTIVATE не показали клинически значимых различий в безопасности между группами маравирок и плацебо[9].
Механизм действия
Маравирок – ингибитор проникновения. В частности, маравирок является отрицательным аллостерическим модулятором рецептора CCR5, который находится на поверхности определенных клеток человека. Хемокиновый рецептор CCR5 является важным корецептором для большинства штаммов ВИЧ и необходим для процесса проникновения вируса в клетку-хозяин. Препарат связывается с CCR5, тем самым блокируя связывание белка gp120 ВИЧ с рецептором. В этом случае ВИЧ не может проникнуть в человеческие макрофаги и T-лимфоциты[12]. Поскольку ВИЧ может также использовать другие корецепторы, такие как CXCR4, необходимо провести тест на тропизм ВИЧ, такой как трофильный анализ, чтобы определить, будет ли лекарство эффективным[13].
Примечания
- Abel S, Russell D, Whitlock LA, Ridgway CE, Nedderman AN, Walker DK (April 2008). “Assessment of the absorption, metabolism and absolute bioavailability of maraviroc in healthy male subjects”. British Journal of Clinical Pharmacology. 65 (Suppl 1): 60—7. DOI:10.1111/j.1365-2125.2008.03137.x. PMC 2311408. PMID 18333867.
- Selzentry- maraviroc tablet, film coated Selzentry- maraviroc solution. DailyMed (18 July 2018). Дата обращения: 31 июля 2020.
- Ran Reshef, 2012.
- "HIV Drug Reduces Graft-versus-Host Disease in Bone Marrow Transplant Patients, Penn Study Shows". Penn Medicine (July 11, 2012). Дата обращения: 2 июля 2021.
- Aaron Smith. "FDA experts support Pfizer's AIDS drug". CNNMoney.com (April 24 2007). Дата обращения: 2 июля 2021.
- Lewis Krauskopf. "Pfizer wins U.S. approval for new HIV drug". Reuters (August 6, 2007). Дата обращения: 2 июля 2021.
- "Celsentri EPAR". European Medicines Agency (EMA) (2020). Дата обращения: 2 июля 2021.
- World Health Organization (2005). “International nonproprietary names for pharmaceutical substances (INN): recommended INN: list 53”. WHO Drug Information. 19 (1): 84–5. HDL:10665/73323. License: CC BY-NC-SA 3.0 IGO.
- Joan Stephenson, 2007.
- J. M. Emmelkamp, J. K. Rockstroh. "CCR5 antagonists: comparison of efficacy, side effects, pharmacokinetics and interactions--review of the literature". European Journal of Medical Research (October 15, 2007). Дата обращения: 2 июля 2021.
- "Maraviroc reduces viral load in naive patients at 48 weeks". AIDS Patient Care and STDs (September 21, 2007). Дата обращения: 2 июля 2021.
- Jay A. Levy, 2009.
- Priscilla Biswas, 2007.
Литература
- Ran Reshef, Selina M. Luger, Elizabeth O. Hexner, Alison W. Loren, Noelle V. Frey, Sunita D. Nasta. "Blockade of lymphocyte chemotaxis in visceral graft-versus-host disease" (англ.) // The New England Journal of Medicine (NEJM). — 2012. — Июль (№ 367 (2)). — С. 135–45. — doi:10.1056/NEJMoa1201248.
- Joan Stephenson. Researchers buoyed by novel HIV drugs: will expand drug arsenal against resistant virus (англ.) // Journal of the American Medical Association (JAMA). — 2007. — 1 апреля (№ 297 (14)). — С. 1535–6. — doi:10.1001/jama.297.14.1535.
- Jay A. Levy. "HIV pathogenesis: 25 years of progress and persistent challenges" (англ.) // AIDS. — 2009. — 1 января (№ 23 (2)). — С. 147–60. — doi:10.1097/QAD.0b013e3283217f9f.
- Priscilla Biswas, Giuseppe Tambussi, Adriano Lazzarin. "Access denied? The status of co-receptor inhibition to counter HIV entry" (англ.) // Expert Opinion on Pharmacotherapy. — 2007. — 1 мая (№ 8 (7)). — С. 923-933. — doi:10.1517/14656566.8.7.923.
