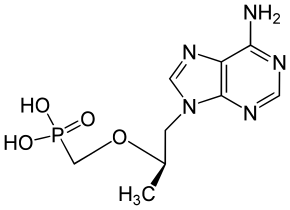
Тенофовир
Тенофовир (международная транскрипция TDF или TAF) — синтетический противовирусный препарат из группы нуклеозидных ингибиторов обратной транскриптазы для приема внутрь. Для перорального применения выпускается в виде соли дизопроксила фумарата или соединения с алафенамидом. Тенофовир был впервые синтезирован чешским учёным и изобретателем Антонином Голи, на который он получил патент в 1984 году.[1] В 1997 году группа ученых из компании «Gilead Sciences» и Калифорнийского университета в Сан-Франциско доказала эффективность тенофовира против ВИЧ у человека при подкожном применении.[2] В дальнейших исследованиях был разработан препарат тенофовир для перорального применения,[3] который и был утвержден FDA в октябре 2001 года для лечения ВИЧ-инфекции,[4] а в 2008 году — для лечения хронического вирусного гепатита B.[5]
| Тенофовир | |
|---|---|
 | |
 | |
| Химическое соединение | |
| Брутто-формула | C9H14N5O4P |
| CAS | 147127-20-6 |
| PubChem | 464205 |
| DrugBank | 14126 |
| Состав | |
| Классификация | |
| АТХ | J05AF07 |
Фармакологические свойства
Тенофовир — синтетический противовирусный препарат из группы нуклеозидных ингибиторов обратной транскриптазы. Механизм действия препарата заключается в образовании активного метаболита — тенофовира дифосфата, который ингибирует фермент ВИЧ обратной транскриптазы и ингибирует α-, β- и γ- ДНК-полимеразы. Тенофовир активен при лечении вируса иммунодефицита человека и вируса гепатита B,[6] поэтому препарат часто применяется при сочетанной инфекции ВИЧ и вирусного гепатита B. Согласно данным специалистов из американского Центра по контролю и профилактике заболеваний, ежедневный пероральный прием тенофовира позволяет уменьшить риск заражения ВИЧ-инфекцией, что особенно актуально для инъекционных наркоманов. Аналогичные данные получены при применении препарата тенофовир/эмтрицитабин.[7] При проведении клинических исследований в Таиланде применения тенофовира позволило уменьшить риск заражения вирусом ВИЧ на 49 %.[8] В то же время применение тенофовир в виде 10 % вагинального геля было признано неэффективным для предотвращения заражения ВИЧ.[9]
Фармакокинетика
Тенофовир при приеме внутрь быстро всасывается, максимальная концентрация в крови достигается в течение 1—2 часов. Биодоступность составляет 25 % при приеме натощак, после приема жирной пищи этот показатель увеличивается до 40 %. В клетках тенофовир фосфорилируется до активного метаболита — тенофовира дифосфата, что имеет удлиненный период полувыведения (60 часов из клеток).[10] Высокие концентрации тенофовира создаются в почках, печени, кишечнике. Препарат проникает через гемато-энцефалический барьер. Тенофовир проникает через плацентарный барьер и выделяется в грудное молоко. Препарат не метаболизируется в организме, выводится из организма преимущественно почками в неизмененном виде. Период полувыведения тенофовир составляет 12—18 часов, при нарушении функции почек это время может увеличиваться.
Показания к применению
Тенофовир применяют в составе комбинированной терапии для лечения ВИЧ-инфекции как у взрослых, так и у детей.[11] Тенофовир применяют также при лечении хронического гепатита В, а также в сочетании ВИЧ-инфекции и вирусного гепатита B. Комбинация тенофовира с энтекавиром эффективна у пациентов с неэффективностью предшествующего лечения другими схемами препаратов (в том числе аналогами нуклеозидов) вирусного гепатита В.[12]
В сочетании с эмтрицитабином используется для доконтактной профилактики ВИЧ-инфекции (ДКП/ПрЕП).
Побочное действие
При применении тенофовир возможны следующие побочные эффекты:
- Аллергические реакции — очень часто (более 10 %) высыпания на коже; редко (0,01—0,1 %) кожный зуд, лихорадка и гриппоподобный синдром, отек Квинке, анафилактический шок.
- Со стороны пищеварительной системы — очень часто (более 10 %) тошнота, рвота, диарея; часто (1—10 %) метеоризм (наблюдается чаще, чем при применении других антиретровирусных препаратов), снижение аппетита, боль в животе; нечасто (0,1—1 %) панкреатит, гепатит (в том числе обострение хронического гепатита В), гепатомегалия.
- Со стороны нервной системы — очень часто (более 10 %) головокружение; часто (1—10 %) головная боль.
- Со стороны опорно-двигательного аппарата — нечасто (0,1—1 %) слабость в мышцах, рабдомиолиз; редко (0,01—0,1 %) миопатии, артралгии, миалгии, миозит, остеомаляция.
- Со стороны мочевыделительной системы — хотя побочное действие со стороны мочевыделительной системы характерна для тенофовира, серьезные побочные эффекты наблюдаются редко. Часто наблюдается снижение клиренса креатинина (25 %) и повышение уровня креатинина в крови (9 %); редко (0,01—0,1 %) наблюдаются острая почечная недостаточность, синдром Фанкони, острый тубулярный некроз, интерстициальный нефрит, острый нефрит, нефрогенный несахарный диабет, протеинурия.
- Другие побочные эффекты — редко липодистрофия, лактатацидоз, одышка.
- Изменения в лабораторных анализах — очень часто (более 10 %) гипофосфатемия; часто (1—10 %) повышение активности аминотрансфераз в крови нечасто нейтропения, повышение активности амилазы в крови, гипокалиемия, глюкозурия, гипоурикемия.
- При проведении комбинированной антиретровирусной терапии у больных возрастает вероятность лактатацидоза и гепатонекроза. При проведении ВААРТ у больных возрастает вероятность развития гипертриглицеридемии, гиперхолестеринемии, инсулинорезистентности, гипергликемии и гиперлактемии. У больных, имеющих сочетанную инфекцию ВИЧ и вируса гепатита B, при отмене ламивудина могут развиваться мгновенное обострение гепатита со значительным повышением активности аминотрансфераз и вероятным развитием печеночной недостаточности. При проведении ВААРТ возрастает вероятность синдрома восстановления иммунной системы с обострением латентных ВИЧ-ассоциированных инфекций и обострения вирусного гепатита B.
Противопоказания
Тенофовир противопоказан при повышенной чувствительности к препарату, кормлении грудью. С осторожностью назначают при тяжелой почечной недостаточности.
Формы выпуска
Тенофовир выпускается в виде таблеток по 0,3 г. Утверждены новые формы выпуска тенофовира для использования на территории Европейского Союза — таблетки по 123, 163 и 204 мг и в виде гранул для перорального применения.[11] Тенофовир входит в состав комбинированных препаратов Трувада (вместе с эмтрицитабином), Атрипла (вместе с эмтрицитабином и эфавирензом) и Комплера (вместе с рилпивирином и эмтрицитабином). Компанией «Gilead Sciences» разработаны также препарат тенофовир в виде тенофовир алафенамида, права на выпуск которого переданы пяти индийским фармацевтическим компаниям.[13] На утверждение FDA компания «Gilead Sciences» передала также новый комбинированный препарат в составе тенофовира алафенамида, элвитегравира, кобицистата и эмтрицитабина для лечения ВИЧ-инфекции у взрослых.[14]
Примечания
- Patent US4808716 - 9-(phosponylmethoxyalkyl) adenines, the method of preparation and ... - Google Patents. (англ.)
- Deeks S.G., Barditch-Crovo P., Lietman P.S., et al. Safety, pharmacokinetics, and antiretroviral activity of intravenous 9-[2-(R)-(Phosphonomethoxy)propyl]adenine, a novel anti-human immunodeficiency virus (HIV) therapy, in HIV-infected adults (англ.) // Antimicrob. Agents Chemother. : journal. — 1998. — September (vol. 42, no. 9). — P. 2380—2384. — PMID 9736567. (англ.)
- Patent US5977089 - Antiviral phosphonomethoxy nucleotide analogs having increased oral ... - Google Patents. (англ.)
- http://www.fda.gov/cder/foi/appletter/2008/021356s025ltr.pdf (англ.)
- FDA Clears Viread for Hepatitis B (англ.)
- МедМир - медицинские журналы на русском языке
- Okwundu C.I., Uthman O.A., Okoromah CAN. Antiretroviral pre-exposure prophylaxis (PrEP) for preventing HIV in high-risk individuals (англ.) // Cochrane Database Syst Rev : journal. — 2012. — Vol. 7, no. 7. — P. CD007189. — doi:10.1002/14651858.CD007189.pub3. — PMID 22786505. (англ.)
- MEDdaily — новости медицины и медицинских технологий. Комментарии специалистов. Архив материалов
- Архивированная копия (недоступная ссылка). Дата обращения: 18 октября 2018. Архивировано 18 октября 2018 года. (рус.)
- Архивированная копия (недоступная ссылка). Дата обращения: 18 октября 2018. Архивировано 19 февраля 2018 года. (рус.)
- Архивированная копия (недоступная ссылка). Дата обращения: 18 октября 2018. Архивировано 18 октября 2018 года. (рус.)
- http://www.hv-info.ru/gepatit-novosti/issledovaniya/497-2013-12-02-21-23-59.html (рус.)
- Medpharmconnect.com
- Medpharmconnect.com