Топотекан
Топотекан — цитостатический препарат из группы камптотецинов. Является ингибитором топоизомеразы I.
| Топотекан | |
|---|---|
| Topotecan | |
 | |
| Химическое соединение | |
| ИЮПАК | (S)-10-[(диметиламино)-метил]-4-этил-4,9-дигидрокси-1Н-пирано[3',4':6,7] индолизино[1,2-b] хинолин-3,14[4н,12н]-дион (в виде гидрохлорида) |
| Брутто-формула | C23H23N3O5 |
| Молярная масса | 457.9 г/моль |
| CAS | 123948-87-8 |
| PubChem | 6419854 |
| DrugBank | APRD00687 |
| Состав | |
| Классификация | |
| АТХ | L01XX17 |
| Фармакокинетика | |
| Биодоступн. | NA |
| Связывание с белками плазмы | 35% |
| Метаболизм | Печень |
| Период полувывед. | 2-3 часа |
| Экскреция | Почки |
| Лекарственные формы | |
| порошок для приготовления раствора для инфузий | |
| Способы введения | |
| Intravenous infusion, oral | |
| Другие названия | |
| Гикамтин® | |
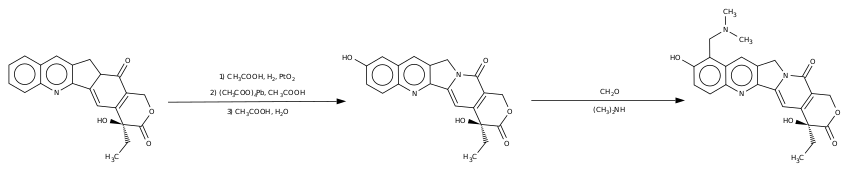
Топотекан - полусинтетический препарат, его синтезируют из камптотецина, алкалоида, содержащегося в растениях рода камптотека.
На первой стадии синтеза окислением хинолинового ядра получают гидроксипроизводное камптотецина, которое далее аминометилируют по Манниху с образованием топотекана:
Фармакологическое действие
Топотекан связывается с комплексом топоизомераза I-ДНК и предотвращает повторное сшивание нитей ДНК. Полагают, что цитотоксичность топотекана обусловлена повреждением удвоенной нити ДНК, образующейся в процессе её синтеза. При этом ферменты, участвующие в репликации, взаимодействуют с тройным комплексом, сформированным топотеканом, топоизомеразой I и ДНК.
Фармакокинетика
Распределение
При внутривенном введении топотекана взрослым в дозах 0.5-1.5 мг/м2 в виде 30-минутной ежедневной инфузии в течение 5 дней площадь под фармакокинетической кривой увеличивалась пропорционально увеличению дозы. Связывание топотекана с белками плазмы - 35 %. Распределение между клетками крови и плазмой достаточно однородно. Vd составляет около 130 л, что приблизительно в 3 раза выше общего содержания воды в организме.
Метаболизм
Топотекан подвергается метаболизму путём гидролиза лактонового кольца с образованием карбоновой кислоты в виде открытого кольца. В экспериментальных исследованиях у крыс определялось 5 %, а у собак 15 % дозы в виде N-деметилированного топотекана. В исследованиях in vitro топотекан не ингибировал человеческие изоферменты CYP1A2, CYP2A6, CYP2C8/9, CYP2C19, CYP2D6, CYP2E или CYP4A системы цитохрома Р450, а также не ингибировал человеческие цитозольные ферменты дигидропиримидин оксидазу или ксантин оксидазу.
Выведение
Клиренс топотекана - 64 л/ч, что составляет приблизительно 2/3 печеночного кровотока. Период полувыведения составляет 2-3 ч. 20-60 % дозы выводится с мочой в неизмененном виде и в виде метаболитов. У пациентов, участвующих в исследованиях, такие факторы как возраст, масса тела и наличие асцита не оказывали значительного влияния на клиренс.
Фармакокинетика в особых клинических случаях
У мужчин плазменный клиренс и Vd топотекана несколько больше, чем у женщин. Однако полученные различия были подобны разнице в площади поверхности тела. У пациентов с печеночной недостаточностью, по сравнению с контрольной группой пациентов, плазменный клиренс был пониженным приблизительно до 67 %. T1/2 топотекана увеличивался приблизительно на 30 %, но никаких очевидных изменений Vd не наблюдалось. Общий плазменный клиренс у пациентов с печеночной недостаточностью был меньше лишь на 10 % по сравнению с контрольной группой пациентов. У пациентов с почечной недостаточностью (КК 41-60 мл/мин) плазменный клиренс уменьшился приблизительно на 67 % по сравнению с контрольной группой пациентов. Vd был слегка пониженным, и, таким образом, T1/2 увеличился только на 14 %. У пациентов с умеренной почечной недостаточностью плазменный клиренс топотекана сократился до уровня, который составлял 34 % значения этого параметра у пациентов контрольной группы. Vd уменьшился приблизительно на 25 %, что привело к увеличению среднего T1/2 с 1.9 ч до 4.9 ч.
Показания
Вторая линия химиотерапии при:
- раке яичников;
- мелкоклеточном раке легкого
- рецидивирующем или персистирующем раке шейки матки
Режим дозирования
Для взрослых и пациентов пожилого возраста рекомендуемая начальная доза топотекана составляет 1.5 мг/м2 внутривенно в виде инфузии в течение не менее 30 мин ежедневно в течение 5 дней с интервалом в 21 день перед началом каждого курса. Рекомендуется провести не менее 4 курсов терапии, поскольку период развития терапевтического эффекта в клинических исследованиях в среднем составлял 9-11.6 недель. Перед назначением первого курса терапии топотеканом у пациентов исходный уровень нейтрофилов должен быть >=1.5х109/л, тромбоцитов >=100х109/л и уровень гемоглобина >=90 г/л (после переливания крови, если это необходимо).
Гикамтин не назначают повторно, если уровень нейтрофилов составляет менее 1х109/л, тромбоцитов - менее 100х109/л, а уровень гемоглобина - менее 90 г/л (в том числе после переливания крови).
Пациентам с выраженной нейтропенией (количество нейтрофилов менее 0.5х109/л) в течение 7 дней или больше или при нейтропении, сопровождающейся лихорадкой или инфекцией, а также пациентам, лечение которых было отсрочено из-за нейтропении, препарат следует назначать в уменьшенной дозе: 1.25 мг/м2/сут, при необходимости постепенно снижая её до 1 мг/м2/сут. При последующих курсах, начиная с 6-го дня курса (первого дня после завершения применения топотекана) можно назначать профилактически колониестимулирующие факторы, чтобы поддержать интенсивность дозы. Если нейтропения не поддается коррекции при применении колониестимулирующего фактора, дозу препарата следует уменьшить.
Аналогичная коррекция дозы проводится при уменьшении количества тромбоцитов менее 25х109/л.
В клинических исследованиях топотекан отменяли, если при применении в дозе 1 мг/м2 требовалось её дальнейшее снижение для предотвращения развития побочных эффектов.
При нарушениях функции почек для пациентов с КК>=40 мл/мин коррекции дозы не требуется. Рекомендуемая доза для пациентов с КК 20-39 мл/мин составляет 750 мкг/м2/сут.
Для рекомендаций относительно дозы препарата для пациентов с КК <20 мл/мин, имеющихся данных недостаточно.
Для пациентов с нарушениями функции печени (билирубин плазмы <=100 мг/л) специального подбора дозы не требуется. Пациенты с нарушениями функции печени переносят 1.5 мг/м2 в течение 5 дней каждые 3 недели, хотя при этом наблюдается небольшое снижение клиренса топотекана.
Правила приготовления растворов
Во флакон, содержащий 4 мг топотекана в форме лиофилизированного порошка, добавляют 4 мл стерильной воды для инъекций. Полученный раствор разбавляют 0.9 % раствором натрия хлорида для внутривенных инфузий или 5 % раствором декстрозы для внутривенных инфузий до достижения концентрации 25-50 мкг/мл.
Побочное действие
Со стороны системы кроветворения
В ходе исследований по определению терапевтической дозы топотекана была обнаружена дозозависимая гематологическая токсичность. Признаков кумулятивной токсичности не отмечено, а все проявления гематологической токсичности были предсказуемы, обратимы и поддавались контролю.
Нейтропения выраженная, но обратимая (количество нейтрофилов <0.5х109/л) отмечалась у 79 % пациентов (42 % курсов); умеренная (количество нейтрофилов 0.5-0.9х109/л) - у 17 % пациентов (28 % курсов). В связи с выраженной нейтропенией лихорадка наблюдалась у 7 % пациентов (2 % курсов), и инфекция - у 14 % пациентов (4 % курсов). Кроме того, у 5 % пациентов (1 % курсов) развился сепсис. Среднее время начала выраженной нейтропении составляло 9 дней, а средняя продолжительность - 7 дней. Более 7 дней выраженная нейтропения продолжалась в 12.5 % курсов.
Лейкопения выраженная, но обратимая (количество лейкоцитов <1х109/л) отмечалась у 32 % пациентов (12 % курсов); умеренная (количество лейкоцитов 1-1.9х109/л) - у 53 % пациентов (42 % курсов).
Тромбоцитопения выраженная, но обратимая (количество тромбоцитов меньше чем 25х109/л) возникала у 23 % пациентов (9 % курсов); умеренная (количество тромбоцитов 25-49.9х109/л) - у 20 % пациентов (13 % курсов).
Среднее время начала выраженной тромбоцитопении было на 14-й день терапии, а средняя продолжительность составляла 5 дней. Тромбоцитарные трансфузии производились в 3.7 % курсов. Существенные осложнения, связанные с тромбоцитопенией, были редкими.
Анемия от умеренной до выраженной формы (уровень гемоглобина<=79 г/л) наблюдалась у 36 % пациентов (15 % курсов), а в слабой форме (уровень гемоглобина 80-100 г/л) - у 56 % пациентов (59 % курсов). Переливания эритроцитов производились у 54 % пациентов (23 % курсов).
Со стороны пищеварительной системы
Наиболее часто - тошнота, рвота, диарея, запор и стоматит. При рекомендуемых дозах эти эффекты обычно слабо выражены. Частота возникновения тошноты, рвоты, диареи и стоматита в выраженной форме (3-й или 4-й степени) составляла соответственно 6 %, 4.5 %, 3.4 % и 2 %. Наблюдались также боли в животе (около 8 %); анорексия (1.1 %); гипербилирубинемия (1.1 %).
Дерматологические реакции
Общая и резко выраженная алопеция наблюдалась у 42 % пациентов, а частичная алопеция - у 17 % пациентов.
Со стороны обмена веществ
Редко - отёки.
Прочие
Утомляемость (3.8 %), астения (2.2 %), недомогание (1.3 %). Из всех пациентов, которые наблюдались в ходе клинических исследований (включая пациентов с выраженной нейтропенией и без неё), у 13 % (5 % курсов) отмечалась лихорадка и у 27 % (10 % курсов) - инфекция. Кроме того, у 5 % всех пациентов, лечившихся топотеканом (1 % курсов), возникал сепсис.
Данных о значительной кардиотоксичности, нейротоксичности или токсичности по отношению к другим внутренним органам и системам не выявлено.
Противопоказания
- миелодепрессия до назначения препарата с количеством нейтрофилов <1.5x109/л или тромбоцитов <=100x109/л;
- беременность;
- лактация (грудное вскармливание);
- повышенная чувствительность к компонентам препарата.
Беременность и лактация
Топотекан может оказывать тератогенное действие на плод, поэтому применение препарата при беременности противопоказано.
Неизвестно, выделяется ли топотекан с грудным молоком, поэтому препарат противопоказан к применению в период лактации.
Особые указания
Гикамтин следует применять под руководством врача, имеющего опыт работы с цитотоксическими препаратами. Обычно при терапии Гикамтином для предотвращения негематологических побочных эффектов не требуется применения премедикации. При работе с Гикамтином следует принимать следующие меры предосторожности: персонал должен быть обучен правилам приготовления растворов; не допускать беременных сотрудниц к работе с препаратом; при приготовлении растворов следует пользоваться защитной одеждой (в том числе маской, защитными очками, защитными перчатками); все предметы, использованные при работе с препаратом, относятся к категории предметов высокого риска, их следует помещать в мешки для высокотемпературной переработки, оставшуюся жидкость можно смыть большим количеством воды; при случайном попадании препарата на кожу или в глаза необходимо немедленно промыть их обильным количеством воды.
Контроль лабораторных показателей
В процессе терапии топотеканом необходимо регулярно контролировать картину периферической крови, включая уровень тромбоцитов.
Использование в педиатрии
Применение топотекана у детей не рекомендуется, так как имеющиеся данные крайне ограничены.
Результаты экспериментальных исследований
В исследованиях in vitro было показано генотоксическое действие на лимфомные клетки мышей и лимфоциты человека; in vivo - генотоксическое действие на клетки костного мозга мышей.
Влияние на способность к вождению автотранспорта и управлению механизмами
На фоне терапии топотеканом необходимо соблюдать особую осторожность при управлении автомобилем или работе с механизмами, если сохраняются утомляемость и слабость.
Передозировка
Предполагается, что основными проявлениями передозировки топотекана могут быть рецидивирующая миелодепрессия и стоматит. Антидот топотекана неизвестен.
Лекарственное взаимодействие
При одновременном применении топотекана с другими цитотоксическими средствами, вызывающими миелодепрессию, возможно усиление угнетающего действия на костный мозг. Топотекан не ингибирует ферменты цитохрома Р450. Совместное применение с ондансетроном, гранисетроном, морфином или кортикостероидами не оказывает существенного влияния на фармакокинетические параметры топотекана.
Условия и сроки хранения
Препарат следует хранить в картонной упаковке, в защищенном от света месте при температуре не выше 30 °C. Срок годности - 3 года. Поскольку препарат не содержит противомикробных консервантов, после растворения лиофилизированного порошка полученный раствор следует использовать сразу или в течение не более 24 ч при условии хранения в холодильнике. Приготовленный раствор стабилен в течение 24 ч при температуре не выше 30 °C. Разбавленный раствор рекомендуется использовать в течение 24 ч после приготовления. Этот раствор стабилен в течение 24 ч при температуре не выше 25 °C.
Условия отпуска из аптек
Препарат отпускается по рецепту.