Шикиматный путь
Шикима́тный путь — метаболический путь, промежуточным метаболитом которого является шикимовая кислота (шикимат). Шикиматный путь отмечается как специализированный путь биосинтеза бензоидных ароматических соединений (очень часто в этом качестве наряду с шикиматным путём отмечается также поликетидный (ацетатно-малонатный) механизм построения бензольных ядер — замыкание (zip-сборка) ароматических систем посредством внутримолекулярной конденсации по типу кротоновой). Шикиматным путём в природе синтезируются такие известные соединения, как фенилаланин, тирозин, триптофан, бензоат, салицилат. Шикиматный путь является источником ароматических предшественников терпеноидных хинонов (убихинонов, пластохинонов, менахинонов, филлохинонов), токоферолов, фолата, флавоноидов, лигнинов, суберинов, меланинов, таннинов и огромного множества других соединений, играющих в природе различную роль. Шикиматный путь — один из древнейших эволюционно консервативных метаболических путей; как источник фундаментальных составляющих (в первую очередь — трёх протеиногенных аминокислот) живой материи фактически представляет собой часть первичного метаболизма. Значение шикиматного пути велико, так как этот путь является единственным установленным путём биосинтеза ряда важнейших природных соединений, в том числе значимых в плане их практического использования. В строгом смысле под шикиматным путём следует понимать только общую часть разветвлённого метаболического процесса — путь биосинтеза хоризмовой кислоты (хоризмата).
История открытия и изучения
В 1935 году немецкий химик-органик Германн Отто Лауренц Фишер[статья] (1888—1960) и Герда Дангшат (?—1964) отметили, что структурно охарактеризованные ими кислоты хинная и шикимовая могут быть биогенетически (метаболически) тесно связанными с бензоидными ароматическими соединениями, в частности, с галловой кислотой[1].[2] Для хинной кислоты была известна биологическая ароматизация (при участии микроорганизмов наблюдали образование из хинной кислоты некоторых фенольных соединений, а также было показано, что хинная кислота в организме млекопитающих метаболизируется в гиппуровую кислоту). Однако всё же чёткого подтверждения того, что гидроароматические кислоты являются естественными предшественниками природных ароматических соединений, не существовало до 1950-х годов[3].
В 1950 году американский микробиолог Бернард Дэвис (1916—1994), применяя ультрафиолетовое облучение, используя свой оригинальный метод отбора с применением пенициллина, получил серию мутантов Escherichia coli, способных расти лишь в такой питательной среде, в которую добавлялись ароматические соединения. Многие мутанты нуждались в фенилаланине, тирозине, триптофане, пара-аминобензоате и пара-гидроксибензоате (в следовых количествах). Неожиданно оказалось, что потребность во всех пяти соединениях можно удовлетворить добавлением шикимовой кислоты (шикимата), в то время считавшейся редким соединением, встречающимся лишь у некоторых растений. Другая группа полученных Дэвисом мутантов не отвечала на добавляемый шикимат как на заменяющий ароматические соединения фактор роста, и обнаружилось, что некоторые из этих мутантов сами накапливали в культуральной среде шикимовую кислоту. Мутанты разных групп могли синтрофно расти на минимальной питательной среде[3]. [4]
Таким образом, шикимат, который отнюдь не является ароматическим соединением, оказался промежуточным продуктом в процессах биосинтеза трёх ароматических протеиногенных аминокислот, пара-аминобензоата и других существенных ароматических соединений.[4] Очевидно, у некоторых полученных Дэвисом мутантов был нарушен синтез шикимата, тогда как у других мутантов были блокированы более поздние стадии метаболического процесса.
При помощи ауксотрофных мутантов Escherichia coli, Aerobacter aerogenes и Neurospora crassa и с применением изотопно-меченых соединений был прослежен весь путь от углеводных предшественников до первичных и вторичных метаболитов ароматической природы.[5] Промежуточные соединения удавалось обнаружить и изолировать благодаря тому, что определённые мутанты их накапливали. Эксперименты с мутантами и выделяемыми ими соединениями позволяли выстраивать эти соединения в цепочку и отмечать в этой цепочке места недостающих метаболитов. Установить начальные этапы пути, связывающие его с известными путями, было значительно сложнее. Мутантный штамм Escherichia coli, накапливающий в культуральной среде шикимовую кислоту, выращивали на средах, содержащих в качестве единственного источника углерода 14C-меченую по определённым позициям d-глюкозу или другие соединения. После этого шикимовую кислоту выделяли. Распределение радиоактивных меток определялось путём ступенчатой химической деструкции. Анализ полученных результатов привёл к выводу, что три из семи атомов углерода молекулы шикимовой кислоты приходят из гликолиза, остальные четыре — из пентозофосфатного пути[6]. Природа исходных соединений была выяснена, когда стал доступен синтетический [7] d-эритрозо-4-фосфат. Было показано, что клеточные экстракты Escherichia coli легко конвертируют d-эритрозо-4-фосфат и фосфоенолпируват в дегидрохиннат[8]. Сначала предположили, а затем экспериментально установили, что промежуточным соединением является семиуглеродный продукт конденсации — соединение, которое теперь известно как ДАГФ[9]. Также, при помощи радиоизотопных меток было показано, что экспериментально наблюдаемое почти количественное превращение под действием бактериальных клеточных экстрактов d-седогептулозо-1,7-дифосфата в дегидрошикимат или шикимат [10] не может быть объяснено преобразованием цельной молекулы, без промежуточного расщепления её на C4 и C3-фрагменты[11].
Важнейшая часть работы по расшифровке пути была проделана Бернардом Дэвисом (важные пионерские работы по выяснению метаболических путей при помощи мутантов велись под его руководством в им же основанной и возглавляемой научно-исследовательской лаборатории туберкулёза при Корнеллском медицинском колледже, Манхэттен, Нью-Йорк) в сотрудничестве с исследователями из Колумбийского университета — Дэвидом Спринсоном (1910—2007) и Паритхичери Сринивасаном (1927—2012)[12]. В числе других сотрудников — Масаюки Катажири, Ульрих Вайс, Элизабет Мингиоли, Иван Саламон, Джудит Левин. Значительный вклад в изучение отдельных стадий процесса внесли также австралийцы Франк Гибсон (1923—2008), Джеймс Питтард и многие другие исследователи. Полная картина метаболического пути стала ясна в 1962—1964 годах, когда Франк Гибсон наконец выделил и изучил долго ускользавшую от наблюдения субстанцию «compound X»[Поясн. 1] — недостающий промежуточный метаболит, структура которого до этого уже была предсказана (впоследствии подтверждена Ллойдом Джэкмэном при помощи ЯМР-спектроскопии). По предложению своего тестя это соединение Гибсон назвал хоризматом (хоризмовой кислотой). Гипотеза Дэвиса (5-карбоксивинил-шикимат-3-фосфат, или, как его тогда называли, «Z1-phosphate», — предшественник как фенилаланина, тирозина, так и триптофана) была доказана, гипотеза Спринсона (последний общий предшественник трёх ароматических аминокислот — фосфошикимовая кислота) подтверждения не получила[13].
В 1950-х годах был, как описано выше, установлен путь биосинтеза дегидрохинната через ДАГФ, долго считавшийся единственным. В геномную эру стали накапливаться факты, которые требовали объяснения. Наиболее любопытным было то, что во многих геномах не выявлялось ортологов генов биосинтеза дегидрохинната при наличии ортологов генов его дальнейшего метаболизма. Результаты последовавших исследований метаболических возможностей организмов подтвердили предположения о существовании альтернативного пути биосинтеза дегидрохинната[14]. В 2004 году были опубликованы результаты исследований американского биохимика Роберта Уайта по расшифровке пути биосинтеза дегидрохинната через ADTH[15]. Однако предложенная Уайтом гипотетическая схема биосинтеза DKFP (прекурсор ADTH) впоследствии не подтвердилась. В 2006 году Роберт Уайт и Сюй Хуэйминь сообщили, что им удалось выяснить истинный путь биосинтеза DKFP у Methanocaldococcus jannaschii[16].
Название пути
Название «шикиматный путь» (the shikimate pathway), также можно встретить «путь шикимовой кислоты» (the shikimic acid pathway), было определено исторически (изучение началось с установления метаболической роли шикимовой кислоты, см. выше). В 1979 году Флос (H. G. Floss), желая подчеркнуть ключевую роль и мультипотентность другого важнейшего промежуточного соединения (хоризмата), предложил название «the chorismate pathway». Ввиду того, что хоризмат находится хотя и в важнейшей, но не единственной точке ветвления цепочки химических превращений, и в силу того, что старое название к тому времени уже хорошо закрепилось, подобное переименование было признано контрпродуктивным и от него отказались. Другое возможное название, «the aromatic pathway», также было отвергнуто, так как многие ароматические соединения синтезируются иными путями, некоторые же неароматические продукты синтезируются из шикиматных предшественников, минуя стадию ароматизации.[17]
Годы открытия основных соединений смотри в приложении.
Распространённость и локализация
Шикиматный путь осуществляется в клетках прокариот (как бактерий, так и архей) и эукариот (грибов, растений, всевозможных протистов, но не животных). У растений реакции шикиматного пути проходят в цитозоле и, практически независимо,[18] в пластидах (главным образом в хлоропластах), однако гены практически всех ферментов локализованы в ядре; при нормальных условиях роста около 20 % всего усваиваемого растением углерода протекает этим путём,[19][20] в масштабе биосферы по некоторым оценкам это составляет около 7×1012 тонн в год[19]. У организмов, клетки которых не содержат пластиды, шикиматный путь протекает в цитозоле. Многоклеточные животные (Metazoa) не имеют ферментной системы шикиматного пути, так как получают протеиногенные ароматические аминокислоты и прочие необходимые продукты шикиматного пути в достаточном количестве с пищей (или от симбионтов) и потому эволюцией освобождены от необходимости их биосинтеза de novo. С другой стороны, избавившись от «лишнего» ещё на этапе своего эволюционного становления, животные попали в зависимость от ряда экзогенных соединений (незаменимые аминокислоты, значительная часть витаминов)[21]. Животные способны преобразовывать готовые ароматические продукты шикиматного пути,[22] в частности, способны превращать незаменимую аминокислоту фенилаланин в тирозин, являющийся заменимой аминокислотой при условии достаточного поступления фенилаланина с пищей. Шикиматный путь частично или полностью утрачен также некоторыми микроорганизмами, живущими исключительно в богатых необходимыми веществами средах.
У бактерий три реакции, завершающие биосинтез фенилаланина, могут проходить как в цитозоле, так и в периплазматическом пространстве или экстрацеллюлярно[23].
Начальные этапы шикиматного пути
В настоящее время известно два пути биосинтеза дегидрохинната — предшественника шикимата. Это классический путь через ДАГФ и обнаруженный позже у архей путь через ADTH.
Путь через ДАГФ
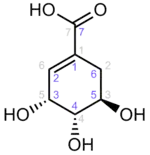
Наиболее распространённым в органическом мире и первым изученным путём образования дегидрохинната является путь его биосинтеза из d-эритрозо-4-фосфата и фосфоенолпирувата. d-Эритрозо-4-фосфат образуется преимущественно в системе транскетолазных и трансальдолазных реакций окислительного и восстановительного пентозофосфатных путей, а также, у некоторых микроорганизмов, — при участии фосфокетолазы. Фосфоенолпируват образуется в процессе гликолитического распада углеводов и из оксалоацетата, а у ряда организмов — также одностадийно из пирувата. Сначала происходит взаимодействие по типу альдольной конденсации d-эритрозо-4-фосфата и фосфоенолпирувата с образованием семи́углеродного соединения 3-дезокси-d-арабино-гепт-2-улозонат-7-фосфат (ДАГФ, англ. DAHP, множество синонимов). Осуществляющий эту реакцию фермент — ДАГФ-синтаза (КФ 2.5.1.54) — представлен, как правило, несколькими изоформами; известно 2 класса. Далее ДАГФ претерпевает внутримолекулярную альдольную конденсацию (циклизацию), что даёт дегидрохиннат. Реакцию осуществляет фермент 3-дегидрохиннат-синтаза (КФ 4.2.3.4), требующая в качестве кофермента NAD, который участвует в механизме реакции, потому как во время каталитического акта сначала происходит окисление гидроксильной группы при C5-атоме углерода молекулы ДАГФ в карбонильную, а в дальнейшем — восстановление этой карбонильной группы обратно в гидроксильную (механизм, характерный и для других циклаз фосфорилированных углеводов [24]). Считается, что в реакцию ДАГФ вовлекается в полукетальной α-пиранозной форме (на схеме из некоторых соображений приведена только формула открытой кето-формы ДАГФ).
Описанный путь биосинтеза дегидрохинната характерен для бактерий, эукариот и части архей.
Путь через ADTH
У многих архей (в основном представители типа Euryarchaeota, относимые к классам Archaeoglobi, Halobacteria, Methanomicrobia, Methanobacteria, Methanococci, Methanopyri, а также типа Thaumarchaeota) активность ДАГФ-синтазы не была показана, а при исследовании их геномов не удалось выявить каких-либо ортологов генов ДАГФ-синтазы. Не было обнаружено и ортологов генов известного класса 3-дегидрохиннат-синтазы. Впоследствии выяснилось, что биосинтез дегидрохинната у этих организмов осуществляется другим путём. В экспериментах на Methanocaldococcus jannaschii установлено, что исходными соединениями служат d-глицеральдегид-3-фосфат, дигидроксиацетонфосфат, l-аспартат-4-се́миальдегид. d-Глицеральдегид-3-фосфат и дигидроксиацетонфосфат (глицерон-фосфат) образуются в клетке разными путями, в том числе в системе транскетолазных, трансальдолазных реакций и в ходе гликолитического распада углеводов. l-Аспартат-4-семиальдегид, также как и названные триозофосфаты, не является специфическим соединением данного метаболического пути; образуется восстановлением β-карбоксильной группы l-аспартата, является предшественником ряда протеиногенных аминокислот (метионина, треонина, изолейцина, а также лизина в одной из двух известных стратегий его биосинтеза). Отщепление фосфата от d-глицеральдегид-3-фосфата генерирует пирувальдегид (метилглиоксаль), который под влиянием фруктозо-1,6-дифосфат-альдолазы класса I (фермент с достаточно низкой субстратной специфичностью)[Поясн. 2] конденсируется с дигидроксиацетонфосфатом (вступает в реакцию в свободном виде либо в виде других субстратов альдолазы — d-фруктозо-1-фосфата или d-фруктозо-1,6-дифосфата) с образованием 6-дезокси-5-кетофруктозо-1-фосфата (сокр. англ. DKFP). DKFP далее под влиянием другой родственной неспецифической альдолазы (КФ 4.1.2.13 / 2.2.1.10)[Поясн. 2] взаимодействует с l-аспартат-4-семиальдегидом с образованием 2-амино-3,7-дидезокси-d-трео-гепт-6-улозоната (сокр. англ. ADTH, синоним: 2-амино-2,3,7-тридезокси-d-ликсо-гепт-6-улозонат). Последнее соединение окислительно дезаминируется и циклизуется в дегидрохиннат под влиянием NAD-зависимого фермента дегидрохиннат-синтазы-II (КФ 1.4.1.24)[15].[16]

Итак, возникающий в результате циклизации шестичленный карбоцикл в дальнейшем подвергается ароматизации (в большинстве случаев).
Дальнейшие превращения дегидрохинната
Дегидрохиннат может обратимо восстанавливаться NAD-, NADP- и PQQ-зависимыми дегидрогеназами в хиннат, роль в биосинтезе ароматических соединений которого обсуждается (у некоторых растений уже выявлен фермент хиннат-гидролиаза, дегидратирующий хиннат в шикимат, что создаёт возможность превращения дегидрохинната в шикимат через хиннат, а не только через дегидрошикимат путём, описанным ниже)[25].[19] Однако строго доказано, что на пути к предшественникам важнейших ароматических соединений если не необходимым, то по крайней мере основным (у всех хорошо изученных в этом отношении организмов) этапом является обратимая дегидратация (фермент: 3-дегидрохиннат-дегидратаза (КФ 4.2.1.10), стереохимия — 1,2-син-элиминирование для ферментов типа I и 1,2-анти-элиминирование в случае ферментов типа II) [26] дегидрохинната в дегидрошикимат. У ряда организмов дегидрошикимат окисляется NADP-зависимой дегидрогеназой в 3,5-дидегидрошикимат или под влиянием 3-дегидрошикимат-дегидратазы (КФ 4.2.1.118) может обратимо дегидратироваться в ароматическое соединение протокатехат (через эти стадии может идти образование галлата, пирокатехина, пирогаллола, флороглюцина, гидроксигидрохинона, прочих фенолов). Но на пути к наиболее важным ароматическим соединениям дегидрошикимат должен претерпеть ряд других химических изменений. Дегидрошикимат обратимо восстанавливается NAD-, NADP- и PQQ-зависимыми дегидрогеназами в шикимат, далее следует необратимая киназная реакция (фермент: шикимат-киназа (КФ 2.7.1.71), макроэргический донор фосфорильной группы — ATP). Образовавшийся шикимат-3-фосфат (фосфошикимат) взаимодействует с фосфоенолпируватом и образуется 5-карбоксивинил-шикимат-3-фосфат (фермент: ЕПШФ-синтаза, англ. EPSP synthase (КФ 2.5.1.19)). Две последние реакции рассматриваются как подготовительные для последующих реакций элиминирования, необходимых для завершения π-электронного секстета бензольного кольца (ароматизации). Необратимая реакция элиминирования фосфат-аниона даёт хоризмат (фермент: хоризмат-синтаза (КФ 4.2.3.5) — флавопротеид, кофактором является FMNred либо FADred, бифункциональные хоризмат-синтазы обладают к тому же NADred или NADPred-зависимой флавин-редуктазной активностью). Стереохимически реакция происходит как 1,4-анти-элиминирование, что предполагает механизм более сложный (предположительно радикальный, принимая во внимание структурные особенности субстрата и характер кофакторов), чем простое синхронное сопряжённое элиминирование, иначе происходило бы нарушение правил орбитальных взаимодействий[27]. В строгом смысле, собственно шикиматный путь образованием хоризмата завершается. От хоризмата расходятся по крайней мере семь путей, ведущих к ароматическим соединениям и родственным им хинонам (в приведённом ниже общем обзоре этих путей отражена основная биосинтетическая роль шикиматного пути).

П р и м е ч а н и е к р и с у н к у: На схеме отмечены различные возможные биохимические превращения, обычно не все из которых реализуются в конкретных организмах. Отмечены наиболее важные биохимические превращения, но разнообразие возможных превращений не ограничивается лишь этими. Хотя некоторые отмеченные на схемах здесь и далее реакции принципиально обратимы (обратимость реакций отмечена в соответствии с KEGG Pathway), равновесие в физиологических условиях может быть практически нацело смещено в определённую сторону, что обусловлено термодинамическими и другими факторами. Каноническая часть шикиматного пути размещена в верхней трети рисунка. Маленькой красной стрелочкой указана та стадия, которую блокирует глифосат (ЕПШФ-синтазная реакция).
В узком смысле шикиматный путь — каскад из 7-ми ферментативных реакций, приводящий к образованию хоризмата — общего предшественника ряда важнейших соединений. Краткая информация по этим реакциям сведена в таблицу, которая вынесена в приложение
Пути, расходящиеся от хоризмата
В живой природе выявлено не менее семи различных путей, расходящихся от хоризмата и приводящих к ароматическим соединениям, а также родственным им хинонам:
- через префенат к фенилаланину, тирозину, фенилпропаноидам и другим соединениям.
- через антранилат к индолу, триптофану и другим соединениям.
- через 2-амино-4-дезоксихоризмат к пигментам и антибиотикам феназинового ряда.
- через 4-амино-4-дезоксихоризмат к пара-аминобензоату, фолату, хлорамфениколу и другим соединениям.
- через пара-гидроксибензоат к убихинону и другим соединениям.
- через изохоризмат к структурным производным нафталина (нафтохинонам), салицилату и другим соединениям.
- через футалозин к нафтохинонам и, возможно, к другим соединениям.
Известны и другие превращения хоризмата, например, присутствующая в его структуре эфирная связь может подвергаться гидролизу. Это путь к алициклическому соединению (1R,3R,4R)-3,4-дигидроксициклогексан-1-карбоксилату (предшественник-стартер в биосинтезе рапамицина, такролимуса, аскомицина и др.)[28]. Аналогично может начинаться биосинтез циклогексилкарбонил-КоА (предшественник асукамицина, селамектина, ансатриенина A,[29] ω-циклогексил-жирных кислот [29] и других соединений).
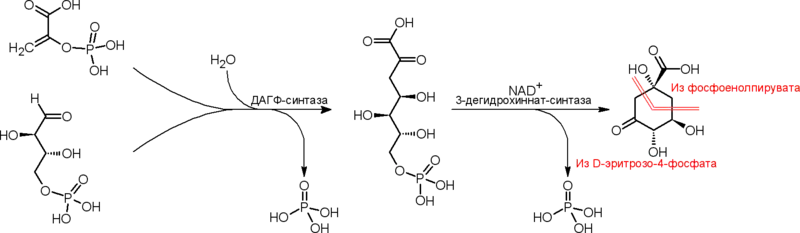
Путь через префенат
Изомеризация хоризмата в префенат происходит в результате [3,3]-сигматропной перегруппировки, по типу напоминающей перегруппировку Кляйзена (в более широком смысле — является перегруппировкой Кляйзена). Эта реакция способна происходить спонтанно (термически), подкисление среды и нагревание ускоряют её. Фермент хоризматмутаза (КФ 5.4.99.5) в физиологических условиях ускоряет реакцию в 2•106 раз[27].
Реакция дегидратационного декарбоксилирования (механизм — сопряжённое элиминирование) префената приводит к фенилпирувату. Эта реакция способна проходить спонтанно (термически, кислая среда является сильным катализатором), для её ускорения существуют ферменты: специфическая префенатдегидратаза (КФ 4.2.1.51) и неспецифическая карбоксициклогексадиенилдегидратаза (КФ 4.2.1.91). Обратимое переаминирование фенилпирувата приводит к протеиногенной аминокислоте фенилаланину.
Окислительное декарбоксилирование (окислитель — NADox или NADPox, ферменты — префенатдегидрогеназы) префената приводит к 4-гидроксифенилпирувату, обратимое переаминирование которого приводит к протеиногенной аминокислоте тирозину.
Известен также путь к фенилаланину и тирозину через арогенат (претирозин). Арогенат получается в результате переаминирования префената. Дегидратационное декарбоксилирование арогената приводит к фенилаланину, а окислительное декарбоксилирование (окислитель — NADox или NADPox) арогената приводит к тирозину. У зелёных растений и цианобактерий путь биосинтеза фенилаланина и (или) тирозина через арогенат обычно является преобладающим.
У некоторых организмов (мутанты Neurospora crassa и др.) найдены спиро-арогенат (лактамное производное арогената) и d-префениллактат (восстановленное по карбонилу производное префената), которые также склонны к ароматизации.[30]
У многих организмов, в том числе у животных и человека, есть фермент аэробная тетрагидробиоптерин-зависимая фенилаланин-4-монооксигеназа (синоним: фенилаланин-4-гидроксилаза, КФ 1.14.16.1), осуществляющий однонаправленное гидроксилирование фенилаланина в тирозин.
Фенилпируват, 4-гидроксифенилпируват, фенилаланин, тирозин и продукты их обмена дают начало огромному множеству различных ароматических соединений (фенилпропаноиды, катехоламины, различные пептиды, многие алкалоиды (изохинолиновые, тропановые, протоалкалоиды), многие гликозиды (кумариновые, большинство известных цианогенных), коферменты PQQ и F420, лигнины, меланины и множество прочих). 4-Гидроксифенилпируват окисляется (с одновременной миграцией и декарбоксилированием кетокарбоксиэтильного заместителя) в гомогентизат, являющийся предшественником токоферолов, пластохинона. Бензоат, пара-гидроксибензоат, салицилат, протокатехат, фанилацетат, гидрохинон могут быть продуктами биодеградации соединений, синтезированных через префенат, помимо чего пара-гидроксибензоат, салицилат и гидрохинон могут быть синтезированы из хоризмата другими путями.
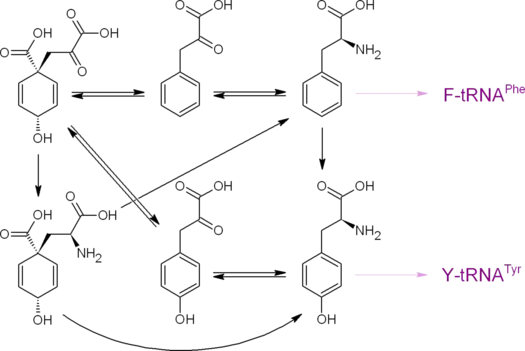
Путь через антранилат
Антранилат синтезируется из хоризмата ферментом антранилатсинтазой (КФ 4.1.3.27). Донором аминогруппы выступает амидный азот глутамина либо аммоний. Антранилат является предшественником индола и протеиногенной аминокислоты триптофана.
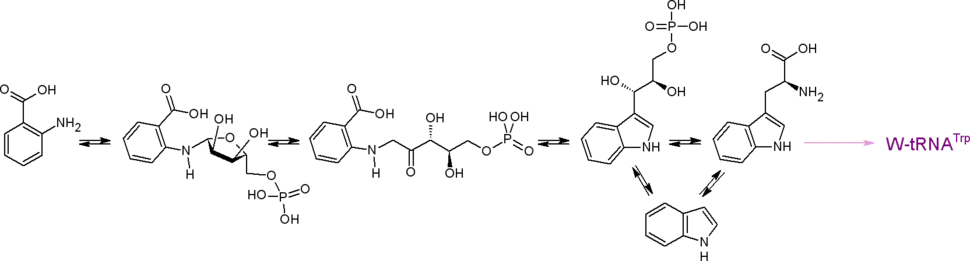
Три последних названных соединения являются предшественниками очень многих соединений: индольных, хинолиновых, хиназолиновых, акридоновых алкалоидов, бензоксазиноидов и др. К примеру, антранилат служит предшественником так называемых pyo-соединений (структурные производные хинолина, такие, как псевданы и N-меркапто-4-формилкарбостирил), индол — прекурсор индикана, а из триптофана синтезируется антибиотик пирролнитрин. Пирокатехин (катехол) образуется в результате декарбоксилирования протокатехата, а также может быть синтезирован из антранилата, из салицилата.
Путь через антранилат близок к пути через 2-амино-4-дезоксихоризмат; эти пути рассматриваются как самостоятельные, так как антранилат и 2-амино-4-дезоксихоризмат производятся из хоризмата разными ферментами.
Путь через 2-амино-4-дезоксихоризмат
Фермент 2-амино-4-дезоксихоризмат-синтаза (КФ 2.6.1.86) производит из хоризмата 2-амино-4-дезоксихоризмат (2-амино-2-дезоксиизохоризмат, сокр. англ. ADIC), открывая путь к структурным производным феназина. Донором аминогруппы выступает амидный азот глутамина. Далее происходит ферментативный гидролиз эфирной связи 2-амино-4-дезоксихоризмата, что даёт (5S,6S)-6-амино-5-гидроксициклогекса-1,3-диен-1-карбоксилат, который далее под влиянием фермента (КФ 5.3.3.-) изомеризуется в (1R,6S)-6-амино-5-кетоциклогекса-2-ен-1-карбоксилат. Последнее соединение подвергается диагонально-симметричной димеризации — в результате — получается предшественник с предобразованной структурой феназиновых соединений. Результатом дальнейших метаболических превращений этого соединения у бактерий является образование пигментов и антибиотиков феназинового ряда, в том числе незамещённого феназина, жёлтого феназин-карбоксилата, 2-гидроксифеназина, синего нефлуоресцирующего пигмента с антибиотической активностью пиоцианина (Pseudomonas aeruginosa), сафенамицинов, эсмеральдинов (димерные феназины)[31].

Различные наборы феназиновых соединений производятся разнообразными бактериями (Pseudomonas, Streptomyces, Nocardia, Sorangium, Brevibacterium, Burkholderia, Erwinia, Vibrio, Pelagiobacter, Brevibacterium, Pantoea agglomerans и др.), среди архей феназиновые соединения найдены у Methanosarcina. Феназиновый оперон (phz-оперон) обычно содержит ген phzC. Этот ген кодирует ДАГФ-синтазу класса II, которая структурно сильно отличается от регулируемых аминокислотами ДАГФ-синтаз, относимых к классу I (прокариотическая ДАГФ-синтаза PhzC структурно ближе к ДАГФ-синтазам высших растений (они также относятся к классу II), чем к прокариотическим ДАГФ-синтазам класса I (AroF, AroG, AroH), которым гомологичны ДАГФ-синтазы дрожжей). Так как phz-оперон содержит отдельный ген с ДАГФ-синтазной функциональностью, то очевидно, что обмен феназинов способен оказывать сильное регуляторное влияние на весь шикиматный путь[31].
Феназиновые соединения являются структурными производными хиноксалина (бензпиразина). Также, определённые структурные производные хиноксалина могут синтезироваться из триптофана.
Известен флавопротеид (содержит FMN, КФ 1.3.99.24), который окисляет 2-амино-4-дезоксихоризмат в 3-(карбоксивинилокси)-антранилат, включающийся в структуру некоторых ендииновых антибиотиков в процессе их биосинтеза. Прекурсоры ендииновых антибиотиков могут образовываться также и через антранилат.
Путь через 4-амино-4-дезоксихоризмат
Изомерный антранилату пара-аминобензоат синтезируется из хоризмата через 4-амино-4-дезоксихоризмат (сокр. англ. ADC) ферментом пара-аминобензоат-синтазой (КФ 2.6.1.85 + КФ 4.1.3.38). Донором аминогруппы выступает амидный азот глутамина. пара-Аминобензоат является предшественником коферментов ряда фолата (THF, THMPT и др.). пара-Аминобензоат и его метаболические производные являются стартерными единицами в биосинтезе некоторых антибиотиков (кандицидин-D, хачимицины (трихомицин), леворин и др.), остаток пара-аминобензоата входит в состав антибиотиков пликацетин, норпликацетин, амицетин, бамицетин и др. Окислением аминогруппы пара-аминобензоата генерируется пара-нитробензоат, который в составе тиоэфира с коферментом A является предшественником-стартером в биосинтезе ауреотина[32]. Спонтанный или ферментативный гидролиз эфирной связи 4-амино-4-дезоксихоризмата приводит к (3R,4R)-4-амино-3-дигидроксициклогекса-1,5-диен-1-карбоксилату. У некоторых микроорганизмов выявлен фермент, катализирующий аналогичную хоризматмутазной [3,3]-сигматропную перегруппировку 4-амино-4-дезоксихоризмата в 4-амино-4-дезоксипрефенат[23]. Эта реакция составляет этап биосинтеза непротеиногенной аминокислоты пара-аминофенилаланин. пара-Аминофенилаланин — прекурсор нескольких известных антибиотиков, из него образуются 4-(диметиламино)-фенилаланин (остаток входит в структуру некоторых циклических пептидных антибиотиков, например, пристинамицина-IA),[33] пара-нитрофенилсеринол (предшественник хлорамфеникола)[34].

Путь через пара-гидроксибензоат
Хоризмат-пируват-лиаза (КФ 4.1.3.40) катализирует реакцию элиминирования пирувата из хоризмата, что приводит к пара-гидроксибензоату. Это не единственный способ биосинтеза пара-гидроксибензоата, который может также образовываться из фенилаланина и тирозина через пара-кумарат (растения, животные, многие бактерии). пара-Гидроксибензоат является предшественником убихинона,[35] растительных гликозидов, шиконина и прочих соединений.

Путь через изохоризмат
Хоризмат-гидроксимутаза (изохоризмат-синтаза, КФ 5.4.4.2) осуществляет обратимую изомеризацию хоризмата в изохоризмат. Изохоризмат является предшественником салицилата, 2,3-дигидроксибензоата (пирокатехата) [36] (предшественник сидерофорных соединений, таких, как энтеробактины), орто-сукцинилбензоата (предшественник менахинонов, филлохинонов, а также ализарина, лавсона, юглона, люцидина, дунниона, моллугина), множества прочих соединений. Из изохоризмата салицилат синтезируется путём элиминирования пирувата (основной, но не единственный способ биосинтеза салицилата). Известен как перициклический, так и не перициклический механизмы этой реакции, описано оба соответствующих типа ферментативной активности[37].[38] У некоторых организмов известен фермент (изохоризмат-мутаза), катализирующий [3,3]-сигматропную перегруппировку изохоризмата в изопрефенат[39].[23] Из изопрефената образуются непротеиногенные аминокислоты мета-карбоксифенилаланин и мета-карбокситирозин — вторичные метаболиты высших растений (Nicotiana silvestris, Iris sp. и др.)[40].[39][41] Изопрефенат — наиболее вероятный предшественник 3-формилтирозина, найденного у Pseudoalteromonas tunicata[42].

кислота
Футалозиновый путь
Биоинформатический анализ секвенированных геномов привёл к обнаружению у некоторых прокариот (Streptomyces spp., Helicobacter pylori, Campylobacter jejuni) другого пути от хоризмата к менахинонам. В начале этого пути в ходе ферментативной реакции из хоризмата, инозина (аденозина) и фосфоенолпирувата образуется футалозин (аминодезоксифуталозин)[43].[44]
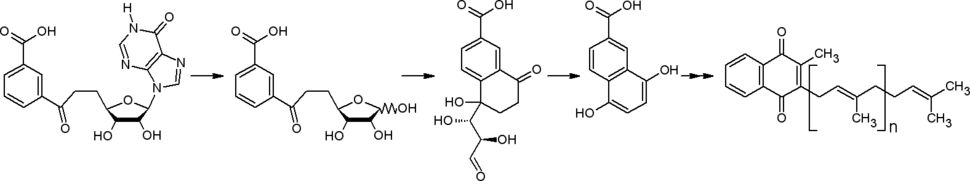
При синтезе менахинонов через изохоризмат и по футалозиновому пути наблюдается разный характер включения в структуру групп атомов, составляющих скелеты исходных соединений (в этих путях второй (хиноидный) карбоцикл достраивается к карбоциклу хоризмата с разных сторон)[43][45].
Неароматические продукты шикиматного пути
Шикиматный путь является специализированным путём биосинтеза ароматических соединений, но может быть рассмотрен как источник ряда неароматических. В основном это соединения, образующиеся из ароматических продуктов шикиматного пути в результате утраты ими ароматичности. Примером может служить диен-изоцианидный антибиотик (продуцирует Trichoderma hamatum), предшественником которого является тирозин:[46]

Ещё пример: фенилацетат (продукт метаболических превращений фенилпирувата и фенилаланина) — биосинтетический предшественник некоторых структурных производных циклогептана (ω-циклогептил-жирных кислот)[29][47].
В других случаях бензольные кольца шикиматного происхождения могут утрачивать ароматичность без разрушения или перестройки углеродного скелета. Так, Rhodopseudomonas palustris способен утилизировать ароматические соединения, в частности деароматизует бензоат, в фототрофных анаэробных условиях гидрируя его до циклогекс-1-ен-1-карбоксилата (дальнейшая утилизация последнего способна покрывать потребность клетки в углероде)[48]. Цианобактериальный дипептид радиозумин, состоит из модифицированных остатков аминокислот, предположительно являющихся метаболическими производными пара-аминофенилаланина с частично гидрированными кольцами[49]. В то же время установлено, что собственные биосинтетические пути разнообразных неароматических структурных производных ароматических аминокислот, таких как 2,5-дигидрофенилаланин,[50][51] 2,5-дигидротирозин,[51] тетрагидрофенилаланин,[50][51] тетрагидротирозин,[51][52][53] 2,5-дигидростильбен,[51] 2-карбокси-6-гидроксиоктагидроиндол [50][51] (структурный компонент цианобактериального пептида эругинозина),[50] антикапсин [51][52][53][54] (предшественник бацилизина),[50][52][53][54] исходят от префената. Известен фермент, префенат-декарбоксилаза, участвующий в синтезе этих соединений и декарбоксилирующий префенат без сопутствующей дегидратации или окисления, что позволяет избежать ароматизации, характерной для более известных метаболических превращений префената[52].[50][51] Кетомицин (антибиотик алициклической структуры) также образуется из префената[55].
Известны также неароматические продукты, синтезируемые из относительно ранних промежуточных неароматических соединений шикиматного пути. В качестве примера таких продуктов можно назвать микоспорины (микоспорин-подобные аминокислоты), которые обнаруживаются в таксономически разнообразных морских, пресноводных и наземных организмах. Один из метаболических путей, приводящих к микоспоринам, ответвляется от шикиматного пути на уровне дегидрохинната. Существование этого пути установлено в экспериментах с аскомицетом Trichothecium roseum[56]. Другой выявленный (цианеи: Nostoc punctiforme, Chlorogloeopsis sp.) путь биосинтеза микоспоринов не использует промежуточные соединения шикиматного пути, но протекает с участием 2-эпи-5-эпи-валиолон-синтазы — гомолога 3-дегидрохиннат-синтазы. Исходным соединением является d-седогептулозо-7-фосфат — центральный метаболит, соединение, имеющее определённые черты структурного сходства с ДАГФ[57].
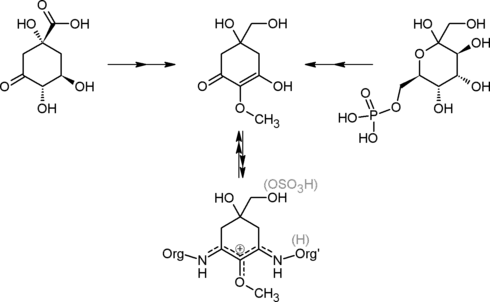
(общая формула)
Известны также продукты взаимодействия ароматических продуктов шикиматного пути с неароматическими промежуточными соединениями шикиматного же пути. Так, 5-O-кофеоилшикимат (дактилифрат) и 3-O-кофеоилшикимат (неодактилифрат) представляют собой шикимовую кислоту, у которой C5-гидроксил (или, соответственно, C3-гидроксил) этерифицирован остатком ароматической кофейной кислоты[58]. Известными производными хинната аналогичного строения являются хлорогенат и неохлорогенат[59].
Термодинамический аспект
Термохимия и кинетика отдельных реакций шикиматного пути хорошо изучены. Проводились специальные термодинамические исследования и расчёты. Ниже — данные по отдельным реакциям.
1). Термодинамика ДАГФ-синтазной реакции [60][61]
ФЕП(aq) + d-Э4Ф(aq) + H2O(1) = ДАГФ(aq) + Ф(aq)
(C3H2O6P)3−(aq) + (C4H7O7P)2−(aq) + H2O(l) = (C7H10O10P)3−(aq) + (HO4P)2−(aq)
Тепловой эффект реакции (изменение энтальпии системы, молярная энтальпия реакции), измеренный калориметрически при T = 298,15 K, pH = 8,18, Im = 0,090 моль/кг, Tris + HCl буфер; установившейся кажущейся константе равновесия K′ > 1,4•103:
ΔrHm (cal) = −(67,7 ± 1,5) кДж/моль
Расчётная стандартная молярная энтальпия реакции (T = 298,15 K и Im = 0):
ΔrHɵm = −(70,0 ± 3,0) кДж/моль (~ −17 ккал/моль)
Расчётная стандартная молярная свободная энергия Гиббса реакции (T = 298,15 K и Im = 0):
ΔrGɵm ≈ −39 кДж/моль
Расчётная () константа равновесия (T = 298,15 K и Im = 0):
Kɵ ≈ 7•106
2). Термодинамика 3-дегидрохиннат-синтазной реакции [61][62]
(C7H10O10P)3−(aq) = (C7H9O6)−(aq) + (HO4P)2−(aq)
Тепловой эффект реакции, измеренный калориметрически (HEPES + NaOH буфер, T = 298,15 K, pH = 7,46, Im = 0,070 моль/кг):
ΔrHm (cal) = −(50,9 ± 1,1) кДж/моль
Расчётная стандартная молярная энтальпия реакции (T = 298,15 K и Im = 0):
ΔrHɵm = −(51,1 ± 4,5) кДж/моль (~ −12 ккал/моль)
Расчётная константа равновесия (T = 298,15 K и Im = 0):
K ≈ 2•1014
3). Термодинамика 3-дегидрохиннат-дегидратазной реакции [61][62]
(C7H9O6)−(aq) = (C7H7O5)−(aq) + H2O(l)
Тепловой эффект реакции, измеренный калориметрически (HEPES + NaOH буфер, T = 298,15 K, pH = 7,42, Im = 0,069 моль/кг):
ΔrHm (cal) = 2,3 ± 2,3 кДж/моль
Расчётная стандартная молярная энтальпия реакции (T = 298,15 K и Im = 0):
ΔrHɵm = 2,3 ± 2,3 кДж/моль (~ 0,5 ккал/моль)
Расчётная константа равновесия (T = 298,15 K и Im = 0):
K = 4,6 ± 1,5
4). Термодинамика шикимат-дегидрогеназной реакции [61]
шикимат(aq) + NADP(aq) = дегидрошикимат(aq) + NADPH(aq)
На основе данных спектрофотометрии были получены следующие значения констант равновесия для этой реакции:
K′ = 0,097 (T = 298,15 K, pH = 7,6)
K′ = 0,18 (T = 303,15 K, pH = 7,8, Tris + HCl буфер)
K′ = 0,175 (T = 303,15 K, pH = 7,9, Tris 0,067 моль/дм3 буфер)
K′ = 0,036 (T = 303,15 K, pH = 7,0, Tris + HCl буфер)
K′ = 0,0361 (T = 303,15 K, pH = 7,0, Tris 0,067 моль/дм3 буфер)
8). Термодинамика хоризматмутазной реакции [61][63][64]
хоризмат(aq) = префенат(aq)
Рассчитанные (при помощи теории молекулярных орбиталей) значения энергии активации хоризмата в газовой фазе:
Дианионная форма: 277,4 кДж/моль (конформация переходного состояния «кресло»), 282,8 кДж/моль (конформация «ванна»). Протонирование стабилизирует переходные формы: энергия активации для конформации «кресло» и конформации «ванна» диацидной формы принимает значения 247,3 кДж/моль и 248,5 кДж/моль соответственно, в водном растворе может снижаться до 86,6 кДж/моль. Так как различия значений энергии активации незначительны, определить преобладающий путь (через «кресло» или через «ванну») неферментативной конверсии хоризмата в префенат затруднительно. Обладая наибольшим сродством к определённому переходному состоянию, хоризматмутаза использует путь через «кресло».
Тепловой эффект реакции, измеренный калориметрически (T = 298,15 K):
ΔrHm (cal) = −(55,4 ± 2,3) кДж/моль (~ −13 ккал/моль)
Полученное при помощи квантовомеханических расчётов значение теплового эффекта (−46,4 кДж/моль) хорошо согласуется с экспериментально измеренным, что является подтверждением как достаточно глубокого понимания природы этой реакции, так и адекватности используемых для расчётов теоретических моделей.
Оценочное значение стандартной молярной энтропии реакции:
ΔrSɵm ≈ 3 Дж/моль•К
Расчётная стандартная молярная энергия Гиббса реакции (T = 298,15 K):
ΔrGɵm ≈ −56 кДж/моль
Расчётная константа равновесия:
K ≈ 7•109 (для конверсии хоризмат2−(aq) в префенат2−(aq) при T = 298,15 K). Для всех практических целей эта реакция может считаться необратимой, в то же время на схемах KEGG Pathway реакция помечена как обратимая.
Связь с другими метаболическими путями
Помимо очевидных связей с путями, производящими исходные соединения шикиматного пути, отдельными примерами можно осветить другого рода связи с другими метаболическими путями.
Некоторые соединения могут синтезироваться шикиматным путём, но этот путь для них не является единственным возможным путём биосинтеза.
Так, протокатехат у некоторых организмов может синтезироваться из дегидрошикимата (в основном при его катаболической утилизации). Протокатехат также является типичным метаболитом, образующимся в процессе биодеградации ароматических и гидроароматических соединений самого различного происхождения. К примеру, продукт поликетидного пути 6-метилсалицилат под влиянием 6-метилсалицилат-декарбоксилазы (КФ 4.1.1.52) декарбоксилируется в мета-крезол, который через серию реакций окисления метильной группы NADP-зависимыми дегидрогеназами может давать протокатехат.
Следует также отметить, что протокатехат является одним из основных промежуточных продуктов биодеградации таких соединений как толуол,[65] ПАУ,[66] бензойная,[67] фталевая и терефталевая [66] кислоты, некоторые азакрасители [68] и другие соединения.
В растениях галлат образуется в реакциях пути шикимовой кислоты, но в грибах это соединение может быть синтезировано поликетидным путём.[69]
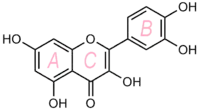
Другого рода взаимодействие метаболических путей можно отметить при синтезе иногда отдельно выделяемых так называемых соединений смешанного (пути) биосинтеза. В качестве примера таких соединений смешанного биосинтеза можно назвать терпеноидные хиноны, в составе молекул которых легко можно различить циклическую структуру шикиматного происхождения и изопреноидную боковую цепь. В структуре многих природных соединений присутствуют бензольные кольца, синтезированные разными способами, в том числе шикиматным и поликетидным путями. Хорошо известный пример соединений такого типа — флавоноиды, у которых кольцо B — шикиматного происхождения, а кольцо А — формируется поликетидным путём.
Хиннат-шикиматный катаболический путь
Кроме биосинтетического шикиматного пути различают также хиннат-шикиматный катаболический путь (иногда также называемый гидроароматическим путём), ответственный за быструю утилизацию излишних количеств хинной, шикимовой и дегидрошикимовой кислот. Избыточный шикимат и хиннат, которые могут поступать в клетку экзогенно посредством специальных переносчиков, в результате обратимых реакций превращаются в дегидрошикимат, дегидратирующийся далее в протокатехат (эти реакции уже отмечались выше). Протокатехат далее, подвергаясь диоксигеназному орто-расщеплению, деградирует до 3-кетоадипата, который затем распадается на субстраты цикла Кребса (ацетил-CoA, сукцинил-CoA) — так называемый кетоадипатный путь. Подвергаясь же диоксигеназному мета-расщеплению, протокатехат деградирует до пирувата и формиата (менее распространённый путь диссимиляции протокатехата). Индуцибельный хиннат-шикиматный катаболический путь известен у грибов (Neurospora crassa) [70] и бактерий (Corynebacterium glutamicum)[71]. Используя хиннат-шикиматный катаболический путь, эти организмы способны расти, потребляя хинную или шикимовую кислоты в качестве единственного источника углерода и энергии.
Гены и ферменты
Краткая информация по ферментам и катализируемым ими реакциям сведена в таблицу, которая вынесена в приложение
Гены прокариот, отвечающие за семь реакций, составляющих путь от d-эритрозо-4-фосфата и фосфоенолпирувата до хоризмата в большинстве случаев имеют название aro-гены (aroA, aroB, aroC, aroD, aroE, aroF, aroG, aroH, aroK, aroL, aroQ, aro1, aroB-1, aroB-2, aroDE, aroKB и некоторые другие). Гены, ответственные за образование фенилаланина и тирозина из хоризмата — phe- и tyr-гены (pheA, pheC, tyrA, tyrAa, tyrB и др.), соответственно, гены биосинтеза триптофана — trp-гены (trpА, trpB, trpC, trpD, trpE, trpF, trpG, trpCF, trpEG, trpGD и др.). Существенное значение для шикиматного пути могут иметь также гены quiA, quiB, qutE, qa-3, ydiB, shiA и некоторые другие. Определённые aro-, phe- и trp- гены не имеют прямого отношения к рассматриваемым здесь биохимическим процессам, но косвенно влияют на них. К примеру, aroP — ген, ответственный за транспорт ароматических аминокислот, pheP — ген, кодирующий фенилаланин-специфичную пермеазу, pheS, pheT, tyrS, trpS — гены соответствующих аминоацил-тРНК-синтетаз (субъединиц в случае фенилаланиновой). Функция генов aroI, aroM (не путать с эукариотическим arom-супергеном) не установлена (по состоянию на сентябрь 1998 года), однако окружение (в том числе предполагаемые регуляторные участки) этих генов позволяет полагать, что они функционально как-то связаны с обменом ароматических соединений. Для генов растений предлагалось название shk-гены[19].
Гены шикиматного пути широко разбросаны по геному, и следуют в различном порядке даже у достаточно близких видов, как правило, не входят в состав единого регулона (хотя в геномах архей наблюдается тенденция к кластеризации). В геноме архебактерии Halobacterium salinarum гены начальных этапов шикиматного пути (OE1472F — ген-паралог fba2 — фруктозо-1,6-дифосфат-альдолазы класса I и OE1475F — ген дегидрохиннат-синтазы-II) включены в триптофановый оперон. Известны и псевдогены. У не имеющей шикиматного пути лактобактерии Lactobacillus delbrueckii subsp. bulgaricus ATCC 11842, например, есть псевдогены aroA(pseudo), aroC(pseudo), aroK(pseudo).
У высших растений гены шикиматного пути локализованы в хромосомах ядра и содержат характерные пластидные сигнальные последовательности (кодируют лидерную N-терминальную сигнальную последовательность полипептида), необходимые для транспорта белковых продуктов этих генов в пластиды.[72]
Для полноценного функционирования ферментной системы шикиматного пути нужно присутствие определённого набора кофакторов, в том числе двухзарядных ионов металлов (Mg2+, Ca2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+ и др.). Отдельные ферменты могут быть требовательны к присутствию в среде определённого иона, другие ионы могут оказывать ингибирующее влияние, в случае других ферментов эти ионы в определённой мере взаимозаменяемы. Ферменты, полученные из разных организмов, а порой и изоферменты одного организма, могут сильно отличаться по отношению к активирующим ионам. Например, дегидрохиннат-синтаза Pyrococcus furiosus проявляет максимальную активность в присутствии Cd2+ (в присутствии любого другого иона активность ниже или отсутствует), для дегидрохиннат-синтаз из других источников подобной требовательности к присутствию катионов кадмия не наблюдается[73].
Практически все описанные ферменты собственно шикиматного пути (7 реакций) являются мономерными, либо представляют собой гомодимерные, гомотетрамерные, гомогексамерные белки с числом активных центров соответствующим числу субъединиц. Среди различных ферментов дальнейших превращений хоризмата встречаются гетеромерные белки. Существуют и охарактеризованы также нековалентные комплексы ферментов (например, ДАГФ-синтаза/хоризматмутаза + шикимат-киназа у Bacillus subtilis).
Fusion
Ферменты шикиматного пути во многих случаях являются многофункциональными. Эти белки — продукты слившихся генов. Среди ферментов шикиматного пути известны следующие бифункциональные белки:
- 3-дегидрохиннат-синтаза/дегидрохиннат-дегидратаза (Rhizopus)
- дегидрохиннат-дегидратаза/шикимат-дегидрогеназа (продукт гена aroDE Chlamydia, Treponema и др.)
- шикимат-киназа/3-дегидрохиннат-синтаза (продукт гена aroKB Escherichia и др.)
- шикимат-киназа/шикимат-дегидрогеназа (Methanoplanus petrolearius и др.)
- шикимат-киназа/ЕПШФ-синтаза (Plasmodium)
- хоризмат-синтаза/флавин-редуктаза (известен у многих аэробных организмов)
- ДАГФ-синтаза/хоризматмутаза (продукт гена aroAG Bacillus subtilis).
Трифункциональные белки:
- 3-дегидрохиннат-синтаза/хоризмат-синтаза/флавин-редуктаза (NADPred-зависимая) (известен у Bacillus subtilis)
Также хорошо известны многофункциональные белки и среди ферментов дальнейших превращений хоризмата:
- хоризматмутаза/префенатдегидратаза (продукт гена pheA Escherichia и др.)
- хоризматмутаза/префенатдегидрогеназа (продукт гена tyrA Escherichia и др.)
- антранилатсинтаза/антранилат-фосфорибозилтрансфераза (продукт гена trpGD Escherichia, Shigella, Citrobacter, Salmonella, Klebsiella, Enterobacter).
- антранилатсинтаза/индол-3-глицерол-фосфат-синтаза (TRP3)
- антранилатсинтаза/индол-3-глицерол-фосфат-синтаза/фосфорибозилантранилат-изомераза (TRP1)
- индол-3-глицерол-фосфат-синтаза/фосфорибозилантранилат-изомераза (продукт гена trpCF)
- триптофан-синтаза/фосфорибозилантранилат-изомераза (продукт гена trpBF)
- пара-аминобензоат-синтаза/4-амино-4-дезоксихоризмат-лиаза (продукт гена pabBC)
- тетрафункциональный белок PHYLLO (известен у растений, катализирует 4 последовательных реакции, в результате которых из хоризмата синтезируется сукцинилбензоат)
- и др.
Пентафункциональный белок arom
У эукариот (протисты, грибы) известен цитоплазматический пентафункциональный белок arom (продукт arom-супергена), сочетающий в одной полипептидной цепи домены с 3-дегидрохиннат-синтазной (КФ 4.2.3.4), 3-фосфошикимат-1-карбоксивинил-трансферазной (КФ 2.5.1.19), шикимат-киназной (КФ 2.7.1.71), 3-дегидрохиннат-дегидратазной (КФ 4.2.1.10, тип I), и шикимат-дегидрогеназной (КФ 1.1.1.25) активностями (домены перечислены по порядку от N-конца). Таким образом, белок arom осуществляет все пять реакций на пути от ДАГФ к 5-карбоксивинил-шикимат-3-фосфату. Белок arom Rhizoctonia solani (возбудитель корневой гнили сельскохозяйственных растений) состоит из 1618 аминокислотных остатков и имеет массу 173 кДа, в полностью функциональном состоянии помимо других необходимых кофакторов (NADox) содержит два иона цинка Zn2+[74].
Генетическая архитектура
Организация в геномах важнейших модельных организмов (подобраны наиболее эволюционно отдалённые организмы, выбраны наиболее детально изученные штаммы):
Расположение aro-генов в хромосоме (нуклеоид, кольцевая молекула ДНК, 4,6 млн пар нуклеотидов) Escherichia coli K-12 (Escherichia coli str. K-12 substr. MG1655):
aroP (транскрипция: ←, функция: транспорт ароматических аминокислот, положение в хромосоме: 120178..121551, расположение на традиционной карте: 2,6), aroL (→, шикимат-киназа, 406405..406929, 8,7), aroM (→, функция неизвестна, 407428..408105, 8,8), aroG (→, ДАГФ-синтаза, регулируемая фенилаланином, 785633..786685, 16,9), aroA (→, ЕПШФ-синтаза, 958812..960095, 20,7), aroT (—, indole acrylic acid resistant mutants, transport, 28,3), aroD (→, 3-дегидрохиннат-дегидратаза, 1774686..1775444, 38,2), aroH (→, ДАГФ-синтаза, регулируемая триптофаном, 1788435..1789481, 38,5), aroC (←, хоризмат-синтаза, 2446388..2447473, 52,7), aroF (←, ДАГФ-синтаза, регулируемая тирозином, 2740080..2741150, 59,0), aroE (←, дегидрошикимат-редуктаза, 3430020..3430838, 73,9), aroKB (←, шикимат-киназа/3-дегидрохиннат-синтаза, 3517398..3519064, 75,8), aroI (—, функция неизвестна, 84,2)[75].[76][77]
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 5842795 пар нуклеотидов) Microcystis aeruginosa NIES-843:
ccmA (транскрипция: →, функция: ДАГФ-синтаза, положение в хромосоме: 557559..558614), aroA (→, ЕПШФ-синтаза, 1380521..1381861), aroC (←, хоризмат-синтаза, 1707983..1709083), aroK (→, шикимат-киназа, 1927033..1927605), aroB (→, 3-дегидрохиннат-синтаза, 2361918..2363018), aroQ (←, 3-дегидрохиннат-дегидратаза, 2783501..2783974), aroE (→, шикимат-дегидрогеназа, 3416423..3417283)[78].
Расположение генов шикиматного пути в хромосоме (нуклеоид, линейная или псевдокольцевая молекула ДНК, 9025608 пар нуклеотидов) Streptomyces avermitilis MA-4680:
aroE (функция: шикимат-дегидрогеназа, положение в хромосоме: 2173767..2174642, complement), aroA (ЕПШФ-синтаза, 3800068..3801408), aroG (ДАГФ-синтаза, 7323905..7325257), aroD (дегидрохиннат-дегидратаза, 7538791..7539270), aroE (шикимат-дегидрогеназа, 8180666..8181502), aroC (хоризмат-синтаза, 8181892..8183076), aroK (шикимат-киназа, 8183073..8183588), aroB (3-дегидрохиннат-синтаза, 8183585..8184676)[79].
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 4093599 пар нуклеотидов) Bacillus subtilis BSn5:
BSn5_01775 (транскрипция: ←, функция: ЕПШФ-синтаза, положение в хромосоме: 345012..346298), aroB (←, 3-дегидрохиннат-синтаза, 355073..356161), BSn5_01830 (←, хоризмат-синтаза/флавин-редуктаза, 356161..357333), aroD (←, дегидрохиннат-дегидратаза, 389768..390535), BSn5_02785 (←, дегидрохиннат-дегидратаза, 518894..519340), aroE (←, шикимат-дегидрогеназа, 622722..623564), BSn5_05730 (←, ДАГФ-синтаза/хоризматмутаза, 1053966..1055042), aroK (→, шикимат-киназа, 2554497..2555057)[80].
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 1664970 пар нуклеотидов) Methanocaldococcus jannaschii DSM 2661:
MJ_0246 (транскрипция: ←, функция: хоризматмутаза, положение в хромосоме: 233695..233994), MJ_0400 (→, ortholog fructose-bisphosphate aldolase, 361590..362411), MJ_0502 (→, ЕПШФ-синтаза, 443159..444448), MJ_1084 (aroE) (→, шикимат-дегидрогеназа, 1022757..1023605), MJ_1175 (←, хоризмат-синтаза, 1113783..1114919), MJ_1249 (→, 3-дегидрохиннат-синтаза, 1191364..1192449), MJ_1440 (→, шикимат-киназа (GHMP-kinase superfamily), 1407283..1408131), MJ_1454 (aroD) (←, 3-дегидрохиннат-дегидратаза, 1423963..1424625)[81].
Расположение генов шикиматного пути в хромосоме (нуклеоид, кольцевая молекула ДНК, 1669696 пар нуклеотидов) Aeropyrum pernix K1:
aroC (транскрипция: ←, функция: хоризмат-синтаза, положение в хромосоме: 384859..386001), aroA (←, ЕПШФ-синтаза, 385991..387274), aroK (←, шикимат-киназа (GHMP-kinase superfamily), 387262..388104), aroE (←, шикимат-дегидрогеназа, 388104..388925), aroD (←, дегидрохиннат-дегидратаза, 388922..389590), aroB (←, 3-дегидрохиннат-синтаза, 389597..390673), aroG (←, ДАГФ-синтаза, 390655..391467), aroA (←, ЕПШФ-синтаза, 892465..893724)[82].
Расположение генов шикиматного пути в хромосомах Saccharomyces cerevisiae S288c (гаплоидное число хромосом — 16):[83]
| Ген | Продукт (функция) | Хромосома | Размер всей хромосомы (пар нуклеотидов) | Положение гена в хромосоме | Смысловая цепь | Интроны |
|---|---|---|---|---|---|---|
| ARO3 | ДАГФ-синтаза | IV | 1 531 933 | 521816..522928 | − | |
| ARO4 | ДАГФ-синтаза | II | 813 184 | 716882..717994 | complement | − |
| ARO1 | Пентафункциональный белок arom | IV | 1 531 933 | 704484..709250 | − | |
| ARO2 | Хоризмат-синтаза | VII | 1 090 940 | 226399..227529 | − | |
| ARO7 | Хоризмат-мутаза | XVI | 948 066 | 674861..675631 | complement | − |
Расположение генов шикиматного пути в хромосомах Populus trichocarpa (гаплоидное число хромосом — 19):[84]
| Ген | Продукт (функция) | Хромосома | Размер всей хромосомы (пар нуклеотидов) | Положение гена в хромосоме | Смысловая цепь | Интроны |
|---|---|---|---|---|---|---|
| DHS3 | ДАГФ-синтаза | LGII | 24 482 572 | 7115794..7120328 | + | |
| DHS1 | ДАГФ-синтаза | LGV | 17 991 592 | 1074502..1077390 | complement | + |
| DHS4 | ДАГФ-синтаза | LGV | 17 991 592 | 9061181..9065741 | complement | + |
| DHQS6:DHQS7 | 3-дегидрохиннат-синтаза | … NW_001492764.1 | complement | + (Оба возможных транскрипта) | ||
| DHQD1 | дегидрохиннат-дегидратаза/шикимат(хиннат)-дегидрогеназа | … NW_001492761.1 | + | |||
| DHQD2 | дегидрохиннат-дегидратаза/шикимат(хиннат)-дегидрогеназа | LGXIII | 13 101 108 | 1974817..1978681 | complement | + |
| DHQD3 | дегидрохиннат-дегидратаза/шикимат(хиннат)-дегидрогеназа | LGXIII | 13 101 108 | 1981754..1986754 | complement | + |
| DHQD4 | дегидрохиннат-дегидратаза/шикимат(хиннат)-дегидрогеназа | LGX | 21 101 489 | 4580304..4584686 | + | |
| DHQD5 | дегидрохиннат-дегидратаза/шикимат(хиннат)-дегидрогеназа | LGXIV | 14 699 529 | 6220933..6226210 | + | |
| SK1 | шикимат-киназа | … NW_001492757.1 | complement | + | ||
| SK2 | шикимат-киназа | LGV | 17 991 592 | 1995576..1998169 | complement | + |
| SK3 | шикимат-киназа | LGVII | 12 805 987 | 5135260..5138431 | complement | + |
| SKp | шикимат-киназа | LGII | 24 482 572 | 4138794..4141592 | complement | + |
| EPSPS | ЕПШФ-синтаза | LGII | 24 482 572 | 10940242..10944837 | + | |
| CS1 | хоризмат-синтаза | LGVIII | 16 228 216 | 2073382..2077810 | complement | + |
| CS2 | хоризмат-синтаза | LGX | 21 101 489 | 19004168..19008214 | + |
Регуляция
Механизмы регуляции шикиматного пути наиболее полно изучены на микроорганизмах. Прокариоты >90 % своих энергетических ресурсов тратят на биосинтез белка, основным выходом шикиматного пути у большинства прокариот являются ароматические протеиногенные аминокислоты[19][85]. Поэтому у большинства прокариот решающая роль в регуляции шикиматного пути отведена именно трём протеиногенным аминокислотам — фенилаланину, тирозину и триптофану. Внутриклеточные концентрации протеиногенных аминокислот имеют критическое значение и в случае любых других живых организмов. Но в случае растений, например, ароматические аминокислоты нельзя назвать «конечными продуктами», так как из них интенсивно синтезируются вторичные метаболиты, которые могут составлять значительную часть сухой массы[85]. Считается, что у растений шикиматный путь регулируется сложнее и преимущественно на транскрипционном уровне[86].
Регуляция шикиматного пути осуществляется посредством контроля синтеза ключевых ферментов и путём регуляции активности этих ферментов. Как и в случае большинства других метаболических путей, для шикиматного пути наиболее характерна регуляция самой первой специфической реакции (у большинства организмов — это ДАГФ-синтазная реакция). Репрессию синтеза ДАГФ-синтазы на транскрипционном уровне могут вызывать фенилаланин, тирозин и триптофан.
У большинства микроорганизмов (Escherichia coli, Erwinia, Methylobacillus capsulatus) ДАГФ-синтаза представлена тремя изозимами, каждый из которых подвержен ретроингибированию одной из трёх аминокислот — фенилаланином (ДАГФ-синтаза-[Phe]), тирозином (ДАГФ-синтаза-[Tyr]) и триптофаном (ДАГФ-синтаза-[Trp]). Доминантным ферментом является ДАГФ-синтаза-[Phe], обеспечивающая 80 % активности. У Pseudomonas ДАГФ-синтаза представлена двумя изозимами (ДАГФ-синтаза-[Tyr], ДАГФ-синтаза-[Trp]), доминантным является ДАГФ-синтаза-[Tyr]. У многих микроорганизмов ингибирующую активность помимо трёх аминокислот проявляют также фенилпируват и антранилат[87].
Фенилаланин, тирозин и триптофан помимо влияния на начальный этап шикиматного пути задействованы также в регуляции более поздних этапов собственного биосинтеза и биосинтеза друг друга. Триптофановый оперон, объединяющий гены ферментов, ответственных за путь от хоризмата к триптофану (триптофановый путь), регулируется триптофаном посредством репрессии, и феномена, получившего название аттенуации[88]. Активность ферментов, кодируемых триптофановым опероном, подвержена регуляции триптофаном по принципу обратной связи.
Помимо триптофанового оперона аттенуация показана также для так называемого фенилаланинового оперона (У Escherichia coli он двухцистронный: pheL-pheA; продукты — PheL — нефункциональный лидерный пептид, PheA — хоризматмутаза/префенатдегидратаза).
Доказано также, что у некоторых организмов значительное регуляторное влияние на ферменты шикиматного пути могут оказывать и продукты шикиматного пути, являющиеся вторичными метаболитами (например, феназиновые соединения у производящих их бактерий).
Конкретные примеры
Системы регуляторных механизмов на примерах конкретных организмов (приведены только основные регуляторные связи):[89]
Escherichia coli
Репрессия. Фенилаланин репрессирует синтез ДАГФ-синтазы-[Phe] и хоризматмутазы/префенатдегидратазы (в экспрессии оперона pheL pheA наблюдается аттенуация, лидерный пептид PheL: MKHIPFFFAFFFTFPstop). Тирозин репрессирует синтез ДАГФ-синтазы-[Tyr] и хоризматмутазы/префенатдегидрогеназы (гены этих ферментов находятся в одном опероне). Триптофан репрессирует синтез ДАГФ-синтазы-[Trp] и ферментов триптофанового оперона.
Ген шикимат-киназы aroL у Escherichia coli подвержен транскрипционному контролю тирозином[90].
Ингибирование. Фенилаланин аллостерически ингибирует активность ДАГФ-синтазы-[Phe] и хоризматмутазы/префенатдегидратазы. Тирозин аллостерически ингибирует активность ДАГФ-синтазы-[Tyr] и хоризматмутазы/префенатдегидрогеназы. Триптофан аллостерически ингибирует активность ДАГФ-синтазы-[Trp] и антранилатсинтазы/антранилат-фосфорибозилтрансферазы.
Шикимат-дегидрогеназа Escherichia coli аллостерически регулируется шикиматом[90].
Bacillus subtilis
Репрессия. Фенилаланин и тирозин репрессируют синтез ДАГФ-синтазы/хоризматмутазы. Фенилаланин репрессирует синтез префенатдегидратазы, тирозин — префенатдегидрогеназы, триптофан — ферментов триптофанового оперона.
Индукция. Хоризмат индуцирует синтез ферментов триптофанового оперона.
Ингибирование. Хоризмат и префенат аллостерически ингибируют ДАГФ-синтазную активность ДАГФ-синтазы/хоризматмутазы. Фенилаланин аллостерически ингибирует префенатдегидратазу, тирозин — префенатдегидрогеназу, триптофан — антранилатсинтазу.
Euglena gracilis
У Euglena gracilis реакции шикиматного пути при освещении протекают в хлоропластах, а в отсутствие света — в цитозоле. Это свойство связывают с очевидной рациональностью такой подстройки метаболизма под соответствующие условия освещения (исходные и макроэргические соединения, восстановительные эквиваленты легко образуются в процессе фотосинтеза). За цитозольный и хлоропласт-локализованный варианты шикиматного пути ответственны разные гены и, соответственно, разные изозимы[91].
Эволюция
Продуктами шикиматного пути являются протеиногенные аминокислоты и предшественники важнейших кофакторов; шикиматный путь достаточно консервативен, выявлен у наиболее эволюционно отдалённых организмов — представителей трёх доменов (бактерии, археи, эукариоты) и, по-видимому, не имеет альтернативы. Эти факты указывают на то, что эта система химических превращений в близком к современному виде сформировалась на заре эволюции более 3 млрд лет назад, а зародилась, вероятно, ещё до становления генетического кода. Факт специфичности для большинства архей иных начальных этапов шикиматного пути, имеющих лишь некоторые черты сходства с начальными этапами шикиматного пути бактерий и эукариот, становится в ряд с множеством других существенных отличительных признаков и согласуется с представлениями об очень раннем эволюционном обособлении этой группы живых организмов[92].
Гены и белковые продукты этих генов являются эволюционирующими образованиями. Изучение различий в структурах генов и ферментов шикиматного пути, а также различия в его регуляторных механизмах даёт ценную информацию для построения кладограмм. К примеру, изозимный состав ДАГФ-синтазы используется как филогенетический маркер. Заслуживают особого внимания многофункциональные белки — продукты слившихся генов. Слияние генов — относительно редкое эволюционное событие, а слившиеся гены достаточно устойчивы и не склонны к повторному реверсивному обособлению, поэтому слившиеся гены — маркеры, позволяющие уточнить филогенетические взаимоотношения таксонов на различных иерархических уровнях. Для исследователей происхождения и эволюционных взаимоотношений эукариот особенно привлекателен arom-суперген[91].
Прокариоты
Ферменты, осуществляющие различные реакции шикиматного пути, несмотря на некоторые аналогии в характере высших структур, каких-либо признаков гомологии не обнаруживают и их филогении совершенно различны. Это означает, что эти ферменты произошли в отдельности и эволюционировали в течение очень долгого времени до расхождения доменов Bacteria и Archaea. Это справедливо для ДАГФ-синтазы, дегидрохиннат-синтазы, дегидрохинназы, ЕПШФ-синтазы, хоризмат-синтазы[92].
Канонический шунт (синтез дегидрохинната через ДАГФ) шире распространён в природе и эволюционно древнее, чем альтернативный вариант шунта (синтез дегидрохинната через ADTH). Последний характерен для большинства архей и возник вместе с расхождением доменов бактерии и археи, путём привлечения древних примитивных ферментов с различными каталитическими функциями. Использование некоторыми филогенетически разнотипными археями пути через ДАГФ, а также обнаружение у некоторых бактерий типично архейного пути через ADTH, объясняется двунаправленным горизонтальным переносом генов, особенно часто имевшим место на ранних этапах эволюции прокариот. Есть некоторые предположения относительно причин, по которым мог возникнуть альтернативный путь биосинтеза дегидрохинната. Это могло произойти по причине малой доступности предшественника — d-эритрозо-4-фосфата (наличие альтернативного пути через ADTH у различных микроорганизмов коррелирует с отсутствием транскетолазы) и/или мог иметь значение фактор энергетической экономии, ведь фосфоенолпируват — макроэрг[92].
Если нехватка фосфоенолпирувата критична, то ДАГФ-синтазу потенциально могла бы заменить 2-кето-3-дезокси-6-фосфогалактонат-альдолаза (KDPGal-альдолаза). Этот фермент, катализируя обратимое альдольное расщепление 2-кето-3-дезокси-6-фосфогалактоната до пирувата и d-глицеральдегид-3-фосфата, способен катализировать также и аналогичную основной, побочную реакцию — альдольную конденсацию пирувата и d-эритрозо-4-фосфата с образованием ДАГФ. Хотя подобная предполагаемая возможность замены ДАГФ-синтазы KDPGal-альдолазой исследуется в экспериментах по направленной эволюции (ради перспективы получения более эффективных продуцентов),[93][94] обнаруженные в природе KDPGal-альдолазы в этом отношении слишком малоактивны и не могут функционально полностью заменить ДАГФ-синтазу[92].
Наиболее убедительным объяснением отсутствия некоторых ферментов у определённых архей является существование негомологичных изофункциональных ферментов. Так, у большинства архей вместо обычной шикимат-киназы присутствует негомологичная ей шикимат-киназа, принадлежащая к надсемейству GHMP-киназ (включает галакто-, гомосерин-, мевалонат- и фосфомевалонат- киназы) и возникшая в результате дупликации какого-то гена с последующим изменением его функции. Некоторые археи всё же имеют обычную шикимат-киназу, однако фрагментарность её таксономического распределения в домене, гетерогенность (встречается как однодоменная форма шикимат-киназы, так и бифункциональная шикимат-киназа/шикимат-дегидрогеназа), говорит о разных филогенетических корнях в пределах домена и о неоднократном горизонтальном приобретении шикимат-киназы от бактерий[92].
Эукариоты
Представляется вполне вероятным то, что эукариоты унаследовали шикиматный путь (в том числе распространённый только среди эукариот пентафункциональный белок arom) от последнего общего эукариотического предка, затем частью эукариот (Metazoa) шикиматный путь был безвозвратно утрачен в связи с гетеротрофностью, а другой частью (Plantae) он был утрачен и повторно приобретён путём симбиоза с цианобактериями, давшими, как полагают, начало пластидам. Кодирование ферментов шикиматного пути ядерным геномом растений, объясняется эндосимбиотическим переносом генов. Эволюционная история шикиматного пути в грибах, так же как и в растениях, видимо, была под влиянием событий горизонтального переноса прокариотических генов[91].
Не исключено также, что arom-суперген мог ещё не существовать во времена последнего общего эукариотического предка. В этом случае аrom-суперген, очевидно являясь очень ранней эукариотической инновацией, должен был быть распространён путём горизонтального переноса генов на самых ранних этапах эволюции эукариот[91].
Родственные метаболические пути
Гомологи ферментов шикиматного пути участвуют в других метаболических процессах (обмен углеводов и синтез вторичных метаболитов). Аминошикиматный путь — этот путь, имеющий значение для синтеза определёнными актиномицетами некоторых вторичных метаболитов (рифамицины, нафтомицины, стрептоварицин, гельданамицин, ансамитоцины, ансатриенины, митомицины и другие), эволюционно произошёл от шикиматного (отдельные ферменты гомологичны ферментам шикиматного пути и осуществляют похожие реакции).

Ингибиторы
В процессе изучения шикиматного пути, а также механизмов токсического влияния на живые организмы различных химических факторов, было обнаружено и сконструировано большое количество различных ингибиторов шикиматного пути. Многие из числа этих ингибиторов нашли применение не только в решении важных исследовательских задач, но и в практических приложениях (хороший пример — гербицид глифосат). Весьма разнообразны как структура этих синтетических и полусинтетических соединений, так и характер их влияния на ферментную систему шикиматного пути. В более простых случаях ингибитор подобен (аналог) субстрату или переходному состоянию, и непосредственно ингибирует фермент, конкурентно связываясь с его активным центром. В других случаях соединение вовлекается в путь, и лишь через определённое число шагов продукт биотрансформации соединения вызывает блокировку процесса (например, по причине наличия атома фтора в том месте, где в нормальном субстрате находится принципиально важный на данном этапе атом водорода) — так называемый «летальный синтез». Многие ингибиторы проявляют свою активность только для определённой широты круга организмов; в случае различных организмов характер ингибирующего влияния может существенно различаться. Так, к примеру, у Neurospora crassa добавляемая (6S)-6-фторшикимовая кислота метаболизируется в (6S)-6-фтор-5-енолпирувил-шикимат-3-фосфат, который конкурентно ингибирует хоризмат-синтазу,[95][96] а у Escherichia coli метаболизм вводимой (6S)-6-фторшикимовой кислоты заходит дальше и образуется 6-фторхоризмат, который не может быть субстратом в синтезе пара-аминобензоата[97].[96]

Практическое значение
Изучение шикиматного пути, его регуляторных механизмов, а также сопряжённое с этим получение, изучение и отбор различных мутантов, позволило выявить «рычаги управления» и создать качественные штаммы-продуценты ароматических аминокислот и других ценных соединений[90]. В настоящее время микробиологическое производство этих соединений экономически выгоднее, чем их химический синтез.
Шикиматный путь отсутствует у Metazoa, но некоторые патогенные для животных микроорганизмы не способны обходиться без его протекания. Поэтому шикиматный путь — потенциальная цель в борьбе с этими патогенами. In vitro было показано, что фторшикиматные аналоги ((6S)-6-фторшикимовая кислота и др.) тормозят рост Plasmodium falciparum[98].[91] Разрабатываются антибактериальные препараты, мишенью которых являются ферменты шикиматного пути[99]. К тому же, на основе болезнетворных микроорганизмов, ослабленных блокировкой шикиматного пути, возможно приготовление вакцин[100].
Конкурентный ингибитор растительной ЕПШФ-синтазы — N-(фосфонометил)-глицин (глифосат) — широко используется в качестве неселективного системного гербицида. Известно, что ЕПШФ-синтазы ряда организмов (штаммы Agrobacterium tumefaciens, Salmonella typhimurium, Klebsiella pneumoniae и др.) практически не ингибируются глифосатом. Это стало предпосылкой для создания специальных генетически модифицированных культур, достаточно резистентных к действию гербицидов на основе глифосата. Эффективность борьбы с сорняками на посевах таких культур значительно повышается (обычно имеется в виду повышение урожайности, но не снижение расхода глифосата). Установлено, что глифосат может понижать активность ещё двух ферментов шикиматного пути: ДАГФ-синтазы и дегидрохиннат-синтазы, а также оказывать некоторое влияние на активность ещё нескольких ферментов других метаболических процессов.[101]
Интересные факты
Кодоны, кодирующие аминокислоты, относящиеся к семейству шикимата (синтезируемые шикиматным путём), начинаются с U (матричная РНК, 5′→3′). Кодоны фенилаланина — UUU, UUC, кодоны тирозина — UAU, UAC, кодон триптофана — UGG (в митохондриях — ещё и UGA, являющийся в стандартном варианте генетического кода стоп-кодоном). Как правило, аминокислоты, порождаемые одним метаболическим путём, кодируются кодонами с одинаковым нуклеотидом на 5′-конце. Вероятность случайности подобной организации генетического кода достаточно низка, поэтому вполне обоснованны попытки найти объяснение. Указанный факт находит это объяснение в рамках представлений о коэволюции генетического кода и путей биосинтеза аминокислот, ставших протеиногенными аминокислотами.
Прочие факты и аспекты
Американская музыкальная группа из Беллингхэма, «Portals Align», играющая в жанре грув-метал, инструментальная музыка, прогрессивный рок, экспериментальная музыка, джент, в ноябре 2011 года записала музыкальную композицию с названием «Shikimate Pathway», на YouTube был опубликован соответствующий видеоклип[102]. Не менее любопытна также дабстеп-композиция «Shikimat» от «Toneless Bombast». На статичной заставке в клипе различимы нарисованные от руки формулы и надписи, имеющие отношение к шикиматному пути[103].
См. также
- Ароматичность и ароматизация
- Ароматические соединения
- Поликетиды, Поликетидсинтаза
- en:Aminoshikimate pathway
Наиболее известные бензоидные ароматические продукты других путей:
- Тетрагидроканнабинол — пример природного бензоидного ароматического соединения, биосинтез бензольного ядра которого происходит не шикиматным путём, а поликетидным. Второй карбоцикл (пренильного происхождения) молекулы тетрагидроканнабинола может ароматизоваться с образованием системы бифенила, что даёт молекулу каннабинола.
- Гиперицин — пример природного бензоидного ароматического соединения, образованного путём окислительной конденсации антроновой и антрахиноновой единиц поликетидного происхождения.
- Рибофлавин — важный пример природного бензоидного ароматического соединения, первичный метаболит, биосинтез которого не связан с шикиматным путём. Бензольное ядро рибофлавина строится в две реакции (обе способны происходить спонтанно в относительно мягких условиях) [104] из l-3,4-дигидроксибутан-2-он-4-фосфата (1-дезокси-l-глицеро-тетрулозо-4-фосфата), генерируемого из d-рибулозо-5-фосфата.
- Эстрадиол — пример бензоидного ароматического соединения, биосинтез бензольного ядра которого осуществляется не специализированным шикиматным путём, а в результате ароматизации, спорадически встречающейся среди метаболических превращений биогенных соединений самых различных типов. В метаболизме изопреноидных соединений, к которым относятся и стероиды, известно довольно много реакций ароматизации.
Приложение
| Реакции шикиматного пути | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Биосинтез ароматических аминокислот | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Годы открытия некоторых наиболее важных соединений, являющихся исходными, промежуточными соединениями шикиматного пути, а также продуктами шикиматного пути | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Пояснения
- Несмотря на то, что существование соединения было теоретически обосновано, обнаружить его в прямом эксперименте было непросто. Причиной сложностей при идентификации этого соединения было то, что оно находится в точке ветвления метаболического пути и преобразуется сразу по нескольким направлениям. Поэтому для обнаружения соединения потребовался особый мутантный штамм Aerobacter aerogenes, дефектный сразу по нескольким генам. Экстракты этого штамма были способны преобразовывать шикимат в антранилат. Когда же глутамин был исключён из реакционной среды, новое соединение было обнаружено.
- При исследовании генома гипертермофильной метаногенной археи Methanocaldococcus jannaschii (усиленно изучающийся модельный организм; первая архея, геном которой был полностью секвенирован) было выявлено, что гены MJ_0400 и MJ_1585 — паралоги и гомологичны гену фруктозо-1,6-дифосфат-альдолазы архейного типа класса I. Функция продуктов этих генов оставалась невыясненной и была оценена как «предположительно белок, вероятно альдолаза». В некоторых научных публикациях априори считалось, что ген MJ_0400 детерминирует фруктозо-1,6-дифосфат-альдолазу. Далее выяснилось, что белковый продукт гена MJ_1585 образует DKFP, а белковый продукт гена MJ_0400 осуществляет взаимодействие DKFP с l-аспартат-4-семиальдегидом. То есть продукты генов MJ_1585 и MJ_0400 осуществляют следующие друг за другом альдолазную (или трансальдолазную) и трансальдолазную реакции в процессе биосинтеза дегидрохинната (путь через ADTH). Позже было установлено, что продукты этих генов проявляют (не утратили) также и фруктозо-1,6-дифосфат-альдолазную активность (свойственна некоторая субстратная неизбирательность). Таким образом, экспериментальные данные говорят о том, что MJ_0400 и MJ_1585 участвуют как в центральном углеводном метаболизме, так и в шикиматном пути. Фруктозо-1,6-дифосфат-альдолазой/фосфатазой является также продукт гена MJ_0299. Ортологи генов MJ_0299, MJ_0400, MJ_1585 идентифицированы в геномах множества других архей.
Примечания
- Hermann O. L. Fischer, Gerda Dangschat. Zur Konfiguration der Shikimisäure (7. Mitteilung über Chinasäure und Derivate) (нем.) // Helvetica Chimica Acta : Научный журнал. — 1935. — Bd. 18, Nr. 1. — S. 1206—1213. — doi:10.1002/hlca.193501801167.
- Блажей А., Шутый Л. Фенольные соединения растительного происхождения = Rastlinné fenolové zlúčeniny / Перевод со словацкого А. П. Сергеева. — М.: «Мир», 1977. — С. 14. — 239 с.
- Bernard David Davis. Aromatic Biosynthesis I. The Role of Shikimic Acid (англ.) // Journal of Biological Chemistry : Научный журнал. — 1951. — Vol. 191. — P. 315—326. — PMID 14850475.
- Мецлер, том 3, 1980, с. 137.
- Мецлер, том 3, 1980, с. 137—138.
- P. R. Srinivasan, Harold T. Shigeura, Milon Sprecher, David B. Sprinson, Bernard D. Davis. The biosynthesis of shikimic acid from d-glucose (англ.) // The Journal of Biological Chemistry : Научный журнал. — 1956. — Vol. 220, no. 1. — P. 477—497. — PMID 13319365.
- Clinton E. Ballou, Hermann O. L. Fischer, D. L. MacDonald. The Synthesis and Properties of d-Erythrose 4-Phosphate (англ.) // Journal of the American Chemical Society : Научный журнал. — 1955. — Vol. 77, no. 22. — P. 5967—5970. — doi:10.1021/ja01627a053.
- P. R. Srinivasan, Masayuki Katagiri, David B. Sprinson. The conversion of phosphoenolpyruvic acid and d-erythrose-4-phosphate to 5-dehydroquinic acid (англ.) // The Journal of Biological Chemistry : Научный журнал. — 1959. — Vol. 234, no. 4. — P. 713—715. — PMID 13654248.
- P. R. Srinivasan and D. B. Sprinson. 2-Keto-3-deoxy-d-arabo-heptonic Acid 7-Phosphate Synthetase (англ.) // Journal of Biological Chemistry : Научный журнал. — 1959. — Vol. 234, no. 4. — P. 716—722. — PMID 13654249.
- Edwin B. Kalan, Bernard D. Davis, P. R. Srinivasan, David B. Sprinson. The conversion of various carbohydrates to 5-dehydroskikimic acid by bacterial extracts (англ.) // The Journal of Biological Chemistry : Научный журнал. — 1956. — Vol. 223, no. 2. — P. 907—912. — PMID 13385238.
- P. R. Srinivasan, David B. Sprinson, Edwin B. Kalan, Bernard D. Davis. The enzymatic conversion of sedoheptulose-1,7-diphosphate to shikimic acid (англ.) // The Journal of Biological Chemistry : Научный журнал. — 1956. — Vol. 223, no. 2. — P. 913—920. — PMID 13385239.
- Werner K. Maas. Bernard David Davis (1916–1994) — A Biographical Memoir by Werner K. Maas (англ.) // Biographical Memoirs : Биографические воспоминания. — 1999. — Vol. 77. — P. 50—63.
- A. J. Pittard and G. B. Cox. Frank William Ernest Gibson 1923–2008 (англ.) // Historical Records of Australian Science : Журнал, освещающий историю науки. — 2010. — Vol. 21, no. 1. — P. 55—74. — doi:10.1071/HR09024.
- Ronald W. Woodard. Unique biosynthesis of dehydroquinic acid? (Mini-review) (англ.) // Bioorganic Chemistry : Научный журнал. — 2004. — Vol. 32, no. 5. — P. 309—315. — doi:10.1016/j.bioorg.2004.06.003. — PMID 15381397.
- Robert H. White. l-Aspartate Semialdehyde and a 6-Deoxy-5-ketohexose 1-Phosphate Are the Precursors to the Aromatic Amino Acids in Methanocaldococcus jannaschii (англ.) // Biochemistry : Научный журнал. — 2004. — Vol. 43, no. 23. — P. 7618—7627. — PMID 15182204. Архивировано 15 октября 2011 года.
- Robert H. White, Huimin Xu. Methylglyoxal is an intermediate in the biosynthesis of 6-deoxy-5-ketofructose-1-phosphate: a precursor for aromatic amino acid biosynthesis in Methanocaldococcus jannaschii (англ.) // Biochemistry : Научный журнал. — 2006. — Vol. 45, no. 40. — P. 12366—12379. — doi:10.1021/bi061018a. — PMID 17014089.
- Bentley, 1990, с. 307.
- Национальный институт биоразнообразия им. А. В. Ферсмана, Лаборатория фитоинвазий: Фенольные соединения (недоступная ссылка). Дата обращения: 14 ноября 2012. Архивировано 20 декабря 2013 года.
- Klaus M. Herrmann. The Shikimate Pathway: Early Steps in the Biosynthesis of Aromatic Compounds (англ.) // The Plant Cell : Научный журнал. — 1995. — Vol. 7. — P. 907—919. — doi:10.1105/tpc.7.7.907. — PMID 12242393.
- Plant Biochemistry
- Linus Pauling. How to Live Longer and Feel Better. — W. H. Freeman and Company, 1986. — ISBN 0-380-70289-4.
- Семёнов А. А. Очерк химии природных соединений / Под ред. акад. Толстикова Г. А.. — Новосибирск: Наука, 2000. — 664 с. — 372 экз. — ISBN 5-02-031642-3.
- David H. Calhoun, Carol A. Bonner, Wei Gu, Gary Xie, Roy A. Jensen. The emerging periplasm-localized subclass of AroQ chorismate mutases, exemplified by those from Salmonella typhimurium and Pseudomonas aeruginosa (англ.) // BioMed Central : Научный журнал. — 2001. — Vol. 2, no. 8. — ISSN 1465-6914. — doi:10.1186/gb-2001-2-8-research0030. — PMID 11532214.
- Xiumei Wu. Functional Analysis of the Biosynthetic Gene Cluster of the Antitumor Agent Cetoniacytone A. — ProQuest, 2008. Архивированная копия (недоступная ссылка). Дата обращения: 1 октября 2017. Архивировано 21 октября 2013 года.
- Leuschner C., Herrmann K. M., Schultz G. The Metabolism of Quinate in Pea Roots (Purification and Partial Characterization of a Quinate Hydrolyase) (англ.) // Plant Physiology : Научный журнал. — American Society of Plant Biologists, 1995. — Vol. 108, no. 1. — P. 319—325. — doi:10.1104/pp.108.1.319. — PMID 12228477.
- Kevin A. Reynolds and Koren A. Holland. The mechanistic and evolutionary basis of stereospecificity for hydrogen transfers in enzyme-catalysed processes (англ.) // Chemical Society Reviews : Научный журнал. — 1997. — Vol. 26. — P. 337—343. — doi:10.1039/CS9972600337.
- Мецлер Д. Биохимия. Химические реакции в живой клетке = Biochemistry. The chemical reactions of living cells / Перевод с английского под ред. акад. А. Е. Браунштейна, д-ра хим. наук Л. М. Гинодмана, д-ра хим. наук Е. С. Северина. — М.: «Мир», 1980. — Т. 2. — 609 с. — 25 000 экз.
- James Staunton, Barrie Wilkinson. Biosynthesis of Erythromycin and Rapamycin (англ.) // Chemical Reviews : Научный журнал. — 1997. — Vol. 97, no. 7. — P. 2611—2630. — PMID 11851474. (недоступная ссылка)
- Heinz G. Floss. Natural products derived from unusual variants of the shikimate pathway (англ.) // Natural Product Reports : Научный журнал. — 1997. — Vol. 14, no. 5. — P. 433—452. — doi:10.1039/NP9971400433. — PMID 9364776.
- Bentley, 1990, с. 359—360.
- Leland S. Pierson III, Elizabeth A. Pierson. Metabolism and function of phenazines in bacteria: impacts on the behavior of bacteria in the environment and biotechnological processes (англ.) // Applied microbiology and biotechnology : Научный журнал. — 2010. — Vol. 86, no. 6. — P. 1659—1670. — doi:10.1007/s00253-010-2509-3. — PMID 20352425.
- Benjamin Busch, Christian Hertweck. Evolution of metabolic diversity in polyketide-derived pyrones: Using the non-colinear aureothin assembly line as a model system (англ.) // Phytochemistry : Научный журнал. — 2009. — Vol. 70, no. 15—16. — P. 1833—1840. — doi:10.1016/j.phytochem.2009.05.022. — PMID 19651421.
- Tariq A. Mukhtar, Gerard D. Wright. Streptogramins, Oxazolidinones, and Other Inhibitors of Bacterial Protein Synthesis (англ.) // Chemical Reviews : Научный журнал. — 2005. — Vol. 105, no. 2. — P. 529—542. — doi:10.1021/cr030110z. — PMID 15700955.
- J. Wongtavatchai and other — «Chloramphenicol»
- F. Gibson and J. Pittard. Pathways of biosynthesis of aromatic amino acids and vitamins and their control in microorganisms (англ.) // Bacteriological Reviews : Научный журнал. — 1968. — Vol. 32, no. 4 Pt 2. — P. 465—492. — PMID 4884716.
- Young I. G., Batterham T. J., Gibson F. The isolation, identification and properties of isochorismic acid. An intermediate in the biosynthesis of 2,3-dihydroxybenzoic acid (англ.) // Biochimica et Biophysica Acta : Научный журнал. — 1969. — Vol. 177, no. 3. — P. 389—400. — doi:10.1016/0304-4165(69)90301-8. — PMID 5787238.
- Michael S. DeClue, Kim K. Baldridge, Dominik E. Künzler, Peter Kast, and Donald Hilvert. Isochorismate Pyruvate Lyase: A Pericyclic Reaction Mechanism? (англ.) // Journal of the American Chemical Society : Научный журнал. — 2005. — Vol. 127, no. 43. — P. 15002—15003. — doi:10.1021/ja055871t. — PMID 16248620.
- Olivier Kerbarha, Dimitri Y. Chirgadzeb, Tom L. Blundellb, Chris Abell. Crystal Structures of Yersinia enterocolitica Salicylate Synthase and its Complex with the Reaction Products Salicylate and Pyruvate (англ.) // Journal of Molecular Biology : Научный журнал. — 2006. — Vol. 357, no. 2. — P. 524—534. — PMID 16434053.
- Lolita O. Zamir, Anastasia Nikolakakis, Carol A. Bonner, Roy A. Jensen. Evidence for enzymatic formation of isoprephenate from isochorismate (англ.) // Bioorganic & Medicinal Chemistry Letters : Научный журнал. — 1993. — Vol. 3, no. 7. — P. 1441—1446.
- Geza Hrazdina, Roy A. Jensen. Spatial Organization of Enzymes in Plant Metabolic Pathways (англ.) // Plant Physiology : Научный журнал. — American Society of Plant Biologists, 1992. — Vol. 43. — P. 241—267. — doi:10.1146/annurev.pp.43.060192.001325.
- Edwin Haslam. Secondary Metabolism — Fact and Fiction (англ.) // Natural Product Reports : Научный журнал. — 1986. — Vol. 3. — P. 217—249. — doi:10.1039/NP9860300217.
- Leah C. Blasiak and Jon Clardy. Discovery of 3-Formyl-Tyrosine Metabolites from Pseudoalteromonas tunicata through Heterologous Expression (англ.) // Journal of the American Chemical Society : Научный журнал. — 2010. — Vol. 132, no. 3. — P. 926—927. — doi:10.1021/ja9097862. — PMID 20041686.
- Tomoshige Hiratsuka, Kazuo Furihata, Jun Ishikawa, Haruyuki Yamashita, Nobuya Itoh, Haruo Seto, Tohru Dairi. An Alternative Menaquinone Biosynthetic Pathway Operating in Microorganisms (англ.) // Science : Научный журнал. — 2008. — Vol. 321, no. 5896. — P. 1670—1673. — doi:10.1126/science.1160446. — PMID 18801996.
- C. Arakawa, M. Kuratsu, Kazuo Furihata, Tomoshige Hiratsuka, Nobuya Itoh, Haruo Seto, Tohru Dairi. Diversity of the Early Step of the Futalosine Pathway (англ.) // Antimicrobial Agents and Chemotherapy : Научный журнал. — 2011. — Vol. 55, no. 2. — P. 913—916. — doi:10.1128/AAC.01362-10. — PMID 21098241. (недоступная ссылка)
- Arata Yajima, Saki Kouno, Tohru Dairi, Manami Mogi, Ryo Katsuta, Haruo Seto, Tomoo Nukada. Synthesis of (±)-cyclic dehypoxanthine futalosine, the biosynthetic intermediate in an alternative biosynthetic pathway for menaquinones (англ.) // Tetrahedron Letters : Научный журнал. — 2011. — Vol. 52, no. 38. — P. 4934—4937. — doi:10.1016/j.tetlet.2011.07.061.
- Jack E. Baldwin, Harjinder S. Bansal, Julia Chondrogianni, Leslie D. Field, Ahmed A. Taha, Viktor Thaller, Donald Brewer, Alan Taylor. Biosynthesis of 3-(3′-isocyanocyclopent-2-enylidene)propionic acid by Trichoderma hamatum (bon.) bain. aggr (англ.) // Tetrahedron : Научный журнал. — 1985. — Vol. 41, no. 10. — P. 1931—1938. — doi:10.1016/S0040-4020(01)96556-1.
- Robin Teufel, Thorsten Friedrich, Georg Fuchs. An oxygenase that forms and deoxygenates toxic epoxide (англ.) // Nature : Научный журнал. — 2012. — Vol. 483, no. 7389. — P. 359—362. — doi:10.1038/nature10862. — PMID 22398448.
- P. L. Dutton, W. C. Evans. The photometabolism of benzoic acid by Rhodopseudomonas palustris: a new pathway of aromatic ring metabolism (англ.) // The Biochemical journal : Научный журнал. — 1968. — Vol. 109, no. 2. — P. 5P—6P. — PMID 5679383.
- Martin Welker & Hans von Döhren. Cyanobacterial peptides — Nature’s own combinatorial biosynthesis (англ.) // FEMS Microbiology Reviews : Научный журнал. — 2006. — Vol. 30, no. 4. — P. 530—563. — doi:10.1111/j.1574-6976.2006.00022.x. — PMID 16774586.
- Sarah Mahlstedt, Elisha N. Fielding, Bradley S. Moore, and Christopher T. Walsh. Prephenate decarboxylases: a new prephenate-utilizing enzyme family that performs non-aromatizing decarboxylation en route to diverse secondary metablolites (англ.) // Biochemistry : Научный журнал. — 2010. — Vol. 49, no. 42. — P. 9021—9023. — doi:10.1021/bi101457h. — PMID 20863139.
- Jason M. Crawford, Sarah A. Mahlstedt, Steven J. Malcolmson, Jon Clardy, Christopher T. Walsh. Dihydrophenylalanine: A Prephenate-Derived Photorhabdus luminescens Antibiotic and Intermediate in Dihydrostilbene Biosynthesis (англ.) // Chemistry & Biology : Научный журнал. — 2011. — Vol. 18, no. 9. — P. 1102—1112. — doi:10.1016/j.chembiol.2011.07.009. — PMID 21944749.
- Sarah A. Mahlstedt and Christopher T. Walsh. Investigation of Anticapsin Biosynthesis Reveals a Four-Enzyme Pathway to Tetrahydrotyrosine in Bacillus subtilis (англ.) // Biochemistry : Научный журнал. — 2010. — Vol. 49, no. 5. — P. 912—923. — doi:10.1021/bi9021186. — PMID 20052993.
- Jared B. Parker and Christopher T. Walsh. Stereochemical Outcome at Four Stereogenic Centers During Conversion of Prephenate to Tetrahydrotyrosine by BacABGF in the Bacilysin Pathway (англ.) // Biochemistry : Научный журнал. — 2012. — Vol. 51, no. 28. — P. 5622—5632. — doi:10.1021/bi3006362. — PMID 22765234.
- Matthew D. Hilton, N. Gurdal Alaeddinoglu, Arnold L. Demain. Synthesis of Bacilysin by Bacillus subtilis Branches from Prephenate of the Aromatic Amino Acid Pathway (англ.) // American Society for Microbiology : Научный журнал. — American Society for Microbiology, 1988. — Vol. 170, no. 1. — P. 482—484. — PMID 3121591.
- Yoshio Takeda, Vivien Mak, Chid-Chin Chang, Ching-Jer Chang, Heinz G. Floss. Biosynthesis of ketomycin (англ.) // The Journal of Antibiotics (Tokyo) : Научный журнал. — 1984. — Vol. 37, no. 8. — P. 868—875. — doi:10.7164/antibiotics.37.868. — PMID 6384167.
- Jean Favre-Bonvin, Jacques Bernillon, Nadia Salin, Noel Arpin. Biosynthesis of mycosporines: Mycosporine glutaminol in Trichothecium roseum (англ.) // Phytochemistry : Научный журнал. — 1987. — Vol. 26, no. 9. — P. 2509—2514. — doi:10.1016/S0031-9422(00)83866-2.
- Jose I. Carreto and Mario O. Carignan. Mycosporine-Like Amino Acids: Relevant Secondary Metabolites. Chemical and Ecological Aspects (англ.) // Marine Drugs : Научный журнал. — 2011. — Vol. 9, no. 3. — P. 387—446. — doi:10.3390/md9030387. — PMID 21556168.
- V. P. Maier, D. M. Metzler, A. F. Huber. 3-O-Caffeoylshikimic acid (dactylifric acid) and its isomers, a new class of enzymic browning substrates (англ.) // Biochemical and Biophysical Research Communications : Научный журнал. — 1964. — Vol. 14, no. 2. — P. 124—128. — doi:10.1016/0006-291X(64)90241-4. — PMID 5836492.
- Nobuji Nakatani, Shin-ichi Kayano, Hiroe Kikuzaki, Keiko Sumino, Kiyoshi Katagiri, Takahiko Mitani. Identification, Quantitative Determination, and Antioxidative Activities of Chlorogenic Acid Isomers in Prune (Prunus domestica L.) (англ.) // Journal of Agricultural and Food Chemistry : Научный журнал. — 2000. — Vol. 48, no. 11. — P. 5512—5516. — doi:10.1021/jf000422s. — PMID 11087511.
- Yadu D. Tewari, N. Kishore, R. H. Bauerle, W. R. LaCourse, Robert N. Goldberg. Thermochemistry of the Reaction {Phosphoenolpyruvate(aq) + d-Erythrose 4-Phosphate(aq) + H2O(1) = 2-Dehydro-3-Deoxy-d-Arabino-Heptonate 7-Phosphate(aq) + Phosphate(aq)} (англ.) // Journal of Chemical Thermodynamics : Научный журнал. — 2001. — Vol. 33, no. 12. — P. 1791—1805.
- NIST — Thermodynamics of Enzyme-Catalyzed Reactions
- Yadu D. Tewari, Robert N. Goldberg, Alastair R. Hawkins, Heather K. Lamb. A thermodynamic study of the reactions: {2-dehydro-3-deoxy-d-arabino-heptanoate 7-phosphate(aq) = 3-dehydroquinate(aq) + phosphate(aq)} and {3-dehydroquinate(aq) = 3-dehydroshikimate(aq) + H2O(l)} (англ.) // Journal of Chemical Thermodynamics : Научный журнал. — 2002. — Vol. 34, no. 10. — P. 1671—1691. — ISSN 0021-9614. — doi:10.1016/S0021-9614(02)00226-4.
- P. R. Andrews and R. C. Haddon. Molecular Orbital Studies of Enzyme Catalysed Reactions. Rearrangement of Chorismate to Prephenate (англ.) // Australian Journal of Chemistry : Научный журнал. — 1979. — Vol. 32, no. 9. — P. 1921—1929. — doi:10.1071/CH9791921.
- Peter Kast, Yadu B. Tewari, Olaf Wiest, Donald Hilvert, Kendall N. Houk, Robert N. Goldberg. Thermodynamics of the Conversion of Chorismate to Prephenate: Experimental Results and Theoretical Predictions (англ.) // Journal of Physical Chemistry B : Научный журнал. — 1997. — Vol. 101, no. 50. — P. 10976—10982. — doi:10.1021/jp972501l. (недоступная ссылка)
- KEGG — Toluene degradation — Reference pathway
- KEGG — Polycyclic aromatic hydrocarbon degradation — Reference pathway
- KEGG — Benzoate degradation — Reference pathway
- KEGG — Aminobenzoate degradation — Reference pathway
- Мецлер, том 3, 1980, задание 15, с. 177.
- R. S. Chaleff. The Inducible Quinate-Shikimate Catabolic Pathway in Neurospora crassa: Induction and Regulation of Enzyme Synthesis (англ.) // Journal of general microbiology : Научный журнал. — 1974. — Vol. 81, no. 2. — P. 357—372. — doi:10.1099/00221287-81-2-357. — PMID 4275849. (недоступная ссылка)
- Haruhiko Teramoto, Masayuki Inui, and Hideaki Yukawa. Regulation of Expression of Genes Involved in Quinate and Shikimate Utilization in Corynebacterium glutamicum (англ.) // Applied and environmental microbiology : Научный журнал. — 2009. — Vol. 75, no. 11. — P. 3461—3468. — doi:10.1128/AEM.00163-09. — PMID 19376919.
- Herrmann, 1999, p. 473, 476, 480, 483, 487, 488, 492.
- Leonardo Negron, Mark L. Patchett, and Emily J. Parker. Expression, Purification, and Characterisation of Dehydroquinate Synthase from Pyrococcus furiosus (англ.). — 2011. — doi:10.4061/2011/134893. — PMID 21603259.
- Uniprot — Pentafunctional AROM polypeptide Rhizoctonia solani
- Mary K. B. Berlyn. Linkage map of Escherichia coli K-12, edition 10: the traditional map (англ.) // Microbiology and molecular biology reviews : Научный журнал. — 1998. — Vol. 62, no. 3. — P. 814—984. — PMID 9729611.
- NCBI — Phenylalanine, tyrosine and tryptophan biosynthesis — Escherichia coli str. K-12 substr. MG1655
- NCBI — Chorismate biosynthesis biosystem — Escherichia coli str. K-12 substr. MG1655
- NCBI — Chorismate biosynthesis biosystem — Microcystis aeruginosa NIES-843
- NCBI — Chorismate biosynthesis biosystem — Streptomyces avermitilis MA-4680
- NCBI — Chorismate biosynthesis biosystem — Bacillus subtilis BSn5
- NCBI — Phenylalanine, tyrosine and tryptophan biosynthesis — Methanocaldococcus jannaschii DSM 2661
- NCBI — Chorismate biosynthesis biosystem — Aeropyrum pernix K1
- NCBI — Chorismate biosynthesis biosystem — Saccharomyces cerevisiae S288c
- NCBI — Chorismate biosynthesis biosystem — Populus trichocarpa
- Klaus M. Herrmann. The Shikimate Pathway as an Entry to Aromatic Secondary Metabolism (англ.) // Plant Physiology : Научный журнал. — American Society of Plant Biologists, 1995. — Vol. 107, no. 1. — P. 7—12. — doi:10.1104/pp.107.1.7. — PMID 7870841.
- Hiroshi Maeda and Natalia Dudareva. The Shikimate Pathway and Aromatic Amino Acid Biosynthesis in Plants (англ.) // Annual Review of Plant Biology : Научный журнал. — 2012. — Vol. 63. — P. 73—105. — doi:10.1146/annurev-arplant-042811-105439. — PMID 22554242.
- Максимова Н. П. и соавт. — «Генетические подходы к созданию штаммов-продуцентов биологически активных соединений»; Минск, БГУ, 2009 г.
- Бокуть С. Б., Герасимович Н. В., Милютин А. А. Молекулярная биология: молекулярные механизмы хранения, воспроизведения и реализации генетической информации / под ред. Мельник Л. С., Касьяновой Л. Д.. — Минск: Вышэйшая школа, 2005. — 463 с. — 3000 экз. — ISBN 985-06-1045-X.
- Гусев М. В., Минеева Л. А. Микробиология / Рецензенты: кафедра микробиологии Ленинградского государственного университета. — 2-е изд. — М.: Издательство Московского университета, 1985. — 376 с. — 10 200 экз.
- Johannes Bongaerts, Marco Krämer, Ulrike Müller, Leon Raeven, Marcel Wubbolts. Metabolic Engineering for Microbial Production of Aromatic Amino Acids and Derived Compounds (англ.) // Metabolic Engineering : Научный журнал. — 2001. — Vol. 3, no. 4. — P. 289—300. — doi:10.1006/mben.2001.0196. — PMID 11676565.
- Thomas A. Richards, Joel B. Dacks, Samantha A. Campbell, Jeffrey L. Blanchard, Peter G. Foster, Rima McLeod and Craig W. Roberts. Evolutionary Origins of the Eukaryotic Shikimate Pathway: Gene Fusions, Horizontal Gene Transfer, and Endosymbiotic Replacements (англ.) // Eukaryotic Cell : Научный журнал. — 2006. — Vol. 5, no. 9. — P. 1517—1531. — doi:10.1128/EC.00106-06. — PMID 16963634.
- Xiao-Yang Zhi, Ji-Cheng Yao, Hong-Wei Li, Ying Huang, Wen-Jun Li. Genome-wide identification, domain architectures and phylogenetic analysis provide new insights into the early evolution of shikimate pathway in prokaryotes (англ.) // Molecular Phylogenetics and Evolution : Научный журнал. — Academic Press, 2014. — Vol. 75. — P. 154—164. — doi:10.1016/j.ympev.2014.02.015. — PMID 24602988.
- Ningqing Ran, K. M. Draths, and J. W. Frost. Creation of a shikimate pathway variant (англ.) // Journal of the American Chemical Society : Научный журнал. — 2004. — Vol. 126, no. 22. — P. 6856—6857. — doi:10.1021/ja049730n. — PMID 15174841.
- Ningqing Ran and John W. Frost. Directed Evolution of 2-Keto-3-deoxy-6-phosphogalactonate Aldolase To Replace 3-Deoxy-d-arabino-heptulosonic Acid 7-Phosphate Synthase (англ.) // Journal of the American Chemical Society : Научный журнал. — 2007. — Vol. 129, no. 19. — P. 6130—6139. — doi:10.1021/ja067330p. — PMID 17451239.
- Shankar Balasubramanian, Gareth M. Davies, John R. Coggins, Chris Abell. Inhibition of chorismate synthase by (6R)- and (6S)-6-fluoro-5-enolpyruvylshikimate 3-phosphate (англ.) // Journal of the American Chemical Society : Научный журнал. — 1991. — Vol. 113, no. 23. — P. 8945—8946. — doi:10.1021/ja00023a051.
- Stephen Bornemann, Manoj K. Ramjee, Shankar Balasubramanian, Chris Abell, John R. Coggins, David J. Lowe and Roger N. F. Thorneley. Escherichia coli chorismate synthase catalyzes the conversion of (6S)-6-fluoro-5-enolpyruvylshikimate-3-phosphate to 6-fluorochorismate. Implications for the enzyme mechanism and the antimicrobial action of (6S)-6-fluoroshikimate (англ.) // Journal of Biological Chemistry : Научный журнал. — 1995. — Vol. 270, no. 39. — P. 22811—22815. — doi:10.1074/jbc.270.39.22811. — PMID 7559411.
- Gareth M. Davies, Keith J. Barrett-Bee, David A. Jude, Malcolm Lehan, Wright W. Nichols, Philip E. Pinder, John L. Thain, William J. Watkins, and R. Geoffrey Wilson. (6S)-6-fluoroshikimic acid, an antibacterial agent acting on the aromatic biosynthetic pathway (англ.) // Antimicrobial Agents and Chemotherapy : Научный журнал. — 1994. — Vol. 38, no. 2. — P. 403—406. — doi:10.1128/AAC.38.2.403. — PMID 8192477.
- Glenn A. McConkey. Targeting the shikimate pathway in the malaria parasite Plasmodium falciparum (англ.) // Antimicrobial Agents and Chemotherapy : Научный журнал. — 1999. — Vol. 43, no. 1. — P. 175—177. — PMID 9869588.
- Vivian Wing Ngar Cheung, Bo Xue, Maria Hernandez-Valladares, Maybelle Kho Go, Alvin Tung, Adeleke H. Aguda, Robert C. Robinson, Wen Shan Yew. Identification of Polyketide Inhibitors Targeting 3-Dehydroquinate Dehydratase in the Shikimate Pathway of Enterococcus faecalis (англ.) // PLOS One : Научный журнал. — Public Library of Science, 2014. — Vol. 9, no. 7. — doi:10.1371/journal.pone.0103598. — PMID 25072253.
- O’Callaghan D., Maskell D., Liew F. Y., Easmon C. S. and Dougan G. Characterization of aromatic- and purine-dependent Salmonella typhimurium: attention, persistence, and ability to induce protective immunity in BALB/c mice (англ.) // Infection and Immunity : Научный журнал. — 1988. — Vol. 56, no. 2. — P. 419—423. — PMID 3276625.
- Bentley, 1990, с. 314, 318, 326.
-
.svg.png.webp) Portals Align — Shikimate Pathway (playthrough)
Portals Align — Shikimate Pathway (playthrough) -
.svg.png.webp) Toneless Bombast — Shikimat
Toneless Bombast — Shikimat - Мецлер, том 3, 1980, с. 175.
- K. Lohmann, O. Meyerhof. Über die enzymatische Umwandlung von Phosphoglycerinsäure in Brenztraubensäure und Phosphorsäure (нем.) // Biochem. Zeit. : Научный журнал. — 1934. — Bd. 273.
- Giorgio Semenza, Anthony John Turner. Selected Topics In The History Of Biochemistry: Personal Recollections IX / Giorgio Semenza. — Amsterdam, London: Elsevier, Gulf Professional Publishing, 2005. — Т. 44. — 438 с. — (Comprehensive Biochemistry). — ISBN 0-444-51866-5.
- B. L. Horecker, P. Z. Smyrniotis. Transaldolase: the formation of fructose-6-phosphate from sedoheptulose-7-phosphate (англ.) // Journal of the American Chemical Society : Научный журнал. — 1953. — Vol. 75, no. 8. — P. 2021—2022. — ISSN 0002-7863. — doi:10.1021/ja01104a532.
- Proceedings of the Biochemical Society. The 342nd Meeting of the Biochemical Society, Department of Agricultural Chemistry, University College of North Wales, Bangor, on 15 July 1955
- B. Davis, U. Weiss. Aromatic biosynthesis. VIII. The roles of 5-dehydroquinic acid and quinic acid (англ.) // Naunyn-Schmiedebergs Archiv für Experimentelle Pathologie und Pharmakologie : Научный журнал. — 1953. — Vol. 220, no. 1—2. — P. 1—15. — PMID 13132923.
- Ulrich Weiss, Bernard D. Davis, Elizabeth S. Mingioli. Aromatic Biosynthesis. X. Identification of an Early Precursor as 5-Dehydroquinic Acid (англ.) // Journal of the American Chemical Society : Научный журнал. — 1953. — Vol. 75, no. 22. — P. 5572—5576. — doi:10.1021/ja01118a028.
- Bernard David Davis. Aromatic biosynthesis. IV. Preferential Conversion, in Incompletely Blocked Mutants, of a Common Precursor of Several Metabolites (англ.) // American Society for Microbiology : Научный журнал. — American Society for Microbiology, 1952. — Vol. 64, no. 5. — P. 729—748. — PMID 12999704.
- Bernard David Davis. Aromatic biosynthesis. V. Antagonism between Shikimic Acid and its Precursor, 5-Dehydroshikimic Acid (англ.) // American Society for Microbiology : Научный журнал. — American Society for Microbiology, 1952. — Vol. 64, no. 5. — P. 749—763. — PMID 12999705.
- Ivan I. Salamon, Bernard D. Davis. Aromatic Biosynthesis. IX. The Isolation of a Precursor of Shikimic Acid (англ.) // Journal of the American Chemical Society : Научный журнал. — 1953. — Vol. 75, no. 22. — P. 5567—5571. — doi:10.1021/ja01118a027.
- J. F. Eijkman. Sur les principes constituants de l’Illicium religiosum (Sieb.) (Shikimi-no-ki en japonais) (фр.) // Recueil des Travaux Chimiques des Pays-Bas : Научный журнал. — 1885. — Vol. 4. — P. 49—53.
- Shende Jiang, Gurdial Singh. Chemical Synthesis of Shikimic Acid and Its Analogues (англ.) // Tetrahedron : Научный журнал. — 1998. — Vol. 54, no. 19. — P. 4697—4753. Архивировано 27 сентября 2007 года.
- Bernard D. Davis and Elizabeth S. Mingioli. Aromatic biosynthesis. VII. Accumulation of two derivatives of shikimic acid by bacterial mutants (англ.) // American Society for Microbiology : Научный журнал. — American Society for Microbiology, 1953. — Vol. 66, no. 2. — P. 129—136. — PMID 13084547.
- Ulrich Weiss, Elizabeth S. Mingioli. Aromatic Biosynthesis. XV. The Isolation and Identification of Shikimic Acid 5-Phosphate (англ.) // Journal of the American Chemical Society : Научный журнал. — 1956. — Vol. 78, no. 12. — P. 2894—2898. — doi:10.1021/ja01593a067.
- J. G. Levin, D. B. Sprinson. The formation of 3-enolpyruvyl shikimate 5-phosphate in extracts of Escherichia coli (англ.) // Biochemical and Biophysical Research Communications : Научный журнал. — 1960. — Vol. 3. — P. 157—163. — doi:10.1016/0006-291X(60)90214-X. — PMID 14416213.
- Margaret I. Gibson, Frank Gibson. A new intermediate in aromatic biosynthesis (англ.) // Biochimica et Biophysica Acta : Научный журнал. — 1962. — Vol. 19, no. 65. — P. 160—163. — doi:10.1016/0006-3002(62)90166-X. — PMID 13947735.
- F. Gibson and L. M. Jackman. Structure of chorismic acid, a new intermediate in aromatic biosynthesis (англ.) // Nature : Научный журнал. — 1963. — Vol. 198. — P. 388—389. — doi:10.1038/198388a0. — PMID 13947720.
- U. Weiss, C. Gilvarg, E. S. Mingioli, B. D. Davis. Aromatic biosynthesis XI. The aromatization step in the synthesis of phenylalanine (англ.) // Science : Научный журнал. — 1954. — Vol. 119. — P. 774—775. — doi:10.1126/science.119.3100.774. — PMID 13168367.
- Sherry L. Stenmark, Duane L. Pierson, Roy A. Jensen, George I. Glover. Blue-Green Bacteria synthesise l-Tyrosine by the Pretyrosine Pathway (англ.) // Nature : Научный журнал. — 1974. — Vol. 247, no. 439. — P. 290—292. — doi:10.1038/247290a0. — PMID 4206476.
- Якубке Х.-Д., Ешкайт Х. Аминокислоты, пептиды, белки = Aminosäuren, Peptide, Proteine / Перевод с немецкого канд. хим. наук Н. П. Запеваловой и канд. хим. наук Е. Е. Максимова, под ред. д-ра хим. наук, проф. Ю. В. Митина. — 3. — М.: «Мир», 1985. — 457 с. — 2700 экз.
- Овчинников Ю. А. Биоорганическая химия / редактор Королева Н. В.. — М.: «Просвещение», 1987. — 816 с. — 10 500 экз.
Литература
- Бартон Д., Оллис У. Д., Хаслам Э. (ред.). Общая органическая химия = Comprehensive organic chemistry / Перевод с английского под ред. Н. К. Кочеткова. — М.: «Химия», 1986. — Т. 11 (Липиды, углеводы, макромолекулы, биосинтез). — С. 685—724. — 736 с.
- Мецлер Д. Биохимия. Химические реакции в живой клетке = Biochemistry. The chemical reactions of living cells / Перевод с английского под ред. акад. А. Е. Браунштейна, д-ра хим. наук Л. М. Гинодмана, д-ра хим. наук Е. С. Северина. — М.: «Мир», 1980. — Т. 3. — 488 с. — 25 000 экз.
Теме шикиматного пути посвящён ряд обзорных публикаций:
- Ronald Bentley. The shikimate pathway — a metabolic tree with many branches (англ.) // Critical Reviews in Biochemistry and Molecular Biology : Научный журнал. — 1990. — Vol. 25, no. 5. — P. 307—384. — doi:10.3109/10409239009090615. — PMID 2279393.
- Paul M. Dewick. The Shikimate Pathway: Aromatic Amino Acids and Phenylpropanoids // Medicinal Natural Products: A Biosynthetic Approach. — 3rd edition. — 2009. — P. 137—186. — 539 p.
- Klaus M. Herrmann, Lisa M. Weaver. THE SHIKIMATE PATHWAY (англ.) // Plant Physiology : Научный журнал. — American Society of Plant Biologists, 1999. — Vol. 50. — P. 473—503. — doi:10.1146/annurev.arplant.50.1.473. — PMID 15012217.
Монография:
- Edwin Haslam. The Shikimate Pathway. — first editions. — London: Butterworths, 1974. — 316 p. — (Biosythesis of natural products series). — ISBN 0-470-35882-3.
Отчёт по симпозиуму, прошедшему 12—16 июня 1985 в Asilomar Conference Center, Пасифик Гров, Калифорния, США (главный редактор Eric E. Conn):
- Heinz G. Floss. The Shikimate Pathway — An Overview (англ.) // Recent Advances in Phytochemistry : Научный журнал. — 1986. — Vol. 20. — P. 13—55. — doi:10.1007/978-1-4684-8056-6_2.
Ссылки
- Phenylalanine, tyrosine and tryptophan biosynthesis — Reference pathway (англ.). KEGG. Дата обращения: 29 апреля 2013. Архивировано 12 мая 2013 года.
- Aromatic Compounds Biosynthesis (англ.). MetaCyc. Дата обращения: 6 мая 2013. Архивировано 12 мая 2013 года.
- Shikimate and Chorismate Biosynthesis (англ.). IUBMB. Дата обращения: 6 мая 2013. Архивировано 12 мая 2013 года.
- SKPDB (ShiKimate Pathway DataBase) (англ.). Дата обращения: 6 мая 2013. Архивировано 12 мая 2013 года.
- Как осуществляется биосинтез фенольных соединений?. PharmSpravka.ru. Дата обращения: 6 мая 2013.
- Биосинтез фенольных соединений. Дата обращения: 6 мая 2013.
- The Shikimic Acid Pathway (англ.). Plant Physiology (online). Дата обращения: 6 мая 2013. Архивировано 12 мая 2013 года.
- Shikimisäure-Weg (нем.). Spektrum der Wissenschaft. Дата обращения: 21 июля 2014.
- Chorismate Is a Key Intermediate in the Synthesis of Tryptophan, Phenylalanine, and Tyrosine (англ.). Principles of Biochemistry (online). Дата обращения: 6 мая 2013. Архивировано 12 мая 2013 года.