Аминоацил-тРНК-синтетаза
Аминоацил-тРНК-синтетаза (АРСаза) — фермент (синтетаза), катализирующий образование аминоацил-тРНК в реакции этерификации определённой аминокислоты с соответствующей ей молекулой тРНК. Для каждой протеиногенной аминокислоты существует по меньшей мере одна аминоацил-тРНК-синтетаза.
| Антикодон-связывающий домен | |
|---|---|
 лейцил-тРНК-синтетаза из Thermus thermophilus | |
| Идентификаторы | |
| Символ | Anticodon_1 |
| Pfam | PF08264 |
| InterPro | IPR013155 |
| SCOP | 1ivs |
| SUPERFAMILY | 1ivs |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| DALR антикодон-связывающий домен 1 | |
|---|---|
 аргинил-тРНК-синтетаза из Thermus thermophilus | |
| Идентификаторы | |
| Символ | DALR_1 |
| Pfam | PF05746 |
| Pfam clan | CL0258 |
| InterPro | IPR008909 |
| SCOP | 1bs2 |
| SUPERFAMILY | 1bs2 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| DALR антикодон-связывающий домен 2 | |
|---|---|
 Структуры цистеинил-тРНК-синтетазы в комплексе с тРНКCys | |
| Идентификаторы | |
| Символ | DALR_2 |
| Pfam | PF09190 |
| Pfam clan | CL0258 |
| InterPro | IPR015273 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
АРСазы обеспечивают соответствие нуклеотидным триплетам генетического кода (антикодону тРНК) встраиваемых в белок аминокислот и, таким образом, обеспечивают правильность происходящего в дальнейшем считывания генетической информации с мРНК при синтезе белков на рибосомах.
Аминоацилирование
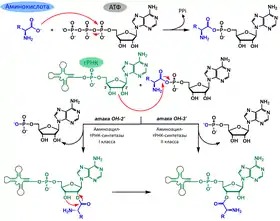
аминокислота + АТФ → аминоацил-АМФ + PPi— АТФ активирует аминокислотуаминоацил-AМФ + тРНК → аминоацил-тРНК + АМФ— активированная аминокислота соединяется с соответствующей тРНК
Суммарное уравнение двух реакций:
аминокислота + тРНК + АТФ → аминоацил-тРНК + АМФ + PPi
Механизм аминоацилирования
Сначала в активном центре синтетазы связываются соответствующая аминокислота и АТФ. Из трёх фосфатных групп АТФ две отщепляются, образуя молекулу пирофосфата (PPi), а на их место становится аминокислота. Образованное соединение (аминоацил-аденилат) состоит из ковалентно связанных высокоэнергетической связью аминокислотного остатка и АМФ. Энергии, содержащейся в этой связи, хватает на все дальнейшие этапы, необходимые для того, чтобы аминокислотный остаток занял своё место в полипептидной цепи (то есть в белке). Аминоацил-аденилаты нестабильны и легко гидролизуются, если диссоциируют из активного центра синтетазы. Когда аминоацил-аденилат сформирован, с активным центром синтетазы связывается 3′-конец тРНК, антикодон которой соответствует активируемой этой синтетазой аминокислоте. Происходит перенос аминокислотного остатка с аминоацил-аденилата на 2′- либо 3′-ОН группу рибозы, входящей в состав последнего на 3′-конце аденина тРНК. Таким образом синтезируется аминоацил-тРНК, то есть тРНК, несущая ковалентно присоединённый аминокислотный остаток. От аминоацил-аденилата при этом остаётся только АМФ. И аминоацил-тРНК, и АМФ освобождаются активным центром.
Безошибочность узнавания аминокислот
Каждая из 20 аминоацил-тРНК синтетаз должна всегда прикреплять к тРНК только свою аминокислоту, узнавая только одну из 20 протеиногенных аминокислот и не связывая другие похожие молекулы, содержащиеся в цитоплазме клетки. Аминокислоты значительно меньше тРНК по размерам, неизмеримо проще по структуре, поэтому их узнавание является значительно большей проблемой, чем узнавание нужной тРНК. В действительности ошибки имеют место, но их уровень не превышает одной на 10 000 — 100 000 синтезированных аминоацил-тРНК[1].
Некоторые аминокислоты отличаются друг от друга очень слабо, например, лишь одной метильной группой (изолейцин и валин, аланин и глицин). Для таких случаев во многих аминоацил-тРНК синтетазах эволюционировали механизмы, избирательно расщепляющие ошибочно синтезированные продукты. Процесс их распознавания и гидролиза называют редактированием. Избирательное расщепление аминоацил-аденилата называют претрансферным редактированием, так как оно происходит до переноса аминокислотного остатка на тРНК, а расщепление готовой аминоацил-тРНК — посттрансферным редактированием. Претрансферное редактирование, как правило, происходит в том же активном центре, что и аминоацилирование. Посттрансферное редактирование требует попадания 3′-конца аминоацил-тРНК с прикреплённым к нему остатком аминокислоты во второй активный центр аминоацил-тРНК синтетазы — редактирующий. Этот второй активный центр есть не у всех аминоацил-тРНК синтетаз, а у тех, у которых есть, находится в отдельном домене глобулы фермента. Встречаются также свободно плавающие ферменты, участвующие в посттрансферном редактировании. После гидролиза разъединённые аминокислота и тРНК (или аминокислота и АМФ) высвобождаются в раствор[2].
Классификация
Все аминоацил-тРНК-синтетазы произошли от двух предковых форм и объединены на основе структурного сходства в два класса. Эти классы отличаются по доменной организации, структуре главного (аминоацилирующего) домена, способу связывания и аминоацилирования тРНК.[3]
Аминоацил-тРНК-синтетазы первого класса — ферменты, переносящие остаток аминокислоты на 2′-ОН группу рибозы; второго класса — ферменты, переносящие остаток аминокислоты на 3′-ОН группу концевой рибозы тРНК.
Аминоацилирующий домен аминоацил-тРНК-синтетаз 1-го класса образован так называемой укладкой Россмана, в основе которой лежит параллельный β-лист. Ферменты 1-го класса являются в большинстве случаев мономерами. 76-й аденозин тРНК они аминоацилируют по 2′-ОН группе.
Ферменты 2-го класса имеют в основе структуры аминоацилирующего домена антипараллельный β-лист. Как правило, они являются димерами, то есть имеют четвертичную структуру. За исключением фенилаланил-тРНК синтетазы, все они аминоацилируют 76-й аденозин тРНК по 3′-ОН группе.
Аминокислоты по классам аминоацил-тРНК-синтетаз:
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
Каждый класс дополнительно делится на 3 подкласса — a, b и c по структурному сходству. Зачастую аминоацил-тРНК-синтетазы одной и той же специфичности (напр., пролил-тРНК синтетаза) существенно отличаются друг у друга у бактерий, архебактерий и эукариот. Тем не менее, ферменты одной специфичности почти всегда более сходны между собой, чем с ферментами других специфичностей. Исключение составляют две различные лизил-тРНК синтетазы, одна из которых относится к 1-му классу, а другая — ко 2-му.
| КФ | Фермент | Аминокислота | Ген, Homo sapiens |
|---|---|---|---|
| 6.1.1.1 | тирозил-тРНК синтетаза | тирозин | YARS |
| 6.1.1.2 | триптофанил-тРНК синтетаза | триптофан | WARS |
| 6.1.1.3 | треонил-тРНК синтетаза | треонин | TARS |
| 6.1.1.4 | лейцил-тРНК синтетаза | лейцин | LARS |
| 6.1.1.5 | изолейцил-тРНК синтетаза | изолейцин | IARS |
| 6.1.1.6 | лизил-тРНК синтетаза | лизин | KARS |
| 6.1.1.7 | аланин-тРНК синтетаза | аланин | AARS |
| 6.1.1.9 | валил-тРНК синтетаза | валин | VARS |
| 6.1.1.10 | метионил-тРНК синтетаза | метионин | MARS |
| 6.1.1.11 | серил-тРНК синтетаза | серин | SARS |
| 6.1.1.12 | аспартил-тРНК синтетаза | аспартат | DARS |
| 6.1.1.14 | глицил-тРНК синтетаза | глицин | GARS |
| 6.1.1.15 | пролил-тРНК синтетаза, глутамил-пролил-тРНК синтетаза | пролин | PARS2, EPRS1 |
| 6.1.1.16 | цистеил-тРНК синтетаза | цистеин | CARS |
| 6.1.1.17 | глутамил-тРНК синтетаза, глутамил-пролил-тРНК синтетаза | глутамат | EARS2, EPRS1 |
| 6.1.1.18 | глутаминил-тРНК синтетаза | глутамин | QARS |
| 6.1.1.19 | аргинил-тРНК синтетаза | аргинин | RARS |
| 6.1.1.20 | фенилаланил-тРНК синтетаза | фенилаланин | FARSA, FARSB |
| 6.1.1.21 | гистидил-тРНК синтетаза | гистидин | HARS |
| 6.1.1.22 | аспарагинил-тРНК синтетаза | аспарагин | NARS |
| 6.1.1.23 | аспартил-тРНК-Asn синтетаза | аспартат | нет у человека |
| 6.1.1.24 | глутамил-тРНК-Gln синтетаза | глутамат | нет у человека |
| 6.1.1.26 | пирролизил-тРНК-Pyl синтетаза | пирролизин | нет у человека |
| 6.1.1.27 | O-фосфо-L-серил-тРНК синтетаза | O-фосфо-L-серин | нет у человека |
Доменная организация
Каждая молекула аминоацил-тРНК синтетазы состоит из двух основных доменов — аминоацилирующего, в котором располагается активный центр и происходят реакции, и антикодон-связывающего, узнающего последовательность антикодона тРНК. Также часто встречаются редактирующие домены, служащие для гидролиза аминоацил-тРНК, несущих не тот аминокислотный остаток, и другие домены[4].
Эволюция
В добелковой жизни (РНК-мире) функцию аминоацил-тРНК синтетаз выполняли, по всей видимости, рибозимы, то есть молекулы РНК, обладающие каталитическими свойствами. В настоящее время такие молекулы воссозданы в лаборатории методом «эволюции в пробирке»[5]. После становления основных элементов аппарата белкового синтеза функция аминоацилирования тРНК перешла к белковым молекулам, восходящим к двум предковым последовательностям. Первоначально эти ферменты состояли только из одного, аминоацилирующего, домена. По мере становления генетического кода росло разнообразие аминоацил-тРНК синтетаз и повышались требования к их специфичности. Это и привело к включению в их структуру дополнительных доменов. Первичная последовательность аминоацил-тРНК синтетаз за время их эволюции дивергировала очень существенно, что, впрочем, не помешало обнаружить в пределах каждого из классов гомологию как первичной последовательности, так и третичной (пространственной) структуры[4].
Технологические перспективы
Мутантные аминоацил-тРНК синтетазы и тРНК используются для включения в белки аминокислот, не предусмотренных генетическим кодом[6].
Примечания
- The frequency of errors in protein biosynthesis. Дата обращения: 11 августа 2010.
- Alternative pathways for editing non-cognate amino acids by aminoacyl-tRNA synthetases.. Дата обращения: 11 августа 2010.
- 6289/pdf/347203a0.pdf Partition of tRNA synthetases into two classes based on mutually exclusive sets of sequence motifs. (недоступная ссылка — 6289/pdf/347203a0.pdf история ). Дата обращения: 11 августа 2010.
- On the evolution of structure in aminoacyl-tRNA synthetases.. Дата обращения: 3 ноября 2011. Архивировано 5 апреля 2012 года.
- Ribozyme-catalyzed tRNA aminoacylation.. Дата обращения: 11 августа 2010. Архивировано 5 апреля 2012 года.
- Site-specific incorporation of an unnatural amino acid into proteins in mammalian cells.. Дата обращения: 11 августа 2010. Архивировано 5 апреля 2012 года.