Лизин
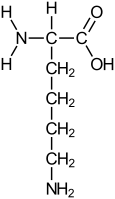
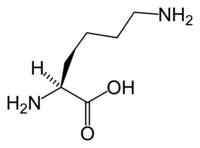
Лизи́н (2,6-диаминогексановая кислота, лат. lysin) — алифатическая аминокислота с выраженными свойствами основания. Как и другие алифатические аминокислоты, лизин в организме человека не синтезируется и является незаменимой аминокислотой.
| Лизин | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
2,6-диаминогексановая кислота | ||
| Сокращения |
Лиз, Lys, K AAA,AAG |
||
| Хим. формула | HO2CCH(NH2)(CH2)4NH2 | ||
| Рац. формула | C6H14N2O2 | ||
| Физические свойства | |||
| Молярная масса | 146,19 г/моль | ||
| Классификация | |||
| Рег. номер CAS | 70-54-2 | ||
| PubChem | 866 | ||
| Рег. номер EINECS | 200-740-6 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 25094 | ||
| ChemSpider | 843 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Химическая формула: C6H14N2O2.
В ДНК кодируется последовательностями AAA и AAG.
Входит в состав белков.
Биосинтез
Подобно другим незаменимым аминокислотам, лизин в животных организмах не синтезируется и должен поступать с пищей в составе растительных белков.
Растениями и бактериями лизин синтезируется из аспартата[1].
Промышленный синтез
С 1960-х лизин синтезировался из сахара и сои ферментацией, в 2010 году мировое производство составило 700 тыс. тонн.
Позже разрабатывались технологические процессы на базе метанола.[2][3]
В Советском Союзе разработками технологий производства лизина занимались в Институте микробиологии и вирусологии им.А.Кирхенштейна под руководством академика Латвийской академии наук Риты Александровны Кукайн и член-корреспондент АН Латвийской ССР Мартина Екабовича Бекера. В лаборатории "Биотехнологии" Улдиса Виестурса была разработана технология промышленного синтеза лизина для животноводства, которая была внедрена на Ливанском опытном биохимическом заводе, строительство которого началось в 1965 году.[4] Многие технологические наработки лаборатории "Биотехнологии" были внедрены на других биохимических заводах Советского Союза, в частности, на Трипольском БХЗ под Киевом, производительностью 10 тыс. т в год (конец 80-х). Методами современной селекции латвийские учёные вывели высокопродуктивные штаммы бактерий-мутантов Brevibacterium flavum, накапливающих до 80 граммов лизина на литр питательной среды. В свое время это был наивысший показатель в мировой практике, который превышал предыдущий рекорд, 60 граммов с одного литра питательной среды, который принадлежал японцам[5]. В лаборатории "Биотехнологии" был разработан также "Способ полунепрерывного культивирования продуцентов лизина" (Виестур У., Швинка Ю., Бабурин Л. Саксе А.), который позволяет повысить производительность промышленного оборудования на 20-30%.
Метаболизм
У млекопитающих лизин метаболизируется в ацетилкофермент А трансаминированием с α-кетоглутаровой кислотой.
Бактерии разлагают лизин в кадаверин декарбоксилированием[6].
Производное лизина — аллизин — используется клетками в синтезе эластина и коллагена с помощью фермента лизилоксидаза[7].
Диетологические рекомендации
Суточная потребность в лизине[8][9][10]:
| младенцы 3-4 мес | 103 мг/кг |
| дети 2 лет | 64 мг/кг |
| дети 10-12 лет | 44−60 мг/кг |
| взрослые от 19 лет | 30−38 мг/кг (ранее — 12) |
В БАД используют гидрохлорид лизина, массовая доля лизина в нём 80,03 %[11]
Медицинское значение
В статье 1978 года утверждалось, что эта аминокислота оказывает противовирусное действие, особенно в отношении вируса, вызывающего герпес[12]. Позже корректно поставленные исследования на людях и животных показали, что лизин не эффективен при лечении герпеса. Однако, несмотря на то, что исследования на людях были проведены корректно, в них участвовал всего 21 пациент, а доза принимаемого лизина была ниже 29 % от адекватного уровня потребления.[13][14]
Исследования, проведённые на животных, показали, что недостаток лизина вызывает иммунодефицитные состояния.[15]
Лизин понижает уровень триглицеридов в сыворотке крови. Лизин в сочетании с пролином и витамином С предупреждает образование липопротеинов, вызывающих закупорку артерий.[16]
Дефицит лизина неблагоприятно сказывается на синтезе белка, что приводит к утомляемости, усталости и слабости, плохому аппетиту, замедлению роста и снижению массы тела, неспособности к концентрации, раздражительности, кровоизлияниям в глазное яблоко, потере волос, анемии и проблемам в репродуктивной сфере.[17]
Считается, что лизин увеличивает выработку гормона роста, но научного подтверждения этому нет, известно только, что выработку гормона роста увеличивает комплекс аминокислот, сравнение эффекта от коктейля аминокислот с лизином и без него не проводились.[18]
Большие дозы лизина улучшают усвоение кальция.[18]
Применение
У людей используется в качестве БАД, эффективен при занятиях спортом и фитнесом (физкультурой), поскольку используется в биосинтезе мышечного белка.[18]
Синтетический лизин применяют для обогащения кормов животных.[3]
Пищевые источники
Хорошими источниками лизина являются яйца, мясо (особенно красное мясо, баранина, свинина и птица), соя, фасоль, горох, сыр (особенно пармезан), некоторые виды рыбы (такие как треска и сардина)[19], моллюски. В большинстве злаков низкое содержание лизина, однако содержание лизина очень высоко в бобовых. Гречка, относящаяся к псевдозерновым, так же содержит относительно большое количество лизина (460 мг/100г).[20]
Примечания
- MetaCyc Pathway: L-lysine biosynthesis I
- AllAboutFeed - News: Norwegian granted for improving lysine production process (англ.) (недоступная ссылка). AllAboutFeed.net. Reed Business bv. (26 января 2010). Дата обращения: 1 мая 2018. Архивировано 11 марта 2012 года.
- Toride Y. Lysine and other amino acids for feed: production and contribution to protein utilization in animal feeding. Дата обращения: 25 января 2011.
- Латвийский лизин // Ригас Балсс : рижская городская газета. — 1965. — 15 апреля (№ 88). — С. 2.
- С.Ильичёва. Государственная премия СССР латвийским учёным // Советская Латвия : газета. — 1979. — 8 марта. — С. 1.
- Шорина, Марина Владимировна. Аккумуляция кадаверина и его физиологическая роль при действии солевого стресса. — 2005-01-01.
- Pinnell, SR; Martin, G.R. The cross-linking of collagen and elastin: enzymatic conversion of lysine in peptide linkage to alpha-aminoadipic-delta-semialdehyde (allysine) by an extract from bone (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1968. — October (vol. 61, no. 2). — P. 708—713. — doi:10.1073/pnas.61.2.708. — PMID 5246001.
- Energy and protein requirements: 5.6 Requirements for essential amino acids. Дата обращения: 10 октября 2010.
- FAO/WHO/UNU. PROTEIN AND AMINO ACID REQUIREMENTS IN HUMAN NUTRITION (PDF). WHO Press (2007)., page 150—152
- Institute of Medicine. Protein and Amino Acids // Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (англ.). — Washington, DC: The National Academies Press, 2002. — P. 589—768.
- Dietary Supplement Database: Blend Information (DSBI). — «L-LYSINE HCL 10000820 80.03% lysine».
- Griffith R.S., Norins A.L., Kagan C. A multicentered study of lysine therapy in Herpes simplex infection (англ.) // Dermatologica : journal. — 1978. — Vol. 156, no. 5. — P. 257—267. — doi:10.1159/000250926. — PMID 640102.
- John J. DiGiovanna, MD; Harvey Blank, M.D. Failure of Lysine in Frequently Recurrent Herpes Simplex Infection: Treatment and Prophylaxis (англ.) // Dermatology : journal. — 1984. — January (vol. 120, no. 1). — P. 48—51. — doi:10.1001/archderm.1984.01650370054010.
- Sebastiaan Bol, Evelien M Bunnik. Lysine supplementation is not effective for the prevention or treatment of feline herpesvirus 1 infection in cats: A systematic review (англ.) // BMC Veterinary Research : journal. — 2015. — November (vol. 11, no. 1). — P. 284. — doi:10.1186/s12917-015-0594-3.
- Chen C., Sander J.E., Dale N.M. The effect of dietary lysine deficiency on the immune response to Newcastle disease vaccination in chickens (англ.) // Avian Dis. : journal. — 2003. — Vol. 47, no. 4. — P. 1346—1351. — doi:10.1637/7008. — PMID 14708981.
- Ivanov V., Roomi M.W., Kalinovsky T., Niedzwiecki A., Rath M. Anti-atherogenic effects of a mixture of ascorbic acid, lysine, proline, arginine, cysteine, and green tea phenolics in human aortic smooth muscle cells (англ.) // J. Cardiovasc. Pharmacol. : journal. — 2007. — March (vol. 49, no. 3). — P. 140—145. — doi:10.1097/FJC.0b013e3180308489. — PMID 17414225.
-
- Rushton D.H. Nutritional factors and hair loss (неопр.) // Clinical and Experimental Dermatology. — 2002. — July (т. 27, № 5). — С. 396—404. — PMID 12190640.
- Zhu X., Galili G. Lysine metabolism is concurrently regulated by synthesis and catabolism in both reproductive and vegetative tissues (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2004. — May (vol. 135, no. 1). — P. 129—136. — doi:10.1104/pp.103.037168. — PMID 15122025.
- Ira Wolinsky, Judy A. Driskell. Nutritional Ergogenic Aids. — CRC Press, 2004. — P. 178—196. — 552 p.
- University of Maryland Medical Center. Lysine. Дата обращения: 30 декабря 2009. Архивировано 25 июля 2013 года.
- Young V.R., Pellett P.L. Plant proteins in relation to human protein and amino acid nutrition (англ.) // The American Journal of Clinical Nutrition : journal. — 1994. — P. 1206S. — PMID 8172124.