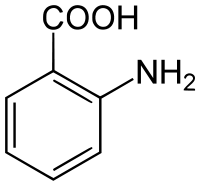
Антраниловая кислота
Антраниловая кислота (лат. Acidum anthranilicum) — ароматическая аминокислота.
| Антраниловая кислота | |
|---|---|
 | |
| Общие | |
| Хим. формула | C7H7NO2 |
| Физические свойства | |
| Молярная масса | 137,138 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 147 °C[1] |
| Классификация | |
| Рег. номер CAS | 118-92-3 |
| PubChem | 227 |
| Рег. номер EINECS | 204-287-5 |
| SMILES | |
| InChI | |
| RTECS | CB2450000 |
| ChEBI | 30754 |
| ChemSpider | 222 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Производные антраниловой кислоты применяются в производстве красителей и синтетических душистых веществ.
Физические свойства
При нормальных условиях антраниловая кислота представляет из себя бесцветные кристаллы; температура плавления 145 °C; возгоняется.
Растворимость (г в 100 г растворителя): в воде — 0,35 (14 °C), 90%-ном этаноле — 10,7 (9,6 °C), бензоле — 1,8 (12 °C), также, хорошо растворима в горячих хлороформе, этаноле, пиридине.
Соли антраниловой кислоты с щелочными металлами, а также минеральными кислотами хорошо растворимы в воде; растворы обладают голубой флуоресценцией.
Нижний концентрационный предел воспламенения 44 г/м3, температура воспламенения 100 °C.
Химические свойства
Антраниловая кислота обладает амфотерными свойствами (lgK1 = 5 , lgK2= 12).
При перегонке антраниловой кислоты декарбоксилируется до анилина:
Она образует с Cd, Со, Cu (II), Ni, Zn, Pb и Hg в уксуснокислых растворах (рН 2,5-5) внутрикомплексные малорастворимые соединения, которые используются для гравиметрического определения перечисленных элементов.
Диазотирование антраниловой кислоты приводит к о-диазобензойной кислоте (является внутренней солью), которая при УФ-облучении образует дегидробензол.
Качественные реакции
Цветные реакции для антраниловой кислоты:
С солями Cu(II) в уксуснокислой среде образует ярко-зеленый осадок (мета-аминобензойная кислота дает голубое окрашивание); в отличие от мета- и пара-аминобензойных кислот, при сплавлении с небольшим избытком SnCl4 и обработке охлажденного плава водным раствором спирта появляется фуксино-красная окраска.
Получение
Промышленные методы получения
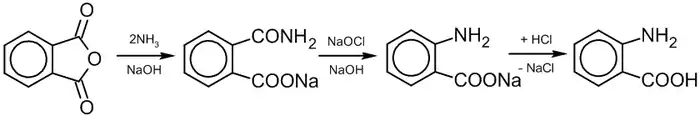
Антранилат натрия получают действием водного раствора NH3 на фталевый ангидрид (рН 7,5-8,5; 40 °C) и последующим взаимодействием полученной натриевой соли фталаминовой кислоты с раствором гипохлорита натрия при 60 °C (расщепление по Гофману). На полученую соль воздействуют разбавленной соляной кислотой, в результате чего получаются антраниловая кислота:
.
Лабораторные методы синтеза
Первоначально получают фталимид, действуя на фталевый ангидрид мочевиной с выделением воды. Реакция происходит при 130-135 °C и постепенным поднятием до 160 °C.
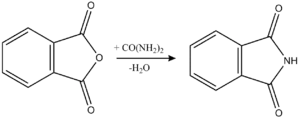
Следующей стадией получения антраниловой кислоты является воздействие на фталимид гидроксидом натрия и бромом, а после - нейтрализуют раствор соляной кислотой осаждают антранилат натрия ледяной уксусной кислотой.
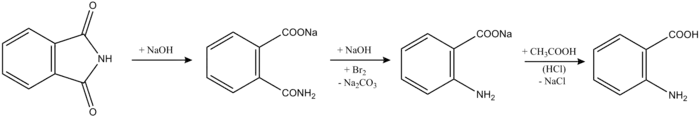
Применение
Антраниловая кислота является промежуточным продуктом при синтезе индиго и других азокрасителей. Производные применяют в производстве азокрасителей и душистых веществ. Для парфюмерии наиболее важны эфиры — метилантранилат (R = CH3) и этилантранилат (R = С2Н5) имеющие запах цветов апельсинового дерева.
Антраниловой кислотой при рафинации хлопкового масла высаживают токсичный полифенол госсипол, присутствие которого препятствует употреблению данного масла в пищу.
Примечания
Ссылки
Химическая Энциклопедия. Т. 1., Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988
Дополнительная литература
- Белов В. И. Химия и технология душистых веществ, М., 1976
- Петрова Р. А., Потапова Т. И. Многостадийные синтезы. Методические указания для лабораторного практикума по органической химии.
- Ullmanns Encyklopadie, 4 Aufl., Bd. 8, Weinheim, 1974, S. 374-75
