Галловая кислота
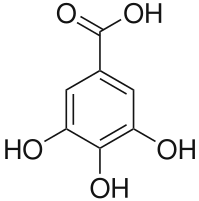
Га́лловая кислота́ (3,4,5-триоксибензойная кислота или 3,4,5-тригидроксибензойная кислота) — органическая кислота, в природе встречающаяся в чае, дубовой коре, тунбергии, дубильных экстрактах.
| Галловая кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
3,4,5-триоксибензойная или 3,4,5-тригидроксибензойная кислота |
| Хим. формула | C7H6O5 |
| Физические свойства | |
| Молярная масса | 170,12 г/моль |
| Плотность | 1,694 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 240 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,16 г/100 мл |
| • в воде (при 100 °C) | 33 г/100 мл |
| • в этаноле | 27,2 г/100 мл |
| • в эфире (при 15 °C) | 2,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | 149-91-7 |
| PubChem | 370 |
| Рег. номер EINECS | 205-749-9 |
| SMILES | |
| InChI | |
| RTECS | LW7525000 |
| ChEBI | 30778 |
| ChemSpider | 361 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
История
Галловая кислота была открыта Карлом Шееле в 1786 году в вытяжках из чернильных орешков (галлов, наростов на дубовых листьях) из-за чего её раньше называли также орешковой кислотой[1].
Свойства
Образует кристаллогидрат с одной молекулой воды (C7H6O5·H2O) — бесцветные кристаллы, темнеющие на свету. Галловая кислота хорошо растворима в кипящей воде, спирте, хуже — в эфире, плохо — в холодной воде; константа диссоциации К = 3,9·10−5 (25 °C).
При нагревании (100—120 °C) галловая кислота теряет воду; tпл безводной галловой кислоты равна 240 °C (с разложением).
Восстанавливает соли серебра и золота до металлов, ионы железа Fe3+ до Fe2+.
С хлорным железом даёт сине-чёрное окрашивание. При нагревании с концентрированной серной кислотой образует гексагидроксиантрахинон (руфигалловую кислоту).
При сухой перегонке галловой кислоты (в токе углекислого газа над пемзой при 190—215 °C) происходит её декарбоксилирование с образованием пирогаллола: C6H2(OH)3COOH → C6H3(OH)3 + CO2.
Нахождение в природе
Сложные эфиры галловой кислоты содержатся в дубильных веществах и танине, которые находятся в чернильных орешках, листьях чая и сумаха, в дубовой коре, гвоздике, в почках берёзы Betula pendula Roth, коре корней гранатника.
Получение
Соединение получают щелочным и ферментативным гидролизом танинов.
Применение
Галловую кислоту применяют:
- в аналитической химии как реагент для фотометрического определения трёхвалентных висмута и церия,
- для синтеза красителей (антрагаллола, галлофлавина и др.) и лекарственных препаратов,
- в микроскопии,
- как деполяризатор при использовании методов электрохимического анализа,
- как цветообразователь в термочувствительной фотокопировальной бумаге,
- для синтеза пирогаллола.
Сложные эфиры галловой кислоты являются антиоксидантами.
Литература
- Ow Y. Y., Stupans I. Gallic acid and gallic acid derivatives: effects on drug metabolizing enzymes (англ.) // Curr. Drug Metab. : journal. — 2003. — June (vol. 4, no. 3). — P. 241—248. — PMID 12769668.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.
- Артамонова Н. Н. Галловая кислота // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 482—483. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- Лазурьевский Г. В., Терентьева Е. В., Шамшурин А. А. Практические работы по химии природных соединений. — М.: Высшая школа, 1966.
Примечания
- Менделеев Д. И., Тищенко В. Е. Галловая (или орешковая) кислота // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
